чем скрепляют грудину после шунтирования
Способ фиксации грудины после аортокоронарного шунтирования у больных с ишемической кардиомиопатией
Владельцы патента RU 2480171:
Изобретение относится к области медицины, а именно к сердечно-сосудистой хирургии, и может найти применение при операциях на органах средостения и грудной клетки у больных с ишемической кардиомиопатией, а также осложненных сахарным диабетом, ХОБЛ, остеопорозом, ожирением. Сущность способа состоит в сшивании рукоятки и тела грудины через 2, 3, 4, 5 межреберные промежутки. При этом для сшивания используют эластичные капроновые мононити. Сначала через первый межреберный промежуток накладывают два шва с двумя витками, охватывающие края рассеченной рукоятки грудины. Для сшивания тела грудины накладывают по одному шву с двумя витками в каждом из следующих межреберных промежутков. Использование данного изобретения обеспечивает уменьшение травмирования, уменьшение возможности появления послеоперационных остеомиелитов и хондроперихондритов, прочную фиксацию частей грудины, отсутствие необходимости в повторном оперативном вмешательстве с целью удаления фиксирующих материалов. 1 ил., 1 пр.
Предлагаемое изобретение относится к медицине, а именно к сердечно-сосудистой хирургии, и может быть использовано для лечения сагиттального рассечения грудины, применяемого при операциях на органах средостения и грудной клетки у больных с ишемической кардиомиопатией.
Наиболее близким к заявляемому изобретению является способ фиксации грудины, принятый в качестве прототипа, заключающийся в следующем: используют проволоку, которую проводят под грудиной и охватывают обе части грудины в межреберных пространствах. Скручивая свободные концы проволоки, стягивают обе части грудины до их соприкосновения и тем самым фиксируют их в этом положении до заживления, причем проволоку проводят через рукоятку грудины [Гаджиев С.А., Догель Л.В., Ваневский В.Л. Диагностика и хирургическое лечение миастении. «Медицина», Ленинградское отделение. 1971. С.158-160].
Задачей изобретения является разработка способа, позволяющего проводить надежное соединение краев грудины у больных с ишемической кардиомиопатией.
Указанный технический результат достигается тем, что в способе фиксации грудины, включающем сшивание рукоятки и тела грудины через 2, 3, 4, 5 межреберные промежутки, согласно изобретению для сшивания используют эластичные капроновые мононити, причем сначала через первый межреберный промежуток накладывают два шва с двумя витками, охватывающие края рассеченной рукоятки грудины, а для сшивания тела грудины накладывают по одному шву с двумя витками в каждом из следующих межреберных промежутков.
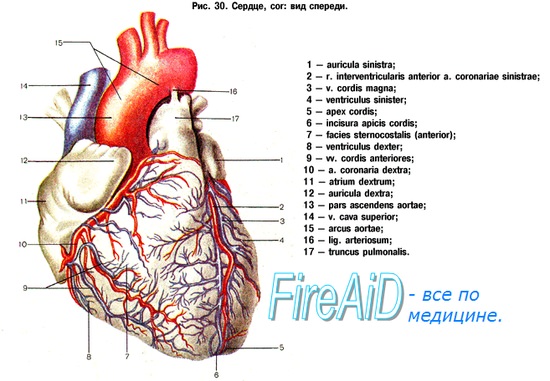
Предлагаемый способ фиксации грудины осуществляется следующим образом: на поверхность рассеченной грудины 1, через первый межреберный промежуток 5 накладывают два капроновых шва с двумя витками, охватывающие края рассеченной рукоятки грудины 1. Затем через 2, 3, 4, 5 межреберные промежутки 5, охватывая боковые стороны тела рассеченной грудины 1, проводят четыре капроновых шва 4 с двумя витками каждый. На дистальную часть грудины у мечевидного отростка накладывают один шов через межреберный промежуток. После наложения швов производят сведение краев рассеченной грудины 1 с одномоментным стягиванием и связыванием капроновых швов 4 поочередно. Мягкие ткани сшивают по стандартной методике.
По сравнению с методами, выполняющими аналогичную функцию, предлагаемый способ обладает следующими преимуществами:
— простота техники, позволяющая сократить время оперативного вмешательства, уменьшить стоимость используемых материалов;
— надежность фиксации частей грудины при одновременном уменьшении травматичности способа у больных с ишемической кардиомиопатией;
— профилактика остеомиелитов и хондроперихондритов в послеоперационном периоде;
— отсутствие необходимости в повторном оперативном вмешательстве с целью удаления фиксирующих материалов.
Больная Д, 63 лет, с диагнозом ИБС. Стенокардия ФК 3. Постинфарктный (2010 г.) кардиосклероз. Осл.: ХСН 3, ФК 3. Вторичная ишемическая кардиомиопатия. Соп.: Гипертоническая болезнь 2 ст., 2 степени, риск 4. Сахарный диабет 2 типа, средней степени тяжести, субкомпенсация. В отделении сосудистой хирургии РКД г.Уфы была проведена операция: аорто-коронарное (ЗМЖА, ОА), маммаро-коронарное (ПМЖА) шунтирование в условиях искусственного кровообращения. Перикард ушивался отдельными узловыми капроновыми швами, грудина ушивалась отдельными швами из стальной проволоки. Мягкие ткани ушивались по стандартной методике. Операция и ранний послеоперационный период проходили без осложнений. Клинические анализы и температура тела были в пределах нормы. В первые дни после операции беспокоил кашель. На 6-е сутки после операции в области швов стало наблюдаться постоянное поступление серозного отделяемого (посев показал стерильность отделяемого), пальпаторно стала определяться нестабильность грудины.
Края грудины разведены до 2 см, хрящевые наложения удалены ложкой Фолькмана. Через 1-й межреберный промежуток, охватывая края рукоятки грудины, проведены 2 шва с двумя витками капроновой мононитью, через 2, 3, 4, 5 межреберные промежутки проведены по 1 шву с двумя витками капроновой мононитью в каждом из межреберных промежутков. После чего края грудины были сведены, швы стянуты. Мягкие ткани и кожа ушиты отдельными узловыми капроновыми швами через все слои.
Операция продолжалась около 50 минут. Больная была переведена под наблюдение в отделение реанимации, экстубирована. Послеоперационный период протекал без осложнений, нестабильности грудины, отделяемого из раны, явлений воспаления не наблюдалось. На 11-е сутки после реостеосинтеза пациентке удалены кожные швы, после чего она была выписана домой в удовлетворительном состоянии.
Способ фиксации грудины, включающий сшивание рукоятки и тела грудины через 2, 3, 4, 5 межреберные промежутки, отличающийся тем, что для сшивания используют эластичные капроновые мононити, причем сначала через первый межреберный промежуток накладывают два шва с двумя витками, охватывающие края рассеченной рукоятки грудины, а для сшивания тела грудины накладывают по одному шву с двумя витками в каждом из следующих межреберных промежутков.
Чем скрепляют грудину после шунтирования
Стенокардия является отражением ишемии миокарда (ишемической болезни сердца — ИБС). Больные часто описывают свои ощущения как сдавление, удушье и стеснение в груди. Стенокардия обычно вызывается дисбалансом между снабжением миокарда кислородом и потребностью в нем. Классическим представителем заболевания является мужчина (мужчины страдают ИБС в 4 раза чаще женщин), убирающий холодным поздним вечером снег после плотного ужина и драки с женой.
2. Как лечится стенокардия?
Лечение стенокардии заключается в лекарственной терапии или реваскуляризации миокарда. Лекарственная терапия направлена па снижение потребности миокарда в кислороде. Стратегическое лечение включает нитраты (нитроглицерин, изосорбид), которые минимально расширяют коронарные артерии, по также снижают артериальное давление (постнагрузку) и, следовательно, потребность миокарда в кислороде; бета-адреноблокаторы, снижающие частоту сердечных сокращений, сократительную способность сердца и постнагрузку; и блокаторы кальциевых каналов, снижающие ностнагрузку и предотвращающие спазмирование коронарных артерий.
Важную роль также играет аспирин (антитромбоцитарное действие).
Если стенокардия резистентна к лекарственной терапии, может потребоваться реваскуляризация миокарда путем чрескожной чреспросветной коронаропластики (ЧЧКП) с установкой стента или без таковой либо аортокоронарное шунтирование (АКШ).
3. Каковы показания к АКШ?
а) Стеноз левой коронарной артерии. Стеноз левой коронарной артерии более чем па 50% является плохим прогностическим фактором для больных, получающих лекарственную терапию. Левая коронарная артерия кровосиабжает значительную часть миокарда, поэтому ЧЧКП очень рискованна. Даже у асимитоматичиых больных коэффициент выживаемости значительно повышается после АКШ.
б) ИБС с поражением трех сосудов (70% стеноз) и с угнетением функции левого желудочка или ИБС с поражением двух сосудов и проксимальной части передней нисходящей ветви левой коронарной артерии. Рандомизированные исследования показали, что у больных с трехсосудистым поражением и угнетением функции левого желудочка выживаемость после АКШ гораздо выше, чем при лекарственной терапии.
АКШ также обеспечивает более высокую выживаемость при двухсосудистом поражении и стенозе проксимальной части передней нисходящей ветви левой коронарной артерии в 95% и более. Однако серьезную проблему представляют больные с угнетенной функцией левого желудочка: так при исходном снижении фракции выброса ниже 30% оперативная летальность повышается.
в) Стенокардия, резистентная к интенсивной лекарственной терапии. Больные, имеющие ограничения в образе жизни из-за ИБС, являются кандидатами на АКШ. Результаты хирургических вмешательств на коронарных артериях показывают, что у прооперированных больных менее выражены симптомы стенокардии, в меньшей степени ограничена жизненная активность и объективно повышается толерантность к физической нагрузке но сравнению с больными, получающими лекарственную терапию.
4. В чем заключается АКШ?
Аорто-коронарное шунтирование (АКШ) является шунтирующей операцией, которая может выполняться как в условиях экстракорпорального кровообращения, так и без пего. Левая внутренняя маммарная артерия выполняет роль трубчатого трансплантата. Экстракорпоральное кровообращение подключается путем канюляции восходящей аорты и правого предсердия, а сердце останавливается путем холодовой кардиоплегии.
Сегменты большой подкожной вены ноги разворачиваются и сшиваются с проксимальной (приточной) частью обходного анастомоза, берущего начало из восходящей аорты, а периферическая (отточная) часть обходного анастомоза соединяется с коронарной артерией дистальнее места облитерации.
Левая внутренняя маммарная артерия обычно сшивается с проксимальной частью передней нисходящей ветви левой коронарной артерии. Когда наложение анастомозов закончено, восстанавливается самостоятельное кровообращение, и разрез грудной клетки зашивается. Обычно накладывается 1-6 шунтов (отсюда термины «тройное» или «четвертное» шунтирование).
5. Улучшает ли АКШ функцию миокарда?
Да. При помощи аорто-коронарного шунтирования (АКШ) улучшается функция гибернирующего миокарда. Под гибернацией миокарда понимают обратимое снижение контрактильной функции сердечной мышцы, вызванное недостаточностью коронарного кровотока, при сохранении жизнеспособности миокарда. У некоторых больных с общей систолической дисфункцией миокарда после АКШ наблюдается значительное улучшение его сократительной функции.
6. Помогает ли АКШ при застойной сердечной недостаточности?
Иногда. АКШ облегчает симптомы застойной сердечной недостаточности, вызванные ишемической дисфункцией миокарда. Напротив, если сердечная недостаточность вызвана длительно существующей инфарктной зоной (постинфарктным рубцом), АКШ не дает хороших результатов. Во время предоперационного обследования необходимо оценить жизнеспособность нефункционирующего миокарда. Остаточное перераспределение радиоизотопа при таллийном сканировании помогает определить еще жизнеспособные сегменты миокарда.
7. Помогает ли АКШ предотвратить желудочковые аритмии?
Нет. Большинство желудочковых аритмий при ИБС возникают на границе возбудимого миокарда, окружающего зону инфаркта. Больным с жизнеугрожающими желудочковыми тахиаритмиями показана имплантация автоматического сердечного дефибриллятора (AICD).
8. В чем разница между ЧЧКП и АКШ?
Шесть рандомизированных контрольных клинических исследований были посвящены сравнению результатов ЧЧКП и АКШ. Хотя в совокупности исследование охватывало более 4700 больных, 75% из них, изначально удовлетворявших критериям отбора, впоследствии были исключены из исследования, поскольку страдали ИБС с поражением нескольких сосудов, когда проведение ЧЧКП не рекомендуется.
В результате этих исследований было выделено несколько важных фактов. В 5 из 6 проведенных исследований общие показатели летальности и заболеваемости инфарктом миокарда после АКШ и ЧЧКП не отличались. Только в одном из исследований, проведенном в Германии (German Angioplasty Bypass Surgery Investigational Study), общее количество смертей и случаев инфаркта миокарда в ближайшем послеоперационном периоде было выше в группе АКШ.
Основное различие между двумя стратегиями лечения заключалось в избавлении от стенокардии и необходимости повторных хирургических вмешательств. В общей сложности 40% больных, которым была выполнена ЧЧКП, потребовались повторные ЧЧКП или АКШ. В то же время только 5% больных после АКШ потребовались повторные операции. Также после АКШ приступы стенокардии развивались реже, чем после ЧЧКП.
Можно сделать бесспорный вывод, что рекомендации к проведению ЧЧКП или АКШ должны быть строго индивидуальны. Оба вида лечения не следует рассматривать как исключительные или противоречащие друг другу. Некоторым больным показано комбинация ЧЧКП и АКШ. АКШ позволяет достичь более стойкой реваскуляризации, хотя существует риск интраоперационных осложнений.
9. Какова примерная проходимость сосудов?
• Шунт из внутренней маммарной 90%-проходимость через 10 лет артерии
• Шунт из большой подкожной 50%-проходимость через 10 лет вены ноги
• ЧЧКП стенозированного сосуда 60%-проходимость через 6 месяцев
• ЧЧКП + стент 80%-проходимость через 6 месяцев
10. Каковы хирургические и технические проблемы, возникающие при АКШ?
Хирургические осложнения в широком смысле включают технические проблемы с наложением анастомоза, осложнения со стороны грудины и осложнения в области разреза после забора подкожной вены ноги. Технические проблемы с наложением анастомоза коронарной артерии приводят к инфаркту миокарда. Осложнения со стороны грудины обычно закапчиваются сепсисом и полиорганной недостаточностью. Разрезы на ноге при заборе большой подкожной вены в послеоперационном периоде могут вызвать отек, инфекцию и боль в конечности.
11. Каков риск АКШ? Какие сопутствующие факторы повышают оперативный риск АКШ?
Оценка оперативного риска является важнейшей задачей хирурга перед реваскуляризацией. Общество торакальных хирургов и Совет Ветеранов разработали и внедрили две большие базы данных. К факторам, повышающим оперативный риск при АКШ, относятся пониженная фракция выброса левого желудочка до операции (экстренной или плановой), возраст больного, заболевания периферических сосудов, хроническое обструктивное заболевание легких и декомпенсированная сердечная недостаточность к моменту операции.
Эти сопутствующие факторы имеют наиболее важное значение для исхода операции. Проще говоря, общие показатели летальности при АКШ могут ввести в заблуждение. Так, хирург А и хирург Б могут выполнять идентичные операции, но иметь различные показатели общей летальности, если хирург А оперирует молодых атлетов, страдающих ИБС, а хирург Б — пожилых людей с пассивным образом жизни, повышенного питания и выкуривающих по 2 пачки сигарет в день. Оценка сопутствующих факторов риска дает более точное представление, насколько наблюдаемый исход операции был прогнозируем.
12. Какие действия следует предпринять, если больного не удается отключить от экстракорпорального кровообращения?
Фактически хирург имеет дело с шоком. Как и в случае с гиповолемическим шоком (при огнестрельном повреждении аорты), основные мероприятия заключаются в следующем:
а) Восстановление объема циркулирующей крови до оптимальных значений давления наполнения в левом и правом желудочках.
б) После нормализации давления наполнения начните инотропную поддержку.
в) Введите струйно инотропный препарат до появления признаков интоксикации (обычно желудочковой тахиаритмии) и начните внутриаортальную баллонную контриульсацию. Последним шагом является введение вспомогательных устройств для левого и/или правого желудочка. Они могут поддержать кровообращение, способствуя функциональному восстановлению миокарда.
13. Все ли артериальные шунты имеют преимущество при реваскуляризации?
Сделанный на основании наблюдений логический вывод, что внутренняя маммарная артерия сохраняет более высокую проходимость по сравнению с подкожной веной ноги, пробудил интерес к тотальной артериальной реваскуляризации. Вместо подкожных вен ног некоторые хирурги в качестве шунтов используют правую внутреннюю маммарную артерию, желудочно-сальниковую артерию и лучевую артерию.
Убедительные данные свидетельствуют о том, что использование в качестве шунта левой внутренней маммарной артерии значительно снижает легальность и сокращает количество рецидивов стенокардии. Данные, свидетельствующие в пользу тотальной артериальной реваскуляризации, не столь очевидны.
14. Обязательно ли при АКШ «разрезать больного пополам»? Существуют ли менее инвазивные хирургические методики?
Параллельно с внедрением минимально инвазивных хирургических методик в общей хирургии (например, лапароскопическая холицистэктомия), возник интерес к менее травматичным операциям на коронарных артериях. Сейчас возможно выполнить АКШ без экстракорпорального кровообращения через небольшой разрез грудины. Эта методика получила название минимально инвазивного прямого аортокоронарного шунтирования (MIDCAB). Специальная платформа стабилизирует эпикардиальную поверхность коронарной артерии для наложения анастомоза.
Сердце продолжает биться под этой платформой и поэтому можно обойтись без экстракорпорального кровообращения.
По другой методике, называемой Heartpoit, кашоляция аорты и дренирование венозной системы осуществляется чрескожно. Троакары вводятся через небольшие разрезы. Подключается экстракорпоральное кровообращение, и анастомозы накладываются с помощью специальной камеры через небольшие торакоскопические порты. По-прежнему неизвестны отдаленные результаты минимально инвазивных методов шунтирования. Ранние сообщения свидетельствуют о значительно большем количестве окклюзий шунтов, а значит, результаты реваскуляризации новыми методами могут быть хуже, чем после традиционных вмешательств.
15. Какие виды лечения применяются у больных с упорной стенокардией, которым не показано АКШ?
Для больных с оптимально подобранной лекарственной терапией, которым не показано АКШ (из-за тяжелой сопутствующей патологии или неудовлетворительного состояния коронарной артерии для шунтирования) альтернативным методом лечения является трансмиокардиальная реваскуляризация. При трансмиокардиальной реваскуляризации используется лазер для прожигания небольших отверстий из эндокарда в эпикард.
Хотя раньше считалось, что лазер доставляет кровь из эндокардиальной капиллярной сети в миокард, многочисленные наблюдения доказывают, что образуемые лазером каналы тромбируются в течение 24 часов и впоследствии окклюзируются. Таким образом, предполагается, что энергия лазера вызывает воспалительную реакцию с возрастанием роли ангиогенных факторов (фактор роста эндотелия сосудов, бета-фактор роста опухолей, фибробластический фактор роста). Хотя многообещающие экспериментальные данные говорят в пользу трансмиокардиалыюй реваскуляризации, широкомасштабные клинические исследования еще не закончены.
Учебное видео кровоснабжения сердца (анатомии артерий и вен)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Чем скрепляют грудину после шунтирования
Ростовский государственный медицинский университет, Ростов-на-Дону, Россия
Центр кардиохирургии ГБУ Ростовской области «Ростовская областная клиническая больница №1»
Сравнительная эффективность различных методов остеосинтеза грудины после аортокоронарного шунтирования у больных ишемической болезнью сердца на фоне избыточной массы тела
Журнал: Кардиология и сердечно-сосудистая хирургия. 2013;6(5): 38-41
Дюжиков А. А., Карташов А. А. Сравнительная эффективность различных методов остеосинтеза грудины после аортокоронарного шунтирования у больных ишемической болезнью сердца на фоне избыточной массы тела. Кардиология и сердечно-сосудистая хирургия. 2013;6(5):38-41.
Dyuzhikov A A, Kartashov A A. Comparative efficacy of different sternum osteosynthesis techniques in obese patients with coronary heart disease after coronary artery bypass grafting. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2013;6(5):38-41.
Ростовский государственный медицинский университет, Ростов-на-Дону, Россия
Проведен сравнительный анализ использования для остеосинтеза грудины после операции аортокоронарного шунтирования полиамидной монофиламентной нити (35 больных) и стальной проволоки (50 больных) у пациентов с ишемической болезнью сердца и ожирением. Доказано, что проведение остеосинтеза грудины капроном по сравнению с традиционным способом с помощью проволоки сопровождается снижением частоты развития инфекционных осложнений после срединной стернотомии и числа случаев нестабильности грудины, ограничением воспалительных реакций с развитием лейкоцитоза, сокращением сроков пребывания больных в стационаре, снижением объема антибиотикотерапии и выраженности боли в грудине в отдаленном послеоперационном периоде.
Ростовский государственный медицинский университет, Ростов-на-Дону, Россия
Центр кардиохирургии ГБУ Ростовской области «Ростовская областная клиническая больница №1»
Операция аортокоронарного шунтирования (АКШ) — одна из самых частых среди кардиохирургических вмешательств. Наиболее удобным и распространенным доступом при выполнении АКШ является срединная стернотомия, предоставляющая для кардиохирурга наибольшую свободу действий [1]. Тем не менее в ходе операции происходят травматическое повреждение грудной клетки, перикарда и сосудов, нарушение каркасности грудной клетки, выделение внутренней грудной артерии, что усложняет заживление и ухудшает качество жизни пациентов. По данным отечественных авторов [3], осложнения срединной стернотомии у больных ишемической болезнью сердца (ИБС) после АКШ развиваются в 0,5—5,9% случаев. По результатам исследования зарубежных авторов, такие послеоперационные осложнения срединной стернотомии, как несостоятельность шва грудины, острый медиастинит и остеомиелит грудины и ребер, составляют 0,4—6% [5, 11, 12]. При этом в случае развития послеоперационного медиастинита летальность пациентов достигает 14—47% [2, 6].
Для остеосинтеза грудины после срединной стернотомии используют различные методики и материалы. Наиболее распространен шов грудины стальной проволокой [11]. Однако не существует единого стандарта в вопросе выбора методики остеосинтеза грудины. Указания в литературе на альтернативные способы соединения грудины носят рекомендательный характер, несмотря на то что опыт применения новых методов указывает на удовлетворительные результаты [9]. Многие современные способы стабилизации грудины эффективны, но дорогостоящи, поэтому мы рассматриваем два наиболее удобных и распространенных способа: использование металлической проволоки и полиамидной монофиламентной нити.
В настоящее время выявлены закономерности и факторы риска развития послеоперационной инфекции грудины и ее расхождения у больных ИБС после АКШ [7, 8, 10]. Однако необходимы дополнительные исследования по обоснованию сравнительной эффективности различных методов закрытия срединной стернотомии и стратегии профилактики осложнений после операций на открытом сердце при сопутствующих заболеваниях пациентов. Поиск новых высокотехнологичных материалов для остеосинтеза грудины у больных ИБС на фоне ожирения и нарушений углеводного обмена позволит повысить качество лечения больных с сердечно-сосудистыми заболеваниями, предупредить развитие опасных осложнений, что подчеркивает актуальность исследования.
Материал и методы
В исследование вошли 85 больных с ИБС и ожирением, которым выполнялись операции шунтирования коронарных артерий (в условиях искусственного кровообращения и фармакохолодовой кардиоплегии раствором кустодиола). У 35 больных (основная группа) остеосинтез грудины после АКШ выполняли полиамидной монофиламентной нитью Мединж №8. У 50 больных (контрольная группа) остеосинтез проводили традиционно: при стабилизации грудины использовали стальную проволоку.
Для оценки степени ожирения рассчитывали индекс массы тела (ИМТ). Уровень гликированного гемоглобина в крови определяли методом ионно-обменной хроматографии на микроколонках («Boehringer Mancheim», Австрия). Расчет индекса инсулинорезистентности у больных проводили по методу НОМА (homeostasis model assessment). У всех больных определяли свободную и связанную фракции воды в компонентах крови термогравиметрическим методом [4].
Статистический анализ данных исследования выполняли с помощью программы Statistica 7.0.
Результаты
Частота развития осложнений, связанных с зоной грудины, в зависимости от типа остеосинтеза грудины представлена в табл. 1.
Поверхностные гнойные раневые осложнения в основной группе встречались в 25,7% случаев, в основной группе — в 44%. Нестабильность грудины, а также медиастинит у пациентов при остеосинтезе грудины капроном не встречались. При традиционном остеосинтезе стальной проволокой прорезывание швов с развитием частичной или тотальной нестабильности грудины наблюдалось в 38% случаев, а медиастинит, потребовавший повторного хирургического вмешательства, — в 22%. Во всех случаях медиастинит был серозным. При традиционном остеосинтезе проволокой лихорадка (повышение температуры тела более 38 °С) возникла у 28% больных, при остеосинтезе монофиламентной нитью — у 11,4%. Таким образом, остеосинтез монофиламентной нитью сопровождается более низкой частотой развития инфекционных осложнений и нестабильности грудины. Использование капрона при остеосинтезе по сравнению со стальной проволокой обеспечивали также манипуляционные удобства для хирурга, меньшую вероятность травматизации рук хирурга, тем самым снижая возможность инфицирования во время операции. Анализ относительного риска показывает, что проведение остеосинтеза монофиламентной нитью было «защитным» фактором в отношении развития таких инфекционных осложнений, как прорезывание швов грудины с развитием частичной или тотальной нестабильности грудины, а также серозный медиастинит; влияние типа остеосинтеза на развитие этих осложнений было статистически значимым. В отношении развития поверхностных гнойных раневых осложнений и лихорадки статистически значимого влияния типа остеосинтеза грудины не обнаружено.
Динамику интенсивности боли в послеоперационный период у больных после АКШ в зависимости от типа остеосинтеза определяли в 1-ю неделю после операции, на 7—20-й день после хирургического вмешательства и через 6 мес. В 1-ю неделю после операции больные испытывали выраженную боль, причем межгрупповых различий в этот период в зависимости от типа остеосинтеза не наблюдалось: 8,4±0,3 и 8,7±0,2 балла в основной и контрольной группах соответственно. На госпитальном этапе наблюдения (7—20 дней после операции) при остеосинтезе грудины капроном средняя оценка интенсивности боли была выше, чем при сшивании грудины стальной проволокой (6,8±0,1 и 5,7±0,3 балла соответственно). Это можно объяснить тем, что при остеосинтезе капроном на первых этапах заживления стернотомной раны нет такой жесткости фиксации краев раны, как при использовании стальной проволоки. На отдаленном этапе наблюдения за больными при остеосинтезе капроном интенсивность боли (1,8±0,3 балла) была ниже, чем при традиционном остеосинтезе (3,9±0,2 балла). Это можно объяснить эффектом инородного тела при наличии стальной проволоки. Наличие стальной проволоки в отдаленном периоде затрудняет проведение компьютерной томографии для контроля качества остеосинтеза грудины. Между тем при остеосинтезе капроном проведение компьютерной томографии позволило контролировать эффективность остеосинтеза.
В совокупности инфекционно-гнойные осложнения у больных после остеосинтеза проволокой встречались в 66% случаев, а при остеосинтезе капроном — в 25,7%.
По критерию Пирсона χ 2 были определены факторы риска развития инфекционно-гнойных осложнений после АКШ у больных ИБС и ожирением. Результаты этого анализа представлены в табл. 2.
Анализ полученных результатов позволил установить, что наибольшее влияние на развитие инфекционно-гнойных осложнений после АКШ у больных ИБС и ожирением оказывал тип остеосинтеза (χ 2 =14,87). На втором и третьем месте по силе сопряжения были нарушения углеводного обмена (χ 2 =11,73) и ожирение (χ 2 =10,38). К патогенетически значимым факторам, способствующим развитию инфекционно-гнойных осложнений, можно также отнести нарушения водного обмена с развитием дисбаланса, связанного с повышением объема свободной и снижением объема связанной воды, инсулинорезистентность.
На следующем этапе исследования инфекционно-гнойные осложнения были разделены на поверхностные инфекции послеоперационной раны и инфекции средостения. Безусловно, по значимости для состояния больного медиастинит играл большую роль, чем поверхностные инфекционные осложнения в области хирургической раны. При традиционном остеосинтезе проволокой инфекции послеоперационной раны встречались в 44% случаев, а при альтернативном остеосинтезе капроном — в 25,7%. Ранжирование факторов, влияющих на развитие инфекции послеоперационной раны после АКШ у больных ИБС и ожирением, было следующим: на первом месте по силе сопряжения — нарушения углеводного обмена и степень их компенсации, на втором — ожирение, на третьем — тип остеосинтеза. Патогенетически важную роль в развитии инфекции играли также инсулинорезистентность и изменения водного обмена.
Медиастинит встречался только при традиционном остеосинтезе проволокой в 22% наблюдений. Наибольшее влияние на развитие инфекции средостения оказывал тип остеосинтеза (χ 2 =19,08). На втором и третьем месте по силе сопряжения были нарушения водного обмена (χ 2 =10,93) и ожирение (χ 2 =10,21). К патогенетически значимым факторам, способствующим развитию инфекции средостения, можно также отнести нарушения углеводного обмена.
Для развития инфекции средостения по сравнению с инфекцией грудины тип остеосинтеза и нарушения водного обмена имели большее влияние, а параметры углеводного обмена — меньшее. Таким образом, тип остеосинтеза и изменения водного обмена могут рассматриваться как патогенетические факторы медиастинита наряду с общеизвестными факторами. При остеосинтезе грудины проволокой за счет прорезывания швов и негерметичности повышается циркуляция тканевой жидкости из подкожной жировой клетчатки в полость средостения, что способствует развитию медиастинита. Увеличение объема свободной воды и снижение объема связанной с клеточными элементами воды способствуют обмену тканевой жидкости между подкожной жировой клетчаткой и средостением, а также созданию гидродинамического застоя в средостении, благоприятствующего воспалению.
Поскольку большинство осложнений после срединной стернотомии было связано с развитием инфекции в области хирургического вмешательства, у больных в раннем послеоперационном периоде была изучена динамика количества лейкоцитов в периферической крови, а также проведены микробиологические исследования отделяемого из раны. У пациентов вне зависимости от типа остеосинтеза в 1-е сутки после операции наблюдался лейкоцитоз. При остеосинтезе грудины капроном нормализация количества лейкоцитов в периферической крови отмечалось, начиная с 5-го дня после операции (8,9±0,1·10 9 /л). При традиционном типе остеосинтеза проволокой снижение количества лейкоцитов крови наблюдалось с 10-х суток (10,7±0,4·10 9 /л), однако нормализация показателей в эти сроки не происходила. Наибольшие различия по числу лейкоцитов в периферической крови в изучаемых группах наблюдалась на 7-й день после операции (8,1±0,4 и 13,2±0,3·10 9 /л в основной и контрольной группах соответственно).
Меньшее число осложнений в основной группе привело к сокращению сроков пребывания больных в стационаре: при остеосинтезе грудины капроном колебалась от 16 до 21 дня, а при традиционном остеосинтезе — от 17 до 40 дней. В среднем в основной группе продолжительность пребывания больных в стационаре составила 18,1±1,5 дня, что на 34,6% (p