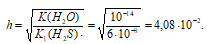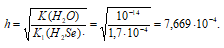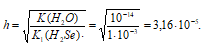сульфаты и сульфиты чем отличаются
Сульфаты и сульфиты чем отличаются
СУЛЬФИТЫ И СУЛЬФАТЫ.
СУЛЬФИТЫ И СУЛЬФАТЫ. Вещества этой группы поступают в водоемы главным образом из целлюлозно-бумажных комбинатов в виде сульфитного и сульфатного щелока, а также образуются в результате разложения органических веществ. Об органическом происхождении сульфатов свидетельствуют резкие колебания содержания их в воде рыбоводных прудов.
В состав сульфитного щелока входят свободная сернистая кислота и ее соли, сульфиды, сульфаты, фурфурол, спирты, альдегид, органические кислоты. Он имеет кислую реакцию (рН 3 — 4,5). Сульфатный щелок содержит сульфаты, карбонаты, щелочи, жирные и смоляные кислоты, меркаптаны, сероводород, имеет щелочную реакцию (рН 9 — 10). Кроме того, со сточными водами поступает много механических примесей, клетчатки и других органических веществ. Поэтому они имеют высокую окисляемость (500 — 2000 мг О 2 /л) и БПК 5 (50 — 750 мг О 2 /л).
Токсичность. Действие сточных вод целлюлозно-бумажной промышленности на водные организмы и водоемы двоякое. Органические компоненты сточных вод изменяют физико-химические свойства воды, резко снижая содержание в ней кислорода и образуя большое количество разлагающихся донных отложений. Ядовитые вещества сточных вод (сернистые соединения, меркаптаны, смолы, фенол и др.) оказывают на водные организмы комплексное токсическое действие, которое усиливается вследствие снижения в воде кислорода.
Соли сернистой кислоты в подкисленной воде вызывают гибель рыб в концентрации 0,5 — 1 мг SО 2 ″/л. В нейтральной среде их токсические концентрации для карпов, линей и золотых рыбок находятся в пределах 20 — 25 мг SО 2 ″/л, а в жесткой воде — около 100 мг/л. Токсические границы сульфита натрия для дафний составляют 440 мг/л, бисульфита натрия 145 мг/л.
Сульфаты менее токсичны. Смертельные концентрации сульфатов калия, натрия, магния и кальция при экспозиции 4 сут колеблются от 800 до 3200 мг/л. Однако стоки сульфатного производства токсичны для рыб разного возраста и дафний даже при разведении в 6 — 7 тыс. раз. Разведение сульфитного щелока в ‘1000 раз безвредно для рыб и зоопланктона. Смолы, скипидар и щелочной лигнин токсичны при содержании выше 2 мг/л, меркаптаны — 2,5 мг/л.
Симптомы и патоморфологические изменения. Сернистая кислота и сульфиты в высокой концентрации оказывают локальное действие, а в малых действуют резорбтивно. При остром отравлении сернистой кислотой вначале наблюдается сильное беспокойство рыб, учащение дыхания, затем наступает угнетение и развиваются параличи. Рыбы опрокидываются на бок, теряют равновесие. Отравление сопровождается усиленным выделением слизи и побледнением плавников. Кожный покров лососей, отравленных сульфитным щелоком, темнеет, пятна становятся незаметными. При отравлении сульфатами рыбы чаще угнетены, симптомы сглажены.
Диагноз ставят путем определения в воде сульфитов, сульфатов и других токсических веществ в зависимости от происхождения сточных вод.
Сульфиты устанавливают йодометрическим методом, а сульфаты — комплексонометрическим объемным методом или титрованием нитратом свинца с дитизоном в качестве индикатора.
Профилактика заключается в предотвращении поступления токсических продуктов и взвешенных веществ на станции биологической очистки сточных вод, использовании очищенных вод для оборотного водоснабжения. Биологически очищенные сульфатные и сульфитные сточные воды становятся безвредными при разведении в 30 — 40 раз. Рыбохозяйственная ПДК сульфатов 100 мг SО 4 ″/л, ПДК сульфитов не установлена.
Готовые домашние задания, готовые задачи по химии и биологии
Характеристика свойств сульфитов, сульфидов и тиосульфатов
Транспортировка олеума
Задача 870.
Олеум перевозят в железных цистернах. Можно ли заменить их свинцовыми? Почему олеум не растворяет железо?
Решение:
Олеум – это насыщенный раствор SO3 в 96 – 98% H2SO4. Олеум перевозят в железных цистернах, потому что в присутствии серной кислоты, концентрация которой близка к 100%, железо становится пассивным, и взаимодействия его с кислотой практически нет. Олеум нельзя перевозить в свинцовых цистернах, потому что свинец интенсивно растворяется в концентрированной серной кислоте с образованием растворимой кислой соли:
Разбавленная серная кислота практически не действует на свинец. Это связано с тем, что образуется малорастворимый сульфат свинца, который, откладываясь на поверхности свинца пассивирует его по отношению к кислоте:
Железо же в разбавленной серной кислоте растворяется с образованием хорошо растворимого сульфата железа:
Fe + H 2 SO 4(разб.) ↔ FeSO4 + Н 2 ↑
Таким образом, концентрированную серную кислоту и олеум можно перевозить и хранить в железных ёмкостях, а разбавленную серную кислоту можно хранить в свинцовых емкостях.
Сульфит натрия. Тиосульфат натрия
Задача 871.
По каким свойствам можно отличить сульфит натрия от тиосульфата натрия? Привести уравнения реакций.
Решение:
а) Сульфит натрия является средней солью сернистой кислоты. Атомы серы в сульфите натрия находятся в своей промежуточной степени окисления +4, поэтому он в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены могут восстанавливаться им до галогеноводородов:
Как окислитель сульфит натрия может реагировать с сильными восстановителями, например, с сероводородом:
Сульфит натрия при прокаливании может разлагаться до сульфата натрия и сульфида натрия:
4 Na 2 S O 3 
При этом протекает реакция самоокисления-восстановления.
б) Тиосульфат натрия Na 2 S 2 O 3 содержит один атом серы в степени окисления 0, а другой – в степени окисления +4. Поэтому тиосульфат натрия в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены хлор или бром, как сильные окислители, окисляют его до серной кислоты или до её соли:
Окисление тиосульфата натрия слабыми окислителями протекает иначе, например, под действием свободного йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6:
Эта реакция служит основой йодометрического метода определения некоторых окислителей и восстановителей.
Как окислитель тиосульфат натрия может реагировать с сильными восстановителями, например, с сероводородом:
При нагревании свыше 200 0 С тиосульфат натрия распадается по схеме:
4Na2S2O3 
При этом протекает реакция самоокисления-восстановления при которой в осадок выпадает свободная сера.
Задача 872.
Указать вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона: а) SO2; б) НF; в) Н2S; г) СО2 д) N2.
Решение:
Озон не реагирует ни с НF, ни с СО2, ни с N2.
Озон может окислят сероводород в атмосфере:
В свою очередь сернистый газ может далее окисляться озоном:
Образовавшийся оксид серы (VI) реагирует с атмосферной влагой:
Уравнение в общем виде:
Значит, вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона это SO2 и Н2S.
Значит концентрация образовавшихся ионов ОН — :
Так как 12,6 > 10,9 > 9,5, то рН1 > рН2 > рН3.
Разница между Сульфонатом и Сульфатом
Ключевое различие между Сульфонатом и Сульфатом заключается в том, что Сульфонат представляет собой анион, который образуется из сульфоновой кислоты, тогда как Сульфат представляет собой анион, который образуется из серной кислоты.
Хотя термины Сульфонат и Сульфат звучат почти одинаково, они представляют собой совершенно разные анионы. Если мы посмотрим на их химическую структуру, сульфонат имеет группу R, которая является органической группой, в то время как сульфат не имеет групп R.
Содержание
Что такое Сульфонат?
Химическая структура Сульфонат-аниона
Что такое Сульфат?
Производят этот анион, используя два основных метода:
За некоторыми исключениями, такими как сульфат кальция и сульфат стронция, известно, что все другие сульфатные соединения растворимы в воде. Кроме того, этот анион может служить лигандом в координационных соединениях (называемые еще комплексными соединениями) путем присоединения одного атома кислорода (монодентатный лиганд) или двух (бидентатный лиганд).
В чем разница между Сульфонатом и Сульфатом?
Основная информация — Сульфонат против Сульфата
Разница между сульфатом и сульфитом
Главное отличие
Основное различие между сульфатом и сульфитом состоит в том, что сульфат состоит из четырех атомов кислорода, которые дополнительно связаны с атомом серы, тогда как сульфит состоит из трех атомов кислорода, которые связаны с атомом серы.
Сульфат против сульфита
Сульфат рассматривается как анион, состоящий из четырех атомов кислорода, связанных с атомом серы, в то время как сульфит рассматривается как анион, образованный из атомов кислорода и атома серы. 96 г / моль — это молярная масса сульфата, а 80 г / моль — это молярная масса сульфита. Различные сульфаты обычно растворимы в воде; с другой стороны, многие сульфиты обычно нерастворимы в воде.
Геометрия сульфатов тетраэдрическая вокруг атома серы; напротив, геометрия сульфита является тригонально-пирамидальной вокруг атома серы. В сульфате +6 считается степенью окисления серы; наоборот, в сульфите +4 обычно является степенью окисления сульфита. Сульфат обычно не может проходить реакции окисления в процессе реакции; С другой стороны, сульфит всегда проходит через полные реакции окисления в процессе реакции.
Сульфат состоит из еще одного атома кислорода в своей структуре; с другой стороны, сульфит в своей структуре состоит на один атом кислорода меньше. Сульфат обычно имеет положительный заряд на атоме серы; напротив, сульфит обычно имеет отрицательный заряд на атоме серы. Атом серы, присутствующий в сульфате, содержит на единицу больше серы, чем атом серы, присутствующий в сульфите.
Сульфат считается солью серной кислоты и обычно производится из этой серной кислоты, которая легко используется в мыле для посуды, средствах для мытья полов, в средствах для мытья тела и шампунях. Напротив, сульфит считается естественным веществом, которое широко используется в организме человека и в некоторых разновидностях пищи. Сульфат не участвует в образовании вина, но некоторое количество сульфата кальция можно использовать в производстве пива; Напротив, сульфиты широко используются в производстве вина, потому что они действуют как консервант, останавливая рост микробов.
Сравнительная таблица
Что такое сульфат?
Сульфат-анион считается сопряженным основанием или солью серной кислоты и обычно производится из этой серной кислоты. Анионы и протон (H + ) сульфата образуются при расщеплении серной кислоты на ее ионы.
Когда связи между атомами серы и кислорода предусмотрены, два атома кислорода сульфата связаны двойными связями с атомом серы, а одинарные связи с атомом серы связывают два других атома кислорода. Связь происходит за счет атома серы, который может образовывать максимум шесть связей вокруг своей структуры. Следовательно, на односвязных атомах кислорода можно увидеть отрицательные заряды.
Электроны, которые присутствуют вокруг атомов серы и кислорода, становятся делокализованными из-за перекрытия орбиталей. Точная длина связи между атомами кислорода и серы составляет 149 пм. Примеры общих сульфатов Барит (BaSO 4 ), англезит (PbSO 4 ), ангидрит (CaSO 4 ), Гипс (CaSO 4 · 2H 2 O) и эпсомит (MgSO 4 · 7H 2 O).
Что такое сульфит?
Сульфит состоит из трех атомов кислорода, а в сульфит-анионе один атом кислорода связан с атомом серы двойной связью. Два других атома кислорода связаны одинарными связями с атомом серы. Длины связей, присутствующие вокруг атомов кислорода и серы, одинаковы, и значение длины связи также одинаково между атомами серы и кислорода из-за резонанса в структуре.
Примеры общего сульфита являются медь сульфит (CuSO 3 ), сульфит цинка (ZnSO 3 ), сульфит магния (MgSO 3 ) и калия Сульфит (К 2 СО 3 ).
Ключевые отличия
Заключение
Вышеупомянутое обсуждение заключает, что сульфат считается четырех атомов кислорода, которые дополнительно связаны с атомом серы, и структура сульфатов является тетраэдрической, тогда как сульфит состоит из трех атомов кислорода, которые связаны с атомом серы, и его состав является тригонально-пирамидальным.
Характеристика свойств сульфитов, сульфидов и тиосульфатов
Транспортировка олеума
Задача 870.
Олеум перевозят в железных цистернах. Можно ли заменить их свинцовыми? Почему олеум не растворяет железо?
Решение:
Олеум – это насыщенный раствор SO3 в 96 – 98% H2SO4. Олеум перевозят в железных цистернах, потому что в присутствии серной кислоты, концентрация которой близка к 100%, железо становится пассивным, и взаимодействия его с кислотой практически нет. Олеум нельзя перевозить в свинцовых цистернах, потому что свинец интенсивно растворяется в концентрированной серной кислоте с образованием растворимой кислой соли:
Разбавленная серная кислота практически не действует на свинец. Это связано с тем, что образуется малорастворимый сульфат свинца, который, откладываясь на поверхности свинца пассивирует его по отношению к кислоте:
Железо же в разбавленной серной кислоте растворяется с образованием хорошо растворимого сульфата железа:
Fe + H 2 SO 4(разб.) ↔ FeSO4 + Н 2 ↑
Таким образом, концентрированную серную кислоту и олеум можно перевозить и хранить в железных ёмкостях, а разбавленную серную кислоту можно хранить в свинцовых емкостях.
Сульфит натрия. Тиосульфат натрия
Задача 871.
По каким свойствам можно отличить сульфит натрия от тиосульфата натрия? Привести уравнения реакций.
Решение:
а) Сульфит натрия является средней солью сернистой кислоты. Атомы серы в сульфите натрия находятся в своей промежуточной степени окисления +4, поэтому он в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены могут восстанавливаться им до галогеноводородов:
Как окислитель сульфит натрия может реагировать с сильными восстановителями, например, с сероводородом:
Сульфит натрия при прокаливании может разлагаться до сульфата натрия и сульфида натрия:
4 Na 2 S O 3 
При этом протекает реакция самоокисления-восстановления.
б) Тиосульфат натрия Na 2 S 2 O 3 содержит один атом серы в степени окисления 0, а другой – в степени окисления +4. Поэтому тиосульфат натрия в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены хлор или бром, как сильные окислители, окисляют его до серной кислоты или до её соли:
Окисление тиосульфата натрия слабыми окислителями протекает иначе, например, под действием свободного йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6:
Эта реакция служит основой йодометрического метода определения некоторых окислителей и восстановителей.
Как окислитель тиосульфат натрия может реагировать с сильными восстановителями, например, с сероводородом:
При нагревании свыше 200 0 С тиосульфат натрия распадается по схеме:
4Na2S2O3 
При этом протекает реакция самоокисления-восстановления при которой в осадок выпадает свободная сера.
Задача 872.
Указать вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона: а) SO2; б) НF; в) Н2S; г) СО2 д) N2.
Решение:
Озон не реагирует ни с НF, ни с СО2, ни с N2.
Озон может окислят сероводород в атмосфере:
В свою очередь сернистый газ может далее окисляться озоном:
Образовавшийся оксид серы (VI) реагирует с атмосферной влагой:
Уравнение в общем виде:
Значит, вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона это SO2 и Н2S.
Значит концентрация образовавшихся ионов ОН — :
Так как 12,6 > 10,9 > 9,5, то рН1 > рН2 > рН3.