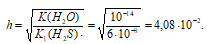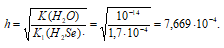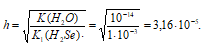сульфаты и сульфиды чем отличаются
Сульфиды. Сульфаты
Во всех соединениях широко развиты изоморфные замещения одних элементов другими, а также примеси редких элементов: кадмия, галлия, индия и талия и др.
Характерны ионные кристаллические решетки. Но в связи с большими радиусами ионов S, Te, Se, As, Sb, наблюдается явление поляризации, поэтому появляются общие электронные оболочки и возникают ионно-ковалентные, а иногда – чисто ковалентные связи.
В большинстве случаев происхождение гидротермальное, иногда – сульфиды являются продуктами кристаллизации сульфидной магмы.
При выветривании в зоне окисления переходят в сульфаты, затем в оксиды, гидрооксиды, карбонаты.
PbS 
галенит англезит церрусит
Сульфиды подразделяются на подклассы:
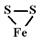
4) сложные (сульфосоли).
Сульфиды представляют собой рудную базу цветной металлургии и являются сырьем для производства серной кислоты.
Представители простых сульфидов:
— Cu2S – халькозин (медный блеск) – медная руда. Свинцово-серый цвет. Ромбическая сингония. Спайность несовершенная. Средне распространенный минерал на Украине.
Представители двойных сульфидов:
Основная химическая масса – морские и озерные осадки. Многие сульфаты – минералы зоны окисления, некоторые – продукты вулканической деятельности.
Используется в качестве утяжелителя в производстве красок, бумаги, клеенок, линолеума; при варке стекол (известен бариевый хрусталь); для изготовления баритовой штукатурки поглощающей рентгеновские лучи в лабораториях и больницах.
Распространен на Украине: Приазовье, Волыноподолье (в месторождении серы), наибольшие скопления в Закарпатье (Береговское и Беганьское месторождения).
—SrSO4 целистин – ромбическая сингония. Кристаллы таблитчатые, призматичные; агрегаты – друзы, шестоватые, зернистые. Цвет небесно-голубой, голубовато-белый, серый, прозрачный. Блеск стеклянный, на плоскостях спайности – перламутровый.
Распространенный минерал на Украине: Приднестровье, Приазовье, Крым, Прикарпатье.
—CaSO4 ангидрит – ромбическая сингония, кристаллы таблитчатые, близкие к изометричным; агрегаты сплошные, мелкозернистые. Важный породообразующий минерал, встречающийся вместе с гипсом и галитом в осадочных породах. Выпадает в осадок при температуре >42°С (до этой температуры выпадает гипс). При нормальном давлении в присутствии воды ангидрит переходит в гипс с большим увеличением объема (на 30%).
Распространенный минерал на Украине (Артемовское месторождение).
—CaSO4·2H2Oгипс (легкий шпат). Разновидности гипса:
— селенит – параллельно-волокнистая разность с шелковым блеском;
— алебастр – снежно-белая, тонкозернистая разность
Кристаллы таблитчатые, иногда очень крупные; характерны двойники «ласточкин хвост». Агрегаты плотные, зернистые, листоватые, волокнистые.
Известные месторождения гипса находятся в Донбассе (Артемовское) и в Приднестровье.
— Na2SO4·10H2Oмирабилит (глауберова соль). Моноклинная сингония – сплошные зернистые массы. Бесцветный, белый, блеск стеклянный, вкус горько-соленый, в пробирке при нагревании растворяется в собственной кристаллизационной воде. На воздухе теряет воду, превращаясь в тенардит Na2SO4·.
Крупнейшие месторождения мирабилита – залив Кара-Богаз-Гол, где он выпадает при 6°С и в больших количествах выносится прибоем на берег. Летом он снова растворяется, а выброшенный на берег минерал переходит в тенардит. Запасы составляют 4 млрд. тон.
И мирабилит и тенардит применяются в стекольной промышленности при изготовлении жидкого стекла, для приготовления соды по методу Леблана, в медицине.
Мирабилит редкий, тенардит среднераспостраненный минералы на Украине.
Характеристика классов сульфидов и сульфатов



Сульфаты представляют собой соли серной кислоты, накапливающиеся, в большинстве своем, в соленасыщенной водной среде. Сульфатам принадлежит большое породообразующее значение, они слагают около 0,1 % массы земной коры. Минералам свойственны низкая твердость, неметаллические разновидности блеска, светлая окраска. В земной коре широко распространены гипс, ангидрит, мирабилит (глауберова соль).
Сульфиды – сернистые соединения тяжелых металлов. Класс насчитывается около 250 минералов, составляющих 0,15 % массы земной коры. Образование сульфидов идет без доступа кислорода, большинство из них имеет гидротермальное происхождение. При окислении сульфиды легко переходят в окислы, карбонаты или сульфаты. Ценность сульфидов в том, что они являются рудами на цветные металлы, причем зачастую им сопутствует золото. Наибольшим распространением пользуются пирит (железный колчедан), халькопирит (медный колчедан), галенит (свинцовый блеск), сфалерит (цинковая обманка), киноварь и др. Подавляющему большинству сульфидов характерны металлический блеск, низкая и средняя твердость, высокая плотность.
Сульфиды – сернистые соединения металлов и полуметаллов. Химически это соли сероводородной кислоты (Н2S). Их общее весовое количество составляет около 0,15% земной коры. В основном это соединения железа с серой. На долю сернистых соединений других металлов приходится лишь 0,01%. Тем не менее, роль этих сульфидов как основных руд этих металлов (цинка, меди, свинца, серебра, сурьмы, висмута, никеля, кобальта, молибдена, ртути и других) очень велика. Всего в классе сульфидов в настоящее время насчитывается около 260 минералов. Но лишь около 20 из них широко распространены в природе и встречаются в больших количествах. Все они, за исключением сероводорода, находятся в природе в твердом состоянии.
Твердость сульфидов варьирует от 1 у молибденита до 6,5 у пирита, преобладают минералы с твердостью 2-4. Сульфиды обычно не прозрачны и обладают сильным металлическим блеском. Исключения составляют сфалерит и киноварь, имеющие алмазный блеск. Сульфиды, содержащие платину и мышьяк, имеют цвет от серебристо-белого до оловянно-белого. Сульфиды железа и некоторые сульфиды меди обладают желтым цветом. Минералы серебра, свинца, иногда меди окрашены в свинцово-серый цвет.
Сульфаты – это соли серной кислоты (Н2SO4). На сегодняшний день известно 162 сульфатных минерала.
Характеристика свойств сульфитов, сульфидов и тиосульфатов
Транспортировка олеума
Задача 870.
Олеум перевозят в железных цистернах. Можно ли заменить их свинцовыми? Почему олеум не растворяет железо?
Решение:
Олеум – это насыщенный раствор SO3 в 96 – 98% H2SO4. Олеум перевозят в железных цистернах, потому что в присутствии серной кислоты, концентрация которой близка к 100%, железо становится пассивным, и взаимодействия его с кислотой практически нет. Олеум нельзя перевозить в свинцовых цистернах, потому что свинец интенсивно растворяется в концентрированной серной кислоте с образованием растворимой кислой соли:
Разбавленная серная кислота практически не действует на свинец. Это связано с тем, что образуется малорастворимый сульфат свинца, который, откладываясь на поверхности свинца пассивирует его по отношению к кислоте:
Железо же в разбавленной серной кислоте растворяется с образованием хорошо растворимого сульфата железа:
Fe + H 2 SO 4(разб.) ↔ FeSO4 + Н 2 ↑
Таким образом, концентрированную серную кислоту и олеум можно перевозить и хранить в железных ёмкостях, а разбавленную серную кислоту можно хранить в свинцовых емкостях.
Сульфит натрия. Тиосульфат натрия
Задача 871.
По каким свойствам можно отличить сульфит натрия от тиосульфата натрия? Привести уравнения реакций.
Решение:
а) Сульфит натрия является средней солью сернистой кислоты. Атомы серы в сульфите натрия находятся в своей промежуточной степени окисления +4, поэтому он в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены могут восстанавливаться им до галогеноводородов:
Как окислитель сульфит натрия может реагировать с сильными восстановителями, например, с сероводородом:
Сульфит натрия при прокаливании может разлагаться до сульфата натрия и сульфида натрия:
4 Na 2 S O 3 
При этом протекает реакция самоокисления-восстановления.
б) Тиосульфат натрия Na 2 S 2 O 3 содержит один атом серы в степени окисления 0, а другой – в степени окисления +4. Поэтому тиосульфат натрия в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены хлор или бром, как сильные окислители, окисляют его до серной кислоты или до её соли:
Окисление тиосульфата натрия слабыми окислителями протекает иначе, например, под действием свободного йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6:
Эта реакция служит основой йодометрического метода определения некоторых окислителей и восстановителей.
Как окислитель тиосульфат натрия может реагировать с сильными восстановителями, например, с сероводородом:
При нагревании свыше 200 0 С тиосульфат натрия распадается по схеме:
4Na2S2O3 
При этом протекает реакция самоокисления-восстановления при которой в осадок выпадает свободная сера.
Задача 872.
Указать вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона: а) SO2; б) НF; в) Н2S; г) СО2 д) N2.
Решение:
Озон не реагирует ни с НF, ни с СО2, ни с N2.
Озон может окислят сероводород в атмосфере:
В свою очередь сернистый газ может далее окисляться озоном:
Образовавшийся оксид серы (VI) реагирует с атмосферной влагой:
Уравнение в общем виде:
Значит, вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона это SO2 и Н2S.
Значит концентрация образовавшихся ионов ОН — :
Так как 12,6 > 10,9 > 9,5, то рН1 > рН2 > рН3.