обструктивная уропатия и рефлюкс уропатия что это
Обструктивная уропатия – когда нужно срочно обращаться к врачу
Обструктивная уропатия – состояние, при котором закупорка препятствует прохождению мочи по мочевыводящему каналу. Возникает в любом участке системы – от почек, где моча образуется, до канала, через который она покидает организм. Состояние повышает давление в мочевыделительном канале и угрожает осложнениями, если вовремя не будет диагностировано.
Причины
Причины развития обструктивной уропатии и рефлюкс-уропатии отличаются в разных возрастных группах:
Обструктивная уропатия у мужчин встречается чаще, у женщин же она часто встречается во время беременности. Это связано с давлением плода и матки на мочевыводящий канал.
Дополнительно причинами заболевания становятся:
Новообразования в простате у мужчин и в матке у женщин способны сужать просвет мочеточника, потому врач проводит дифференциальную диагностику с определением сопутствующих заболеваний и первопричин.
Непроходимость мочевыводящих путей – симптомы
Признаки уропатии зависят от локализации, продолжительности состояния. Пациентов беспокоят такие симптомы:
Если непроходимость возникает быстро, она причиняет боль и описанные состояния. При медленно прогрессирующей уропатии болезненность не отмечается на первых стадиях. В этом случае заболевание угрожает гидронефрозом.
Нарушение оттока мочи – повод немедленно обратиться к урологу! Патология может развиваться критически быстро, но своевременная диагностика и лечение предотвратят острые состояния и осложнения.
Диагностика
Для обнаружения обструктивной уропатии у мужчин и женщин назначаются лабораторные и инструментальные обследования:
В клинике урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова можно пройти диагностику и получить консультацию опытного уролога. Современные диагностические аппараты, врачи высшей категории помогут справиться с заболеванием на любой стадии в короткие сроки. Не откладывайте визит к врачу, позаботьтесь о здоровье сегодня!
Обструктивная уропатия
(обструкция мочевыводящих путей)
, MD, Duke University Medical Center
Этиология
Наиболее частые причины различны в разном возрасте:
Обструкция может происходить на любом уровне, от почечных канальцев (цилиндры, кристаллы) до наружного отверстия уретры. Проксимальнее места обструкции может развиваться повышение внутрипросветного давления, стаз мочи, инфекция мочевыводящих путей или камнеобразование (которое также может приводить к обострению или возникновению обструкции). Обструкция гораздо более распространена среди мужчин (обычно вследствие развития доброкачественной гиперплазии простаты), но врожденные и приобретенные стриктуры уретры Стриктура уретры Стриктура уретры – рубцовый процесс, приводящий к обструкции просвета передней уретры. Стриктура уретры бывает: Врожденная Приобретенныая Любой фактор, повреждающий эпителий уретры, или губчатое. Прочитайте дополнительные сведения и стенозы отверстия мочеиспускательного канала встречаются у представителей обоих полов. У женщин обструкция уретры может развиваться на фоне первичной или метастатической опухоли или в результате образования стриктуры после лучевой терапии, хирургии или урологических инвазивных манипуляций (обычно – повторных дилатаций).
Патофизиология
Патологические изменения заключаются в дилатации собирательных трубочек и дистальных канальцев, а также хронической тубулярной атрофии с незначительным поражением клубочка. Развитие дилатации занимает 3 дня с момента начала обструктивной уропатии; до этого срока собирательная система относительно устойчива, и ее дилатация менее вероятна. Обструктивная уропатия без дилатации также может происходить, когда фиброз или ретроперитонеальная опухоль вовлекает собирательные системы, при умеренной обструктивной уропатии и сохранной функции почек, а также в случае внутрипочечного расположения почечной лоханки.
Обструктивная нефропатия
Время и скорость, с которой необратимое повреждение почки (или почек) развивается после обструкции, зависит от многих факторов, которые трудно предсказать. Для того, чтобы предотвратить необратимые повреждения, обструкция мочевых путей должна быть как можно скорее диагностирована и подвержена лечению.
Клинические проявления
Клинические проявления различаются в зависимости от локализации, степени обструкции и скорости развития обструктивной уропатии.
Боль является наиболее частым признаком растяжения мочевого пузыря, чашечно-лоханочной системы (т. е. мочеточника, почечной лоханки и почечных чашечек) или почечной капсулы. Изменения в верхнем отделе мочеточника или в почке сопровождаются болью или повышенной чувствительностью в поясничной области, в то время как острая обструкция нижнего отдела мочеточника вызывает боль с иррадиацией в яичко на той же стороне у мужчин или в половые губы у женщин. Распространение почечной и мочеточниковой боли происходит, как правило, вдоль Т11-Т12. При острой полной обструкции мочеточника (например, при обструкции камнем) боль может быть резко выраженной и сопровождаться тошнотой и рвотой. Большая водная нагрузка (например, при потреблении алкоголя или кофеин содержащих напитков, или осмотического диуреза после введения внутривенного контраста) вызывает дилатацию и боль, если продукция мочи повышается до уровня большего, чем позволяет пропустить место обструкции.
Боль, как правило, минимальна или отсутствует при частичной или медленно развивающейся обструктивной уропатии (например, врожденная обструкция мочеточниково-лоханочного сочленения, опухоль в малом тазу). Гидронефроз иногда может приводить к формированию пальпируемого образования в поясничной области, особенно при выраженном гидронефрозе у новорожденных и детей.
Инфекция мочевыводящих путей может вызывать дизурию, пиурию, императивные и учащенные позывы к мочеиспусканию, боль в соответствующих сегментарных зонах почек и мочеточников, чувствительность в косто-вертебральном углу, лихорадку, а в наиболее тяжелых случаях даже сепсис.
Диагностика
Анализ мочи и определение уровня электролитов, креатинина и азота мочевины в крови (АМК)
Катетеризация мочевого пузыря или ультразвуковая оценка объема мочевого пузыря после мочеиспускания, иногда с последующей цистоуретроскопией и экскреторной цистоуретрографией при подозрении на обструкцию уретры
Визуализирующие методы исследования при подозрении на обструкцию мочеточника, более проксимальную обструкцию или гидронефроз без обструкции
Обструктивную уропатию следует подозревать при появлении:
Олигурии или анурии
Необъяснимой почечной недостаточности
Боли, свидетельствующей о растяжении мочевого тракта
Олигурии или анурии, чередующейся с полиурией
Должны быть выполнены общий анализ мочи Общий анализ мочи У пациентов с нефрологической патологией симптомы и признаки заболевания могут быть неспецифическими и/или отсутствовать до поздних стадий болезни. Симптомы могут быть местными (например, отражающими. Прочитайте дополнительные сведения 
При отсутствии симптомов у пациента с длительно существующей обструктивной уропатией, анализ мочи может быть нормальным или выявить в осадке только небольшое количество цилиндров, лейкоцитов, эритроцитов. При ОПН на фоне нормального анализа мочи необходимо исключать двустороннюю обструктивную нефропатию.
Обследование при подозрении на обструкцию мочеточника
Если нет симптомов обструкции мочеиспускательного канала или нет признаков обструкции по данным уретроцистоскопии и микционной цистоуретрографии, предполагается, что имеет место обструкция мочеточника или более проксимальная обструкция.
Обследование при мочеточниковой или более проксимальной обструкции
Применение методов визуализации направлено на выявление обструкции и определение ее уровня. Выбор и последовательность методов зависят от клинической картины заболевания.
УЗИ брюшной полости – первоочередной метод исследования у большинства пациентов, за исключением страдающих заболеваниями уретры, поскольку позволяет избежать потенциальных аллергических и токсических осложнений внутривенного введения рентген-контрастных веществ и оценить атрофические изменения паренхимы почек. При УЗИ можно диагностировать гидронефроз. Если принимают во внимание самые минимальные диагностические критерии (визуализация ЧЛС), частота ложноположительных результатов составляет 25%. Также могут быть ложноотрицательные результаты при отсутствии гидронефроза на ранней стадии обструкции (в первые несколько дней), или при умеренной обструкции, ретроперитонеальном фиброзе, опухолевом сдавлении ЧЛС, из-за которого не происходит расширения мочеточника.
КТ Компьютерная томография Визуализационные методики часто используются для обследования пациентов с нефрологической и урологической патологией. Рентгенография брюшной полости без использования рентгеноконтрастных препаратов. Прочитайте дополнительные сведения 
Дупплексная допплеровская ультрасонография Ультразвуковое исследование Визуализационные методики часто используются для обследования пациентов с нефрологической и урологической патологией. Рентгенография брюшной полости без использования рентгеноконтрастных препаратов. Прочитайте дополнительные сведения 
Экскреторная урография Внутривенная урография (ВВУ) Визуализационные методики часто используются для обследования пациентов с нефрологической и урологической патологией. Рентгенография брюшной полости без использования рентгеноконтрастных препаратов. Прочитайте дополнительные сведения 
Антеградная или ретроградная пиелография предпочтительнее исследований с внутрисосудистым введением контраста у пациентов с азотемией. Антеградное исследование выполняют после чрескожной пункционной нефростомии, ретроградное – через цистоскоп. Пациентов с интермиттирующей обструкцией необходимо обследовать во время обострения, иначе можно не найти обструкцию.
Радионуклидное сканирование Радионуклидное сканирование Визуализационные методики часто используются для обследования пациентов с нефрологической и урологической патологией. Рентгенография брюшной полости без использования рентгеноконтрастных препаратов. Прочитайте дополнительные сведения 
МРТ Магнито-резонансная томография Визуализационные методики часто используются для обследования пациентов с нефрологической и урологической патологией. Рентгенография брюшной полости без использования рентгеноконтрастных препаратов. Прочитайте дополнительные сведения 
Обследование при гидронефрозе без очевидных признаков обструкции
Дополнительное обследование необходимо в случае болей в пояснице или в боку, вызванных обструкцией у пациентов с гидронефрозом, но без очевидной обструкции при визуализирующих методах, а также может выполняться у пациентов со случайно выявленным гидронефрозом для диагностики невыявленной ранее обструкции. Исследование также может быть проведено для того, чтобы обнаружить нераспознанную другим способом обструкцию у больных со случайно выявленным гидронефрозом.
При проведении диуретической ренографии назначают петлевой диуретик (например, фуросемид 0,5 мг/кг внутривенно) перед радиоизотопным исследованием почек. Необходима достаточная сохранность функции почек пациента для назначения диуретика. При обструкции скорость выведения радиоактивного вещества (или контрастного вещества) с момента появления радиофармпрепарата в почечной лоханке замедляется и период полувыведения составляет > 20 минут (в норме
Пациент лежит на животе. При наличии обструктивной уропатии вместо значительного увеличения оттока мочи скорость распределения радиофармпрепарата замедлена и наблюдается дальнейшее расширение ЧЛС и увеличение давления в лоханке > 22 мм. рт. ст.
ст. Ренограмма или положительный перфузионный тест, вызывающие у пациента боль, аналогичную исходной, подтверждают обструкцию. Отсутствие роста перфузионного давления свидетельствует о внепочечном происхождении боли. Ложноположительные и ложноотрицательные результаты возможны при проведении обоих тестов.
Прогноз
Большинство обструкций поддаются коррекции, но запоздалое лечение может привести к необратимым повреждениям почки. Сколько времени потребуется для развития нефропатии и насколько она будет обратима, зависит от причины заболевания, присоединения инфекции мочевыводящих путей, степени и продолжительности обструкции. В общем ОПН, вызванная мочеточниковым камнем, обратима, с полным восстановлением функции почки. При хронической прогрессирующей обструктивной уропатии нарушение функции почек может быть частично или полностью необратимым. Прогноз хуже при нелеченной инфекции мочевыводящих путей.
Лечение
Лечение предполагает хирургическое устранение обструкции, применение инструментальных методов (например, эндоскопии, литотрипсии) или медикаментозной терапии (например, гормональная терапия при раке простаты). При гидронефрозе показано незамедлительное дренирование, если имеется нарушение функции почек, персистирующая инфекция мочевых путей (ИМП) или стойкий или не поддающийся коррекции болевой синдром. Незамедлительное дренирование показано в случае, если обструкция сопровождается развитием инфекции. При нижней обструктивной уропатии может потребоваться катетеризация или более проксимальное дренирование. Постоянный мочевой катетер можно устанавливать для острого или длительного дренирования некоторым пациентам.
Постоянное дренирование с использованием чрескожной нефростомы может потребоваться при тяжелой обструктивной уропатии, инфекции мочевыводящих путей или камнях.
Интенсивная терапия обязательна при инфекции мочевыводящих путей и почечной надостаточности.
В случае гидронефроза без очевидной обструкции необходимо рассматривать возможность хирургического лечения, если у пациента имеется болевой синдром и положительная диуретическая ренограмма. Однако лечение не требуется при бессимптомном течении и отрицательной диуретической ренограмме или при положительной диуретической ренограмме при сохранной функции почек.
Ключевые моменты
Распространенными причинами у детей являются врожденные патологии; у молодых взрослых – камни, а у мужчин более старшего возраста – доброкачественная гипертрофия простаты.
Последствия могут приводить к почечной недостаточности и инфекции.
Боль часто появляется вследствие растяжения органов в верхнем отделе желудочно-кишечного тракта (как правило, чувствуется в левом боку) или мочевого пузыря (как правило, чувствуется в яичках, надлобковой области или половых губах).
Обструктивную уропатию следует подозревать, когда у пациентов развивается необъяснимая другими причинами почечная недостаточность, снижение мочеотделения, характерный для обструкции болевой синдром, а также олигурия или анурия, чередующиеся с полиурией.
В случае предполагаемой обструкции в нижнем отделе мочевого тракта следует катетеризировать мочевой пузырь, затем провести цистоуретроскопию, а в отдельных случаях – цистоуретрографию.
При подозрении на обструкцию в верхнем отделе мочевого тракта следует провести визуализирующие исследования (например, УЗИ органов брюшной полости, КТ, дуплексное сканирование, допплеровскую ультрасонографию, внутривенную пиелографию, МРТ).
Следует незамедлительно принять меры для разрешения обструкции, особенно в случае наличия у пациентов инфекций мочевыводящих путей.
Пузырно-мочеточниковый рефлюкс у детей: лечебная тактика
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна.
Среди детей и подростков пузырно-мочеточниковый рефлюкс (ПМР) встречается в 1% случаев, доля билатерального рефлюкса составляет до 50,9% [1]. При этом в 50% случаев степень рефлюкса с разных сторон различна. Распространенность ПМР и последствия этого заболевания (хронический пиелонефрит, отставание в развитии, артериальная гипертензия, хроническая почечная недостаточность), неизбежно приводящие к инвалидизации, диктуют необходимость поиска путей улучшения лечебной тактики. Среди причин развития ПМР у мальчиков основное место занимают пороки развития устьев мочеточников, в то время как у девочек преобладают вторичные формы ПМР, обусловленные инфекцией мочевых путей и нейрогенными дисфункциями мочевого пузыря (НДМП). Так, на первом году жизни соотношение страдающих ПМР мальчиков и девочек составляет 6:1, а по мере взросления это соотношение изменяется с точностью до наоборот [2].
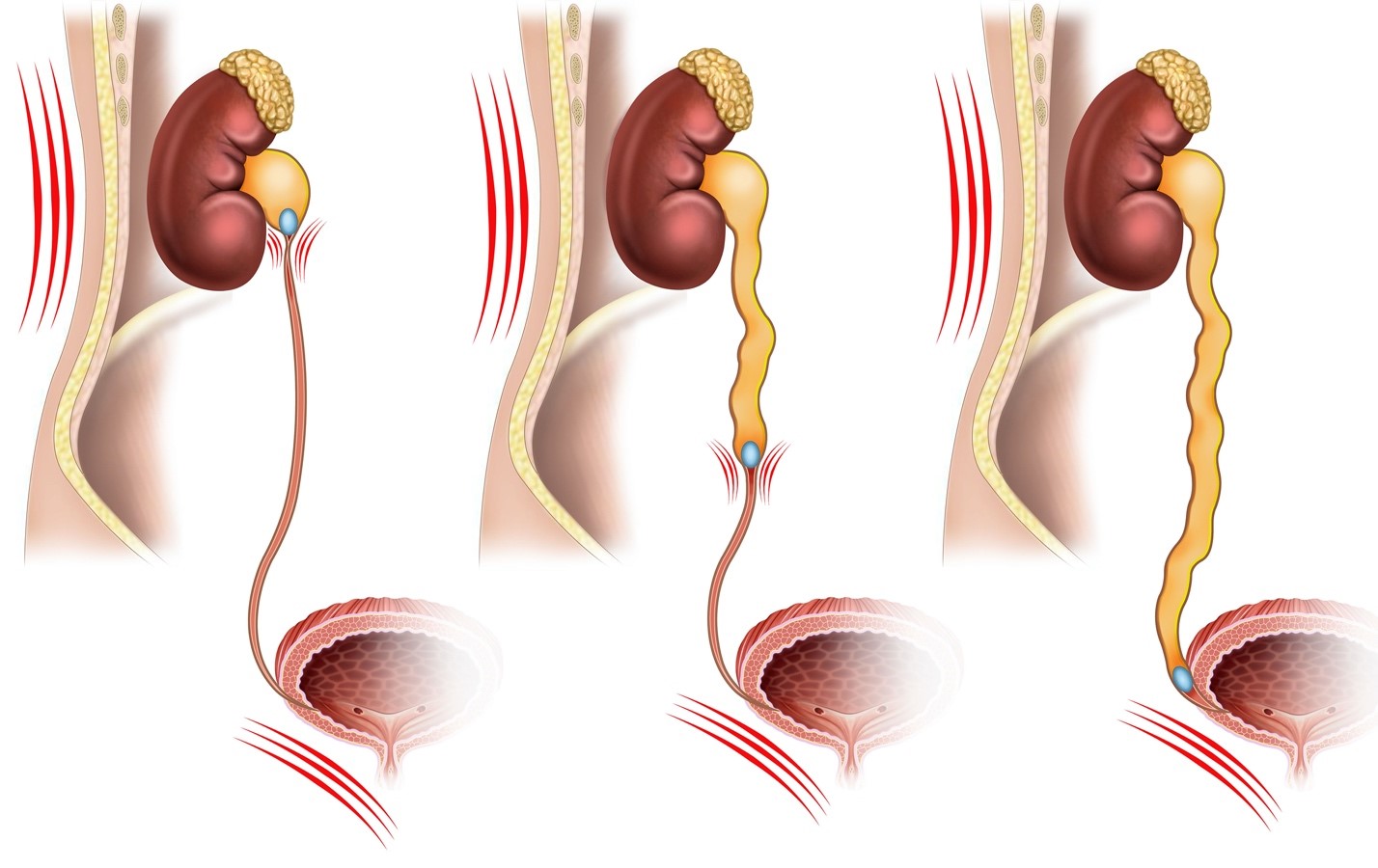
Чтобы понять причины развития ПМР, необходимо иметь представление о нормальном строении пузырно-мочеточникового сегмента (ПМС) (рис.). Анатомически замыкательная функция ПМС осуществляется благодаря определенному соотношению длины и ширины внутрипузырного отдела мочеточника (5:1), косому прохождению мочеточника через стенку мочевого пузыря. Длинный подслизистый тоннель является пассивным элементом уретеро-везикального «клапана». Активный элемент клапанного механизма представлен мышечно-связочным аппаратом мочеточника, который при сокращении детрузора смыкает устье.
К причинам антифизиологичного тока мочи относятся патологические состояния, приводящие к нарушению замыкательной функции ПМС и высокое внутрипузырное давление мочи. К первым можно отнести врожденные пороки ПМС и воспалительный процесс поверхностного и глубокого слоев треугольников мочевого пузыря (циститы), нарушающий работу детрузора или непосредственно самого ПМС.
Аномалии ПМС являются следствием неправильного развития мочеточникового выроста вольфова протока на 5-й неделе эмбриогенеза [3, 4]. Представить аномалии ПМС можно следующим образом:
Утрата замыкательной функции ПМС встречается при воспалении стенки мочевого пузыря или зоны ПМС. Наиболее часто вторичный ПМР является следствием (осложнением) гранулярной, буллезной или фибринозной форм цистита. Инфекция мочевых путей встречается у 1–2% мальчиков и у 5% девочек. Чаще мочевые пути колонизируются условно-патогенной (кишечной) флорой, среди которой основное место занимает кишечная палочка (40–70%) [3].
В норме ПМС способен противостоять внутрипузырному давлению жидкости до 60–80 см водного столба [5]. Высокое гидростатическое давление является следствием интравезикальной обструкции или функциональных расстройств мочевого пузыря. Интравезикальная обструкция развивается при клапанах задней уретры, рубцовом фимозе у мальчиков, склерозе шейки мочевого пузыря (болезни Мариона), меатальном стенозе у девочек.
НДМП встречаются у 20% детей в возрасте 4–7 лет. К 14 годам число страдающих этими дисфункциями сокращается до 2% [6]. НДМП проявляют себя ирритативной или обструктивной симптоматикой. Основные формы НДМП: гиперактивность детрузора, гипотония детрузора и детрузорно-сфинктерная диссинергия. При этих состояниях ПМР также считается вторичным и является следствием повышения давления жидкости в мочевом пузыре. Гиперактивность детрузора характеризуется резкими скачками внутрипузырного давления и нарушением накопительной функции мочевого пузыря. Гипотония детрузора характеризуется снижением чувствительности стенки пузыря, его переполнением и нарастанием давления мочи в его просвете выше критических цифр. Детрузорно-сфинктерная диссинергия представляет собой нарушение синхронной работы детрузора и сфинктерного аппарата, приводящее к функциональной инфравезикальной обструкции при микции.
С возрастом отмечается тенденция к уменьшению встречаемости первичного и увеличению вторичного ПМР. При этом частота регрессии первичного ПМР находится в обратной зависимости от степени ПМР. При I и II степенях ПМР регрессия отмечается в 80%, а при III — всего в 40% случаев. Объяснение этому дает теория «матурации» ПМС (Hutch, 1961), которая приобрела себе сторонников позднее (Kellerman, 1967; King, 1974). Суть теории заключается в том, что с развитием ребенка происходит физиологическая трансформация ПМС — удлиняется внутрипузырный отдел мочеточника, уменьшается его диаметр относительно длины и изменяется угол впадения в мочевой пузырь.
Современная лечебная стратегия при ПМР включает в себя комплекс мероприятий (терапевтических и хирургических), направленных на устранение причины рефлюкса и ликвидацию его последствий. Выбор метода коррекции ПМР, безусловно, определяется его формой.
Суть консервативной терапии должна сводиться к эрадикации инфекции мочевых путей и устранению функциональных расстройств мочевого пузыря и профилактике гибели почечной паренхимы. По данным Ю. Ф. Исакова, эффективность консервативной терапии при I–III степени ПМР составляет 60–70%. Основными осложнениями (проявлениями) ПМР являются хронический пиелонефрит (50–70%) и рефлюксогенная нефропатия (60–70%) [2]. Этиологическая структура хронического пиелонефрита (по А. Ф. Возианову и др., 2002) представлена следующим образом: кишечная палочка — 40–60%, протей — 9–16%, клебсиелла — 7–20%, стрептококк — 4–10%, L-формы — 15%, микробные ассоциации — 10–15%, энтерококк — 2–5%, синегнойная палочка — 2–7%, энтеробактер — 5–15%, стафилококк — 5–14%.
Антимикробная терапия должна носить длительный характер (6–12 мес) и применяться по результатам посевов мочи. Наиболее удобными для детей являются препараты пероральных форм. При лечении в стационаре применяются внутримышечные или внутривенные формы. Для эрадикации возбудителя нашли применение следующие препараты:
– аугментин, 25–50 мг/кг/сут, перорально в течение 7–10 сут;
– амоксиклав, 20–40 мг/кг/сут, перорально в течение 7–10 сут;
– цефуроксим (зиннат), 20–40 мг/кг/сут (в два приема) в течение 7–10 сут;
– цефаклор (цеклор), 20–40 мг/кг/сут (в три приема) в течение 7–10 сут;
– цефиксим (супракс), 8 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
– цефтибутен (цедекс), 7–14 мг/кг/сут (в 1 или 2 приема) в течение 7–10 сут;
После использования бактерицидных препаратов (антибиотиков) длительным курсом назначается уросептическая терапия:
– налидиксовая кислота — 60 мг/кг/сут, перорально, в течение 3–4 нед;
– пипемидовая кислота (пимидель, палин) — 200–400 мг/сут, перорально, в течение 3–4 нед;
– нитроксолин (5-НОК) — 10 мг/кг/сут, перорально, в течение 3–4 нед.
С целью купирования аллергического компонента назначаются десенсибилизирующие средства:
Важную роль играет применение лекарственных средств, улучшающих внутриклеточный обмен. С антиоксидантной целью назначаются:
С целью коррекции митохондриальной недостаточности применяются:
Обязательным компонентом консервативной терапии является применение фитопрепаратов: листья и плоды брусники, клюквы, смородины, кора дуба, зверобой, крапива, ромашка, черника, мать-и-мачеха и др.
Для повышения эффективности лечения циститов у детей старшего возраста применяется местная терапия — внутрипузырные инстилляции, к которым надо относиться с осторожностью у больных с высокими степенями ПМР. Важно помнить, что объем растворов не должен превышать 20–50 мл. Используются растворы: протаргол; солкосерил; гидрокортизон; хлоргексидин; фурациллин.
Курс лечения рассчитан на 5–10 инстилляций, при буллезном цистите повторяют 2–3 курса. Эффективно дополнение местной терапии физиотерапевтическим лечением.
Особое место в лечении инфекции мочевых путей у детей следует уделять нормализации функции кишечника. Нарушение нормального ритма опорожнения толстой кишки приводит к компрессии нижней трети мочеточника, нарушению васкуляризации, застою в области малого таза, инфицированию мочевых путей (лимфогенный путь).
НДМП наблюдается у пациентов с миелодисплазией и различными ее проявлениями: менингомиелоцеле, рахишизисе, Spina bifida (неполное закрытие позвоночного канала) и др. Лечению НДМП отводится важное звено в комплексной терапии. Устранение функциональных расстройств мочевых путей является сложнейшей задачей и требует длительного времени.
При гипорефлекторном детрузоре рекомендуются:
При гиперактивности детрузора назначаются:
Физиотерапевтическое лечение носит вспомогательный характер, однако значительно повышает эффективность терапии. Этот метод применяется как при НДМП, так и при воспалительных заболеваниях мочевых путей.
Отдельное место в лечении ПМР отводится эндоскопическим методам. Так, согласно опросу, проведенному итальянскими урологами, 80% родителей выбирают эндоскопическое лечение в качестве альтернативы открытым операциям и длительной медикаментозной терапии [7].
Приоритет в медицинском применении тефлоновой пасты принадлежит отоларингологу Arnold, использовавшему ее с целью коррекции голосовой щели (1962). Внедрение в урологическую практику тефлона состоялось в 1974 г., когда V. Politano выполнил парауретральную инъекцию по поводу недержания мочи. Впервые о малоинвазивном эндоскопическом способе коррекции ПМР заявил Е. Маtouschek. В 1981 г. он с положительным результатом выполнил инсуфляцию тефлоновой пасты ребенку 8 лет в область устья рефлюксирующего мочеточника [8]. Впоследствии O. Donnel совместно с P. Puri (1984) описали методику эндоскопического лечения ПМР [9]. За 25 лет опробовано большое количество имплантируемых материалов, начиная с тефлона и заканчивая культурами аутогенных клеток [8–16]. Наиболее полная классификация инъецируемых материалов выглядит следующим образом [17]:
Первый опыт применения антирефлюксных имплантантов настораживал специалистов в связи с возможностью развития нежелательных побочных эффектов: возникновения в месте инъекции некроза, малигнизации, миграции материала с формированием гранулем в регионарных лимфатических узлах и/или паренхиматозных органах [18–20]. Современными экспериментальными и клиническими работами доказана инертность и гипоаллергенность, безопасность используемых в настоящее время биоматериалов [12, 13]. Положительные результаты эндоскопического лечения ПМР, по данным недавних исследований, (Chertin, 2003; Kirsch, 2004) достигают 70–90%.
Показаниями к эндоскопическому способу коррекции ПМР являются неэффективность консервативной терапии в сроки от 6 до 12 мес. Отсутствие острой фазы воспаления мочевого пузыря — обязательное условие для эндоколлагенопластики.
Эндоскопический способ коррекции ПМР благодаря простоте выполнения и достаточно высокой при этом эффективности прочно входит в алгоритм лечебной тактики. Несомненно, важная роль должна отводиться правильному выбору показаний к этому методу. Коллагенизация устья мочеточника оправдана при нормальном его строении, т. е. отсутствии зияния устья и латеральной дистопии. При IV и V степенях ПМР и снижении секреторной функции почки > 50% показано выполнение открытой реимплантации мочеточника.
Метод эндоскопического лечения, направленный на удлинение интрамурального отдела мочеточника и уменьшение диаметра устья, выполняется по следующей методике. Производится цистоскопия, в ходе которой определяется клинико-анатомическая картина мочевого пузыря: состояние мочепузырного треугольника, форма и расположение устьев мочеточника, наличие парауретральных дивертикулов и уретероцеле, воспалительных изменений. Через рабочий канал тубуса цистоскопа проводится длинный инъектор (диаметр 5Сh), присоединенный к шприцу с коллагеном. Коллаген представлен субстанцией в виде геля. Стандартный объем коллагена в шприце — 2 мл. Вкол иглы инъектора (длина 6 мм) осуществляется под устье мочеточника — на 6 ч условного циферблата, на всю глубину. Для профилактики осложнений перед коллагенопластикой возможна катетеризация устья мочеточниковым катетером 5Сh. При давлении на поршень шприца с коллагеном в зоне вкола иглы постепенно образуется валик. В зависимости от степени зияния устья и длины подслизистого отдела мочеточника, вводится от 1 до 2 мл субстанции. При этом устье мочеточника приобретает точечную или щелевидную форму, после чего инструмент удаляется. Мочевой пузырь на сутки дренируется двупросветным уретральным катетером Фоли 8–14Сh, баллон которого наполняется на 5 мл.
Самым эффективным способом коррекции ПМР остается оперативный — 93–97% случаев [21]. Известно более 80 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Принципиальным механизмом всех видов открытых вмешательств является удлинение интрамурального отдела мочеточника с целью создания клапанного механизма, способного пропускать мочу в одном направлении из мочеточника в мочевой пузырь. Наиболее удачной признана техника тоннельного анастомоза, благодаря способности тоннеля противостоять высокому гидростатическому давлению внутри мочевого пузыря (как при наполненном мочевом пузыре, так и при мочеиспускании), препятствуя рефлюксу мочи в мочеточник.
Показаниями к хирургическому лечению являются: рефлюксирующий мегауретер (при ПМР IV, V степени), рецидивирующий характер ПМР при более низких степенях и отсутствии положительного эффекта от консервативного или эндоскопического лечения, сочетание рефлюкса с обструктивным компонентом в зоне ПМС.
В послеоперационный период всем пациентам обязательно проводится профилактическая антибиотикотерапия в течение 3–4 сут с последующим переходом на уросептическую терапию в течение 2–3 нед.
Публикации, касающиеся первого опыта использования тоннельной техники уретероцистоанастомоза, принадлежат D. Williams и J. Hutch и появились они в 60-х годах прошлого столетия [3]. По разным данным, известны от 80 до 120 способов открытого оперативного лечения ПМР — это различные модификации уретероцистоанастомоза. Одни выполняются со вскрытием мочевого пузыря (операции Коэна, Политано-Лидбеттера и др.) [22], другие без цистотомии (операции Лича–Грегуара [23, 24], Барри [22]). В любом возрасте эти операции проводятся с применением эндотрахеального наркоза. Осложнения открытых операций в большинстве случаев общие — кровотечение, развитие стриктуры анастомоза, нарушение эвакуации мочи на уровне пузырно-мочеточникового соустья в результате ангуляции и как следствие развитие ретенции верхних мочевых путей, рецидив ПМР, послеоперационный цистит и пиелонефрит [25].
В России наиболее часто выполняются операции Коэна и Политано–Лидбеттера. Уретероцистоанастомоз по Коэну выполняется через разрез передней стенки мочевого пузыря и основан на принципе удлинения внутрипузырной части мочеточника путем его реимплантации во вновь сформированный подслизистый тоннель. Специфичными осложнениями данного способа являются кровотечение из мочепузырного треугольника (Льето) и юкставезикального отдела мочеточника, развитие послеоперационного цистита. Послеоперационное кровотечение из треугольника Льето связано с формированием подслизистого тоннеля в наиболее кровоснабжаемой зоне мочевого пузыря, что обусловлено анатомическими особенностями. Послеоперационное кровотечение из юкставезикального отдела мочеточника возникает вследствие разрыва регионарных артериальных и венозных сплетений во время его слепой тракции для проведения через подслизистый тоннель. Оба варианта кровотечений требуют повторной ревизии операционной раны, гемостаза и ухудшают результат реконструктивно-пластической операции. Из-за чреспузырного доступа, особенностями и слабыми сторонами уретероцистоанастомоза по Коэну являются пересечение всех слоев стенки мочевого пузыря с развитием рубца, препятствующего нормальной сократительной способности пузыря; невозможность расправления перегибов расширенного мочеточника и выполнения его моделирования перед реимплантацией, необходимость в которых возникает при IV и V степенях ПМР (на долю IV и V степеней приходится до 60% среди всех оперативных вмешательств).
В основе принципа уретероцистоанастомоза по Политано–Лидбеттеру лежит создание подслизистого тоннеля мочевого пузыря. Особенностью техники является широкое вскрытие мочевого пузыря и рассечение слизистой оболочки мочевого пузыря в трех местах для создания тоннеля, при этом отсечение мочеточника производится с внешней стороны мочевого пузыря, так как данный способ предполагает резекцию расширенного мочеточника. Специфичными осложнениями операции по Политано-Лидбеттеру являются развитие рубца в месте вскрытия пузыря; развитие ангуляции предпузырного отдела мочеточника из-за использования техники анастомозирования и образование стриктур пузырно-мочеточникового анастомоза, не поддающихся эндоскопической коррекции. Характерным рентгенологическим симптомом ангуляции мочеточника является его трансформация в виде рыболовного крючка. На практике это значительно снижает возможность катетеризации почки при возникающей необходимости (например, при мочекаменной болезни). Применение столь травматичного способа уретероцистоанастомоза при отсутствии расширения мочеточника ограничено или неоправданно.
Экстравезикальный способ уретероцистоанастомоза является максимально эффективным оперативным вмешательством у детей с ПМР (98%). В задачи уретероцистоанастомоза входит создание надежного клапанного механизма ПМС, формирование адекватного просвета мочеточника, не препятствующего свободному пассажу мочи. Экстравезикальная методика уретероцистоанастомоза в полной мере отвечает предъявляемым требованиям. Использование экстравезикальной методики позволяет избежать вскрытия мочевого пузыря (широкого рассечения детрузора) и в то же время дает возможность сформировать подслизистый тоннель на любом участке стенки мочевого пузыря, выбрав бессосудистую зону. Длина тоннеля также может быть выбрана хирургом произвольно.
Появление новых эффективных препаратов при фармакологическом консервативном лечении ПМР у детей, с одной стороны, и внедрение в практическую медицину новых оперативных способов лечения, включая лапароскопическую хирургию, робототехнику — с другой, безусловно, в будущем изменит значение обычных открытых способов коррекции ПМР. Но сегодня в стратегии лечения ПМР открытые оперативные вмешательства играют ключевую роль, так как они позволяют ликвидировать самые сложные формы ПМР.
В заключение хотелось бы подчеркнуть, что выбор метода коррекции ПМР должен быть строго индивидуальным и основываться на объективном анализе врачом данных обследования и оценке возможности применения всех имеющихся способов устранения ПМР у данного конкретного больного.
Литература
А. Ю. Павлов, доктор медицинских наук
С. А. Маслов
Н. В. Поляков, кандидат медицинских наук
А. А. Лисенок, кандидат медицинских наук
Г. В. Симонян
НИИ урологии, Москва