что такое глюкагон и для чего он нужен
ГлюкаГен® 1мг ГипоКит
Инструкция
Торговое наименование
ГлюкаГен® 1 мг ГипоКит
Международное непатентованное название
Лекарственная форма
Лиофилизат для приготовления раствора для инъекций 1 мг в комплекте с растворителем
Состав
Один флакон содержит
состав растворителя на один шприц: стерильная вода для инъекций
Описание
Лиофилизированный порошок белого цвета.
Восстановленный препарат – прозрачный бесцветный раствор.
Фармакотерапевтическая группа
Гормоны поджелудочной железы. Гормоны, расщепляющие гликоген. Глюкагон.
Фармакологические свойства
Фармакокинетика
Глюкагон имеет короткий период полураспада в крови около 3-6 минут. Скорость метаболического клиренса глюкагона в организме человека составляет около 10 мл/кг/мин.
Фармакодинамика
Глюкагон является гипергликемическим агентом, мобилизующим гликоген в печени, который выделяется в кровь в виде глюкозы. Глюкагон ингибирует тонус и моторику гладкой мускулатуры желудочно-кишечного тракта.
При лечении тяжелой гипогликемии действие глюкагона на концентрацию глюкозы в крови обычно наблюдается в течение 10 минут.
Ингибирующее действие препарата на гастроинтестинальную моторику начинается через 1 минуту после внутривенной инъекции, длительность действия препарата составляет 5-20 минут в зависимости от дозы. Действие препарата начинается через 5-15 минут после внутримышечной инъекции и длится от 10 до 40 минут в зависимости от дозы.
Показания к применению
— тяжелые гипогликемические состояния, возникающие у больных сахарным диабетом после инъекции инсулина
— для диагностики: подавление моторики при проведении обследования органов желудочно-кишечного тракта
Способ применения и дозы
Дозирование
Терапевтическое показание (Тяжелая гипогликемия)
Дозировка для взрослых пациентов: Вводят 1 мг с помощью подкожной или внутримышечной инъекции.
Глюкаген 1 мг гипокит : инструкция по применению
Состав
Вспомогательные вещества: лактозы моногидрат, вода для инъекций.
(В состав могут также входить кислота хлористоводородная и/или натрия гидроксид, используемые при производстве препарата для подбора pH).
Описание
Фармакологическое действие
Фармакокинетика
Показания к применению
Противопоказания
Беременность и период лактации
Для диагностики (подавление сократительной способности органов желудочно- кишечного тракта)
ГлюкаГен® 1 мг ГипоКит должен вводиться только медицинским персоналом. После внутривенного введения 0,2-0,5 мг действие препарата начинается в течение 1 минуты и длится от 5 до 20 минут в зависимости от обследуемого органа. После внутримышечного введения 1-2 мг действие препарата
начинается через 5-15 минут и продолжается 10-40 минут в зависимости от обследуемого органа.
После завершения процедуры пациенту надо дать богатые углеводами продукты, если это совместимо с применяемой диагностической процедурой.
В зависимости от используемого метода диагностики и способа введения, доза препарата составляет 0,2-2 мг. Обычная диагностическая доза, используемая для расслабления мышц желудка, луковицы двенадцатиперстной кишки, двенадцатиперстной кишки и тонкой кишки, составляет 0,2-0,5 мг при внутривенном введении и 1 мг при внутримышечном введении. Доза для расслабления мышц прямой кишки составляет 0,5-0,75 мг при внутривенном введении и 1-2 мг при внутримышечном введении.
Побочное действие
Частота возникновения побочных реакций, связанных с применением препарата ГлюкаГен® 1 мг ГипоКит как в клинических исследованиях, так и в процессе постмаркетингового наблюдения, представлена ниже. Побочные реакции, которые не наблюдались в ходе клинических исследований, но о которых поступали спонтанные сообщения, представлены как «очень редкие». Сообщения о побочных реакциях при постмаркетинговом использовании очень редки. Однако, для постмаркетинговых исследований характерны заниженные данные побочных реакций, что следует учитывать при интерпретации полученных результатов о количестве этих реакций. Количество эпизодов использования препарата оценивается как 46,9 миллионов за 16 лет.
Частота побочных реакций определялась следующим образом: очень редко ( 1/10000, 1/1000, 1/100,
Содержание
Глюкагон [ править | править код ]
Историческая справка [ править | править код ]
Еще до открытия инсулина в островках поджелудочной железы были обнаружены разные группы клеток. Сам глюкагон был открыт Мерлином и Кимбаллом в 1923 г., менее чем через 2 года после инсулина. Однако если открытие инсулина вызвало ажиотаж, то глюкагоном мало кто заинтересовался. Только по прошествии более 40 лет стало ясно, какую важную физиологическую роль играет этот гормон в регуляции обмена глюкозы и кетоновых тел, но его роль как лекарственного средства и на сегодняшний день невелика. Глюкагон используют лишь для быстрого купирования гипогликемии, а также в лучевой диагностике в качестве препарата, подавляющего моторику кишечника.
Химические свойства [ править | править код ]
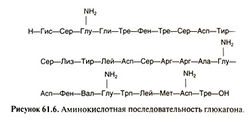
Глюкагон представляет собой одноцепочечный полипептид, состоящий из 29 аминокислотных остатков (рис. 61.6). Между глюкагоном и другими полипептидными гормонами, в том числе секретином, ВИП и гастроингибирующим пептидом, имеется значительная гомология. Аминокислотная последовательность глюкагона у млекопитающих высококонсервативна; она одинакова у человека, коровы, свиньи и крысы.
Глюкагон образуется из препроглюкагона — пептида-предшественника, состоящего из 180 аминокислот и пяти доменов которые подвергаются раздельному процессингу (Bell et al., 1983). За N-концевым сигнальным пептидом в молекуле препроглюкагона следует глицентиноподобный панкреатический пептид затем идут аминокислотные последовательности глюкагона и глюкагоноподобных пептидов типов 1 и 2. Процессинг препроглюкагона осуществляется в несколько этапов и зависит от ткани, в которой он происходит. В результате из одного и того же препрогормона в а-клетках островков поджелудочной железы и в нейроэндокринных клетках кишечника (L-клетках) образуются разные пептиды (Mojsov et al., 1986). Глицентин, важнейший промежуточный продукт процессинга, состоит из N-концевого глицентиноподобного панкреатического пептида и С-концево-го глюкагона, разделенных между собой двумя остатками аргинина. Оксинтомодулин состоит из глюкагона и С-концевого гексапептида, тоже разделенных между собой двумя остатками аргинина.
Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике. Их секреция продолжается и после панкреатэктомии.
Регуляция секреции [ править | править код ]
Секреция глюкагона регулируется глюкозой, поступающей с пищей, инсулином, аминокислотами и жирными кислотами. Глюкоза — мощный ингибитор секреции глюкагона. При приеме внутрь она оказывает гораздо более сильное действие на секрецию глюкагона, чем при в/в введении (как, впрочем, и на секрецию инсулина). Вероятно, эффект глюкозы опосредуется какими-то пищеварительными гормонами. Он утрачивается при нелеченном или декомпенсированном инсулинозависимом сахарном диабете, отсутствует и в культуре a-кпеток. Следовательно, действие глюкозы на а-клетки, по крайней мере отчасти, зависит от стимуляции ею секреции инсулина. Соматостатин, свободные жирные кислоты и кетоновые тела тоже тормозят секрецию глюкагона.
Большинство аминокислот стимулируют секрецию и глюкагона, и инсулина. Это объясняет, почему после приема чисто белковой пищи у человека не возникает опосредованная инсулином гипогликемия. Подобно глюкозе, аминокислоты более эффективны при приеме внутрь, чем при в/в введении. Следовательно, их эффект также может быть отчасти опосредован пищеварительными гормонами. Кроме того, секреция глюкагона находится под контролем вегетативной нервной системы. Раздражение симпатических нервных волокон, иннервирующих островки поджелудочной железы, а также введение адреностимуляторов и симпатомиметиков усиливают секрецию этого гормона. Ацетилхолин обладает аналогичным действием. Глюкагон при сахарном диабете. У больных с декомпенсированным сахарным диабетом концентрация глюкагона в плазме повышена. Благодаря своей способности усиливать глюконеогенез и гликогенолиз глюкагон усугубляет гипергликемию. Однако нарушения секреции глюкагона при сахарном диабете, по-ви-димому, носят вторичный характер и исчезают при нормализации уровня глюкозы в крови (Unger, 1985). Роль гиперглюкагонемии при сахарном диабете прояснили эксперименты с введением соматостатина (Gerich et al., 1975). Соматостатин, хотя и не нормализует полностью метаболизм глюкозы, существенно замедляет скорость развития гипергликемии и кетонемии у больных инсулинозависимым сахарным диабетом после внезапной отмены инсулина. У здоровых людей в ответ на гипогликемию секреция глюкагона увеличивается, а при инсулинозависимом сахарном диабете этот важный защитный механизм утрачивается еще в самом начале болезни.
Метаболизм [ править | править код ]
Глюкагон быстро разрушается в печени, почках и плазме, а также в тканях-мишенях (Peterson etal., 1982). EroT1/2 в плазме составляет всего 3—6 мин. Отщепление протеазами N-концевого остатка гистидина приводит к потере глюкагоном биологической активности.
Механизм действия [ править | править код ]
Глюкагон связывается с рецептором на мембране клеток-мишеней; этот рецептор представляет собой гликопротеид с молекулярной массой 60 ООО (Sheetz and Tager, 1988). Структура рецептора полностью не расшифрована, однако известно, что он сопряжен с Gj-белком, который активирует аденилатциклазу (гл. 2). Главный эффект глюкагона на гепатоциты опосредуется цАМФ. Модификация N-концевого участка молекулы глюкагона превращает его в частичный агонист: сродство к рецептору в той или иной степени сохраняется, а способность активировать аденилатциклазу в значительной степени утрачивается (Unson et al., 1989). Так ведут себя, в частности, [Фен’]-глюкагон и дез-Гис’-[Глу9]-глюкагонамид.
Посредством цАМФ-зависимого фосфорилирования глюкагон активирует фосфорилазу — фермент, который катализирует лимитирующую реакцию гликогенолиза. Одновременно происходит фосфорилирование гликогенсинтетазы, и ее активность снижается. В результате гликогенолиз усиливается, а гликогенез тормозится. цАМФ стимулирует также транскрипцию гена фосфоенолпируваткарбоксикиназы — фермента, который катализирует лимитирующую реакцию глюконеогенеза (Granner et al., 1986). В норме инсулин вызывает противоположные эффекты, и когда концентрации обоих гормонов максимальны, действие инсулина преобладает.
цАМФ опосредует фосфорилирование еще одного бифункционального фермента — 6-фосфофрукто-2-киназы/фрукто-зо-2,6-дифосфатазы (Pilkis et al., 1981; Foster, 1984). От этого фермента зависит внутриклеточная концентрация фруктозо-2,6-дифосфата, который, в свою очередь, регулирует глюконеогенез и гликогенолиз. Когда концентрация глюкагона высока, а инсулина низка, 6-фосфофрукто-2-киназа/фрукго-зо-2,6-дифосфатаза фосфорилируется и работает как фосфата-за, снижая содержание фруктозо-2,6-дифосфата в печени. Когда концентрация инсулина высока, а глюкагона низка, фермент дефосфорилируется и работает как киназа, увеличивая содержание фрукгозо-2,6-дифосфата. Фруктозо-2,6-дифосфат является аллостерическим активатором фосфофруктокиназы — фермента, который катализирует лимитирующую реакцию гликолиза. Таким образом, когда концентрация глюкагона высока, гликолиз тормозится, а глюконеогенез усиливается. Это приводит к увеличению уровня малонил-КоА, ускорению окисления жирных кислот и кетогенезу. Напротив, когда высока концентрация инсулина, гликолиз усиливается, а глюконеогенез и ке-тогенез подавляются (Foster, 1984).
Глюкагон, особенно в высоких концентрациях, действует не только на печень, но и на другие ткани. В жировой ткани он активирует аденилатциклазу и усиливает липолиз, в миокарде — увеличивает силу сердечных сокращений. Глюкагон расслабляет гладкие мышцы ЖКТ; такой же эффект оказывают аналоги гормона, не активирующие аденилатциклазу. В некоторых тканях (в том числе в печени) имеется еще один тип рецепторов глюкагона; связывание гормона с ними приводит к образованию ИФ3, ДАГ и увеличению внутриклеточной концентрации кальция (Murphy et al., 1987). Роль этого рецептора глюкагона в регуляции метаболизма остается неизвестной.
Применение [ править | править код ]
Глюкагон используют для лечения тяжелых эпизодов гипогликемии, обычно у больных сахарным диабетом, когда невозможно организовать в/в инфузию глюкозы. Кроме того, глюкагон применяют в лучевой диагностике как средство, подавляющее моторику ЖКТ.
Глюкагон, применяемый в лечебных целях, получают из бычьей и свиной поджелудочных желез. Аминокислотные последовательности человеческого, бычьего и свиного глюкагона идентичны. При гипогликемии 1 мг глюкагона вводят в/в, в/м или п/к. В экстренных ситуациях первые два пути введения предпочтительны. Улучшение наступает в течение 10 мин, что позволяет свести к минимуму риск поражения ЦНС. Гипергликемизирующий эффект глюкагона кратковременен и может вообще не проявиться, если запасы гликогена в печени истощены. После улучшения, наступившего под действием глюкагона, больному вводят глюкозу либо заставляют его что-нибудь съесть, чтобы предотвратить рецидив гипогликемии. Самые частые побочные эффекты глюкагона — тошнота и рвота.
Глюкагон назначают перед рентгеноконтрастными исследованиями верхних и нижних отделов ЖКТ, перед ретроградной идеографией (Monsein et al., 1986) и перед MPT (Goldberg and Thoeni, 1989) для того, чтобы расслабить гладкие мышцы желудка и кишечника. Его используют также для снятия спазма при остром дивертикулите, патологии желчных путей и сфинктера Одди, как вспомогательное средство при удалении желчных камней с помощью петли Дормиа, а также при обструкции пищевода и инвагинации кишечника (Friedland, 1983; Mortens-sonetal., 1984; Kadir and Gadacz, 1987). Введение глюкагона облегчает дифференциальную диагностику механической и паренхиматозной желтухи (Berstock et al., 1982).
Глюкагон стимулирует выброс катехоламинов клетками феохромоцитомы и используется как экспериментальное диагностическое средство при этой опухоли. Кроме того, глюкагоном пытались лечить шок, используя его инотропное действие на сердце. Препарат оказался полезным для тех больных, которые принимали β-адреноблокаторы, потому что β-адреностимуляторы у них неэффективны.
Глюкагон
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Глюкагон.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Глюкагон.jpg?fit=825%2C550&ssl=1″ />
Глюкагон вырабатывается для поддержания уровня глюкозы в кровотоке при голодании и для повышения очень низкого уровня глюкозы.
Что такое глюкагон?
Глюкагон — это гормон, участвующий в контроле уровня сахара (глюкозы) в крови. Он вырабатывается альфа-клетками, обнаруженными на островках Лангерганса, в поджелудочной железе, откуда он попадает в кровоток. Альфа-клетки, секретирующие глюкагон, окружают секретирующие инсулин бета-клетки, что отражает тесную взаимосвязь между двумя гормонами.
Роль глюкагона в организме заключается в предотвращении слишком низкого падения уровня глюкозы в крови. Для этого он действует на печень несколькими способами:
Как контролируется глюкагон?
» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Как-контролируется-глюкагон.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Как-контролируется-глюкагон.jpg?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/%D0%9A%D0%B0%D0%BA-%D0%BA%D0%BE%D0%BD%D1%82%D1%80%D0%BE%D0%BB%D0%B8%D1%80%D1%83%D0%B5%D1%82%D1%81%D1%8F-%D0%B3%D0%BB%D1%8E%D0%BA%D0%B0%D0%B3%D0%BE%D0%BD.jpg?resize=900%2C600&ssl=1″ alt=»Как контролируется глюкагон?» width=»900″ height=»600″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Как-контролируется-глюкагон.jpg?w=900&ssl=1 900w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Как-контролируется-глюкагон.jpg?resize=450%2C300&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Как-контролируется-глюкагон.jpg?resize=825%2C550&ssl=1 825w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Как-контролируется-глюкагон.jpg?resize=768%2C512&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Как контролируется глюкагон?
Глюкагон работает вместе с гормоном инсулином, чтобы контролировать уровень сахара в крови и поддерживать его в пределах установленного уровня. Глюкагон высвобождается, чтобы остановить слишком низкое падение уровня сахара в крови (гипогликемия), в то время как инсулин высвобождается, чтобы остановить слишком высокий уровень сахара в крови (гипергликемия).
Высвобождение глюкагона стимулируется низким уровнем глюкозы в крови, приемом пищи, богатой белком, и адреналином (еще один важный гормон для борьбы с низким уровнем глюкозы). Высвобождению глюкагона препятствует повышенный уровень глюкозы в крови и углеводов в пище, обнаруживаемый клетками поджелудочной железы.
В долгосрочной перспективе глюкагон имеет решающее значение для реакции организма на недостаток пищи. Например, он поощряет использование накопленного жира для получения энергии, чтобы сохранить ограниченное количество глюкозы.
Что произойдет, если у меня будет слишком много глюкагона?
Редкая опухоль поджелудочной железы, называемая глюкагономой, может секретировать чрезмерное количество глюкагона. Это может вызвать:
Что произойдет, если у меня будет слишком мало глюкагона?
Сообщалось о необычных случаях недостаточности секреции глюкагона у младенцев. Это приводит к очень низкому уровню глюкозы в крови, неконтролируемому без введения глюкагона.
Глюкагон можно вводить путем инъекции, чтобы восстановить уровень глюкозы в крови, пониженный инсулином (даже у пациентов без сознания). Он может увеличить высвобождение глюкозы из запасов гликогена в большей степени, чем инсулин может его подавить. Эффект глюкагона ограничен, поэтому очень важно есть углеводную пищу, когда человек достаточно выздоровел, чтобы питаться безопасно.
Что такое глюкагон и для чего он нужен
Глюкагон — гормон, секретируемый альфа-клетками островков Лангерганса при снижении уровня глюкозы в крови. Он выполняет функции, диаметрально противоположные функциям инсулина. Наиболее важная из них — увеличение уровня глюкозы в крови, т.е. действие, прямо противоположное влиянию инсулина.
Подобно инсулину глюкагон является крупным полипептидом. Его молекулярная масса — 3485, он состоит из цепочки из 29 аминокислот. Введение чистого глюкагона животным сопровождается выраженной гипергликемией. Инъекция 1 мкг/кг глюкагона способна увеличить концентрацию глюкозы в крови на 20 мг/дл крови (увеличение на 25%) в течение 20 мин. По этой причине глюкагон также называют гипергликемическим гормоном.
а) Влияние на метаболизм глюкозы. Главные влияния глюкагона на метаболизм глюкозы заключаются в:
(1) расщеплении гликогена печени (гликогенолиз);
(2) увеличении глюконеогенеза в печени.
Оба этих эффекта приводят к существенному увеличению глюкозы в других органах.
б) Глюкагон вызывает гликогенолиз и увеличивает концентрацию глюкозы в крови. Наиболее мощный эффект глюкагона опосредован его способностью вызывать гликогенолиз в печени, увеличивая таким образом концентрацию глюкозы в крови в течение нескольких минут.
Это достигается комплексом последовательных событий.
1. Глюкагон активирует аденилатциклазу в мембране гепатоцитов.
2. Это приводит к образованию циклического аденозинмонофосфата.
3. цАМФ активирует белок-регулятор протеинкиназы.
4. Белок-регулятор протеинкиназы активирует протеинкиназу.
5. Это, в свою очередь, приводит к активации киназы фосфорилазы В.
6. Киназа фосфорилазы В превращает фосфорилазу в фосфорилазу А.
7. Это обеспечивает расщепление гликогена и появление глюкозо-1-фосфата.
8. Глюкозо-1-фосфат дефосфорилируется, затем глюкоза выделяется из клеток печени.
Эта последовательность событий чрезвычайно важна по нескольким причинам: во-первых, это один из наиболее тщательно изученных процессов, где циклический аденозинмонофосфат функционирует как вторичный посредник; во-вторых, это демонстрация каскадной системы, в которой каждый последующий продукт производится в большем количестве, чем предшествующий, поэтому данный процесс дает представление о возможностях механизма биологического усиления. Такой тип механизма усиления используется повсеместно в организме для управления многими, если не большинством клеточных метаболических систем, т.к. часто усиливающий эффект этого механизма возрастает в миллион раз. Это объясняет способность всего нескольких микрограмм глюкагона буквально за несколько минут обеспечить увеличение концентрации глюкозы в крови в 2 раза по сравнению с исходным уровнем.
Инъекция глюкагона всего через 4 ч может вызвать столь интенсивный гликогенолиз, что это приведет к опустошению депо гликогена в печени.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021