что такое гликолиз в биологии
Гликолиз
Гликолиз (греч. glycos — сладкий, lysis — расщепление) — первый этап клеточного дыхания, представляющий собой последовательность реакций, в ходе которых одна молекула глюкозы (C6H12O6) расщепляется на две молекулы пировиноградной кислоты (C3H4O3). Реакции протекают в цитоплазме без участия кислорода, но при участии ферментов. В пирувате атомы углерода оказываются в более окисленной форме, так как четыре атома водорода отщепляются и восстанавливают другое соединение (НАД до НАД · H2).
Суммарное уравнение реакции гликолиза
Чистый выход энергии, запасенной в АТФ, всего две молекулы, что говорит о малой эффективности этого этапа клеточного дыхания. Основная часть энергии глюкозы остается в пировиноградной кислоте, а также запасается в НАД · H2. При аэробном дыхании эта энергия потом используется для получения основного количества молекул АТФ.
Поскольку глюкоза при гликолизе теряет четыре атома водорода, то происходит ее окисление. Акцепторами водорода выступают молекулы никотинамидадениндинуклеотида (НАД + ).
Глюкоза не сразу распадается до пирувата, а через ряд последовательных реакций. Суммарно их можно представить в виде трех этапов:
Глюкоза фосфорилируется за счет фосфатных групп АТФ и превращается в фруктозо-1,6-бифосфат. При этом используются две молекулы АТФ, которые становятся АДФ.
Фруктозо-1,6-бифосфат расщепляется на два фосфорилированных трехуглеродных сахара.
Эти сахара превращаются в пировиноградную кислоту. При этом синтезируется четыре молекулы АТФ, а к двум молекулам НАД присоединяется водород.
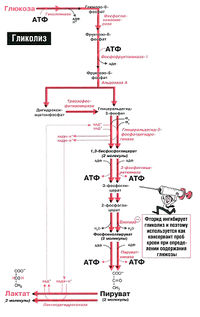
В гликолизе участвуют около девяти ферментов, составляющих конвейер. Как видно из схемы, гликолиз протекает в десять стадий.
При дальнейшем окислении пировиноградной кислоты в митохондриях используется энергия, запасенная в НАД · H2.
В процессе эволюции гликолиз – первым способом получения АТФ. В наше время он характерен как для прокариот, так и эукариот как один из этапов клеточного дыхания.
Следует иметь в виду, что в клетках гликолиз — не единственный способ окисления глюкозы.
Гликолиз
Содержание
Гликолиз [ править | править код ]
Гликолиз – процесс распада одной молекулы глюкозы с выделением энергии, достаточной для «зарядки» двух молекул АТФ, протекает в саркоплазме под воздействием 10 специальных ферментов.
Гликолиз может протекать без потребления кислорода (такие процессы называются анаэробными) и с потреблением кислорода (аэробный гликолиз) способен быстро восстанавливать запасы АТФ в мышце.
При занятиях бодибилдингом и высокоинтенсивных упражнениях происходит анаэробный гликолиз, с образованием молочной кислоты.
Во время динамических нагрузок, таких как бег, плавание и т.п., происходит аэробный гликолиз.
Аэробный гликолиз происходит в митохондриях под воздействием специальных ферментов и требует затрат кислорода, а соответственно и времени на его доставку. Окисление происходит в несколько этапов, сначала идет гликолиз, но образовавшиеся в ходе промежуточного этапа этой реакции две молекулы пирувата не преобразуются в молекулы молочной кислоты, а проникают в митохондрии, где окисляются в цикле Кребса до углекислого газа СО2 и воды Н2О и дают энергию для производства еще 38 молекул АТФ. Суммарное уравнение реакции окисления глюкозы выглядит так:
Распад глюкозы по аэробному пути (аэробный гликолиз) дает энергию для восстановления 38 молекул АТФ. Аэробное окисление в 19 раз эффективнее анаэробного гликолиза.

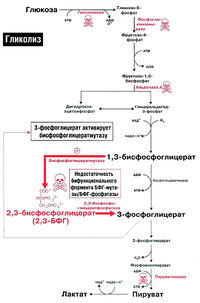
Анаэробный гликолиз глюкозы в эритроцитах, 2,3-БФГ и эффект Бора [ править | править код ]
Эритроциты транспортируют большое количество кислорода, которым снабжают все органы человека. По иронии судьбы сами они не могут использовать этот кислород. Источником энергии для эритроцитов служит глюкоза, при окислении которой в ходе анаэробного гликолиза в эритроцитах образуется АТФ (рис. 18.1). Аэробное окисление глюкозы в эритроцитах невозможно, так как в них отсутствуют митохондрии и вместе с ними все ферменты цикла Кребса. Кроме того, в них отсутствуют также ферменты, необходимые для окисления жирных кислот и использования кетоновых тел.
Функция эритроцитов — транспорт кислорода ко всем органам и тканям организма. Гемоглобин эритроцитов прочно связывается с кислородом, образуя оксигемоглобин. Однако в периферических тканях эритроциты должны отдать этот кислород другим клеткам. Это осуществляется благодаря явлению, известному под названием эффекта Бора. Эффект Бора создается благодаря двум факторам: протонам и 2,3-бисфосфоглицерату (рис. 18.2).
Работающим мышцам необходим АТФ, и поэтому в них интенсивно функционирует цикл Кребса. В цикле Кребса образуется диоксид углерода, который проникает в эритроциты и реагирует с водой, образуя угольную кислоту (эту реакцию катализирует карбоангидраза). Угольная кислота самопроизвольно диссоциирует, образуя бикарбонат и протон, что приводит к местному возрастанию концентрации протонов (Н+), т.е. понижению pH. Протоны высвобождают кислород из гемоглобина, и кислород диффундирует из эритроцитов в периферические ткани. Здесь он связывается с миоглобином и переносит кислород в дыхательную цепь, где он используется для синтеза АТФ путем окислительного фосфорилирования.
2,3-БФГ-шунта (шунт Рапопорта-Люберинга) (рис. 18.2). В периферических тканях молекула 2,3-БФГ связывается с дезоксигемоглобином и стабилизирует его структуру, не позволяя ему захватывать кислород от соседней молекулы оксигемоглобина.
2.3- БФГ в норме и при патологии [ править | править код ]
Эмбриональный гемоглобин имеет низкое сродство к 2,3-БФГ [ править | править код ]
Гемоглобин — тетрамер. состоящий из двух альфа-цепей и двух бета-цепей. Фетальный гемоглобин имеет иное строение: он состоит из двух а-цепей и двух у-цепей. По сравнению с нормальным гемоглобином взрослого человека, фетальный гемоглобин имеет более низкое сродство к 2,3-БФГ. Это значит, что сродство к кислороду у фетального гемоглобина выше, чем у гемоглобина материнского организма. Благодаря этому происходит транспорт кислорода от материнского организма к азолу.
2.3- БФГ и высотная адаптация [ править | править код ]
Предположим, что некий житель низин решил провести отпуск в горах. В первые дни отпуска даже незначительные физические нагрузки вызовут у него усталость и одышку. Но за несколько дней произойдет адаптация к высокогорью — в эритроцитах повысится концентрация 2,3-БФГ. Благодаря этому ткани станут получать кислород в достаточном количестве. несмотря на то что его концентрация в разреженном горном воздухе невысока. Повышение концентрации 2,3-БФГ — ответная реакция организма на недостаток кислорода
У курящих лиц концентрация 2,3-БФГ в эритроцитах выше, чем у некурящих. Так организм компенсирует сниженное вследствие постоянного воздействия угарного газа обеспечение тканей кислородом. Компенсаторное повышение уровня 2.3- БФГ также часто наблюдается у больных хроническими анемиями, обструктивной болезнью легких, при врожденных пороках сердца и муковисцидозе.
Энзимопатии гликолитического пути в эритроцитах [ править | править код ]
В редких случаях из-за врожденной недостаточности гликолитических ферментов в эритроцитах развивается наследственная несфероцитарная гемолитическая анемия. Это заболевание может быть весьма тяжелым, поскольку в эритроцитах гликолиз — единственный путь синтеза и АТФ и 2.3-БФГ.
Нарушения гликолитического ферментативного аппарата могут по-разному сказываться на метаболизме 2.3-БФГ (рис. 18.2). Если нарушение расположено проксимально по отношению к 2.3-БФГ-шунту (например, при недостаточности гексокиназы, фосфоглюкоизомеразы или альдолазы А), уровень 2,3-БФГ будет снижен, так как будет снижена интенсивность синтеза его предшественников. Если же нарушение расположено после 2.3-БФГ-шунта (например, недостаточность пируваткиназы). концентрация 2.3-БФГ в эритроцитах будет повышена.
Кроме того, у ряда больных была обнаружена недостаточность бифункционального фермента шунта — БФГ-мутазы/2,3-БФГ-фосфагазы. У таких больных концентрация 2.3- БФГ была низкой.
Номенклатура альдолаз [ править | править код ]
Чтобы учащийся не путал разные термины, необходимо разобраться в номенклатуре альдолаз. Альдолаза (полное название — фруктозо-1,6-бисфосфат-атьдолаза) по официальной номенклатуре называется D-глицеральдегид-З-фосфатлиазой (КФ 4.1.2.13). Она выполняет три функции:
У животных обнаружены три формы альдолазы.
Альдолаза А. Содержится в эритроцитах и мышцах. При наследственной гемолитической анемии в крови содержится дефектная форма альдолазы А.
Альдолаза В. Недостаточность альдолазы В приводит к наследственной непереносимости фруктозы. Альдолаза В присутствует в печени, почках и тонком кишечнике.
Альдолаза С. Содержится в головном мозге.
Взаимосвязь гликолиза и аэробных реакций [ править | править код ]
Два способа оценки аэробных возможностей организма (прямая оценка показателя максимального устойчивого состояния по лактату и косвенная оценка аэробно-анаэробного перехода) основаны на классической теории активации гликолиза, предложенной А. Хиллом. В основу этой теории легла гипотеза о том, что активация гликолиза в мышечном волокне запускается при снижении аэробного ресинтеза АТФ. Основной причиной снижения аэробного ресинтеза АТФ должно быть неадекватное снабжение клетки кислородом, т.е. фактически снижение внутриклеточного парциального давления кислорода до критического уровня (0,1—0,5 мм рт. ст.), ниже которого нормальное функционирование митохондрий невозможно. Прямо проверить данное предположение оказалось методически достаточно сложно.
Относительно недавно появились исследования, в которых in situ было измерено внутримышечное парциальное давление кислорода, связанного с миоглобином, во время максимального теста с возрастающей нагрузкой в т. gracilis у собаки методом криомикроспектроскопии. Среднее парциальное давление кислорода, связанного с миоглобином, при работе на уровне МПК значительно выше критического и составляет 5,5 мм рт. ст., при этом не удается обнаружить связь между ПК мышцей или средним парциальным давлением кислорода в волокне и концентрацией лактата в мышце или суммарным выходом лактата из мышцы.
Сходные результаты получены при измерении внутримышечного парциального давления кислорода во время максимального теста с повышающейся нагрузкой (50-100% от пикового ПК) у тренированных велосипедистов в условиях in vivo при разгибании ноги в коленном суставе. Исследователи получили достаточно неожиданный результат. Оказалось, что парциальное давление кислорода в миоглобине не изменяется на протяжении всего теста с возрастающей нагрузкой (50—100% от пикового ПК) вплоть до отказа от работы. Среднее парциальное давление кислорода, связанного с миоглобином, составляет 3,1 мм рт. ст. Любопытно, при работе в гипоксических условиях (F,02—0,12) парциальное давление кислорода, связанного с миоглобином, оказывается достоверно ниже, чем в нормоксии и составляет 2,1 мм рт. ст. Оно также не изменяется во всем диапазоне нагрузок (50
100% от пикового ПК). При этом потребление кислорода тканями рабочей ноги, измеренное с помощью прямого метода (по Фику), линейно растет вплоть до отказа от работы, как в гипоксических, так и в нормоксических условиях.
Таким образом, даже при гипоксии во время максимальной нагрузки парциальное давление кислорода в миоглобине не падает ниже критического уровня. Однако при этом наблюдается увеличение скорости суммарного выхода лактата из рабочей мышцы, измеренное с помощью прямого метода. Причем работа в условиях гипоксии приводила к значительно более интенсивному выходу лактата (относительно нормированной мощности работы), чем работа в нормоксических условиях. На основании этих данных можно сделать вывод о том, что парциальное напряжение кислорода в активной мышечной клетке не является ключевым фактором, активирующим гликолиз. В то же время опыты с гипоксией дают основание полагать, что парциальное давление кислорода в цитоплазме может модулировать активность гликолиза. Увеличение суммарного выхода лактата из мышцы, как в условиях нормоксии, так и в условиях гипоксии, регулируется, главным образом, активацией симпато-адреналовой системы. Это подтверждается сходной динамикой концентрации адреналина в артериальной крови и суммарного выхода лактата из рабочей мышцы. Влияние симпато-адреналовой системы на гликолиз подтверждается и рядом других работ, в которых исследовали изменения концентрации катехоламинов во время нагрузки, а также опытами с применением бета-блокаторов.
Среди других возможных кандидатов на роль активаторов гликолиза выделяют: АДФ, АМФ, неорганический фосфат, отношение креатин/фосфокреатин и цитоплазматический окислительно-востановительный потенциал (НАДН+/НАД+).
Суммируя результаты описанных исследований, можно сказать, что парциальное давление кислорода в цитоплазме мышечной клетки не опускается до критичного уровня даже при работе максимальной аэробной мощности. Это означает, что активность гликолиза в мышечном волокне во время работы не зависит от скорости аэробного ресинтеза АТФ или, по крайней мере, зависит не только от нее.
Гликолиз и его субстраты
Гликолиз — это катаболизм глюкозы до двух молекул пировиноградной кислоты. Не слишком понятное определение, но сейчас попытаемся прояснить его.
Катаболизм — это окисление молекулы до более простой/простых с выделением энергии. Наша молекула — глюкоза. А энергия выделяется в виде АТФ и тепла. В химических связях глюкозы запасено много энергии, которая может быть использована организмом. Если мы будем окислять глюкозу до талого, то получим углекислый газ и воду. И кучу энергии! Но это нужно сделать с умом.
Представьте, что мы просто спалим глюкозу в один этап. Так мы получим углекислый газ и воду, да ещё вот такое количество энергии. Это горение молекулы.
В нашем организме такой реакции нет. Это экзотермическая реакция. В ней вся энергия выделяется в виде тепла, а не идёт на синтез полезной батарейки — молекулы АТФ. Если бы так было в организме, то вряд ли наши клетки долго прожили. У них бы быстро случилось профессиональное выгорание.
Организм делает умнее и удобнее. Он постепенно окисляет молекулу глюкозы до углекислого газа и воды — делит окисление на несколько стадий. А стадии делит на реакции. Так молекула глюкозы окисляется до промежуточных продуктов. В ходе этого выделяется энергия, которая запасается в виде АТФ. Часть энергии рассеивается — выделяется тепло. Но это только маленькая часть.
Весь этот процесс называется катаболизмом глюкозы. Он состоит из гликолиза и общего пути катаболизма.
Гликолиз это первая стадия катаболизма. В ходе него выделяется немного энергии в виде АТФ, но что важнее — мы получаем две молекулы пирувата. Пируват та же пировиноградная кислота. Просто в растворе кислота диссоциирует, а название её иона — пируват.
Почему пируват, а не другая молекула?
Наш организм получает энергию из белков, жиров и углеводов. Можно подумать, что для каждого класса молекул существует отдельный способ вытащить из него энергию. Но это не так. Зачем делать печку для каждого вида дров, если можно сделать одну общую для всех? Таким вопросом задались клетки нашего организма и решили, что лучше сделать одну печь. Эта печь — общий путь катаболизма.
Общий путь катаболизма включает превращение пирувата в ацетил-коэнзим А, цикл трикарбоновых кислот и окислительное фосфорилирование. Видите? Он начинается с пирувата. Потому что:
Пируват объединяет катаболизм белков, жиров и углеводов.
Клетки умнее, чем кажутся. Они решили, что можно сделать не только одну печь, но и один вид дров. Они окисляют белки, жиры и углеводы до одной молекулы — ацетил-коэнзим А. И пируват — это его предшественник. Их отделяет всего одна реакция, поэтому если мы посмотрим на все виды обмена, то увидим такое.
В ходе общего пути катаболизма образуется огромное количество молекул АТФ. Куда больше, чем при гликолизе.
Теперь мы поняли, что гликолиз — это первый этап катаболизма глюкозы. В ходе него образуется немного энергии в виде АТФ. Но что важнее — гликолиз готовит дрова для печи. Или пируват для общего пути катаболизма, как тебе больше нравится.
Гликолиз — это первый этап катаболизма глюкозы
У гликолиза есть и другое название — дихотомическое расщепление глюкозы. Это название заключает главный смысл гликолиза: в ходе него происходит деление молекулы глюкозы надвое.
Этапы гликолиза
Гликолиз идёт в цитоплазме всех клеток нашего организма. Прочитай это ещё раз. Он состоит из двух этапов: подготовительного и энергетического. Мне кажется, что подготовительный этап можно разделить на два шага. Так будет удобнее для понимания.
На энергетическом этапе из каждой фосфотриозы образуется пируват. На этом этапе образуются 4 молекулы АТФ и 2 молекулы НАДH.
Кажется, что я вас слишком быстро окунул в тему. Не бойтесь, дальше всё будет понятнее. Если что, то нам даже не придётся зубрить все десять реакций. Да-да, их всего десять. Мы выведем всё логически. Нам нужно знать только формулу молекулы глюкозы и пирувата. С чего начинаем и к чему идём. В глюкозе шесть атомов углерода, а в пирувате всего три. Поэтому сначала нужно превратить глюкозу (гексозу) в триозу. За этим и нужен подготовительный этап.
У большинства ферментов название будет по субстратам. Знаем субстрат и продукт реакции — можем назвать фермент. Если хорошо знаем их классы.
Подготовительный этап гликолиза
В нём пять реакций. В процессе поймёте, почему лучше разделить его на два шага.
Первый шаг подготовительного этапа
Наша задача на этом шаге — получить фруктозо-1,6-фосфат.
Первая реакция. Мы начинаем с глюкозы. Она попадает в клетку с помощью глюкозного транспортёра (ГЛЮТ). Проблема в том, что этот транспортёр работает в обе стороны. ГЛЮТ может загонять глюкозу в клетку, а может выкидывать её. Всё зависит от градиента концентрации между кровью и клеткой. Так не пойдёт!
Ещё нам нужно увеличить реакционную способность глюкозы, потому что ей дальше придётся вступать в реакции. Убьём двух зайцев с помощью фосфорилирования! Для этого нам понадобится фермент — гексокиназа/глюкокиназа и молекула АТФ. Глюкокиназа действует в печени, а гексокиназа в других тканях — это изоферменты. Между ними есть отличия, о которых можно прочитать здесь.
В ходе реакции мы получаем глюкозо-6-фосфат. У него больше реакционная способность, чем у глюкозы. А ещё он не может вылететь из клетки — для него нет переносчика в клеточной мембране. Мы загнали глюкозу в ловушку и сделали её менее стабильной.
Эта реакция необратима, потому что мы затратили энергию макроэргической связи АТФ.
Вторая реакция. Мы превратим глюкозо-6-фосфат в фруктозо-6-фосфат. Зачем? Это пока секрет, но доверьтесь мне — дальше всё станет ясно! Фосфогексоизомераза катализирует эту реакцию.
Реакция идёт в несколько этапов. Сначала фосфогексоизомераза раскрывает циклическую форму глюкозо-6-фосфата — переводит его в линейную. Далее образуется линейная форма фруктозо-6-фосфата. Линейная форма фруктозо-6-фосфата быстро переходит циклическую. Такая форма более стабильна.
Эта реакция обратима
Третья реакция. Из-за того, что прошлая реакция обратима, мы можем опять получить глюкозо-6-фосфат. А он отправится на другие процессы — пентозофосфатный путь, синтез гликогена и всё такое. Нужно закрепить наш успех — отделить молекулу от других процессов. Прицепим ещё одну фосфатную группу к молекуле. Для этого нужна киназа — фосфофруктокиназа — и молекула АТФ. Получаем фруктозо-1,6-бисфосфат.
Этим заканчивается первый шаг подготовительного этапа. В нём произошло несколько важных вещей. Клетка поймала глюкозу в ловушку — теперь она не сможет пройти через биологическую мембрану. С помощью образования фруктозо-1,6-бисфосфата гликолиз отделился от других клеточных процессов. Клетка увеличила реакционную способность глюкозы, превратив её в нестабильный фруктозо-1,6-бисфосфат. На эти важные процессы клетка не поскупилась и потратила две молекулы АТФ.
Как-то даже парадоксально: клетка хочет получить энергию, но при этом тратит её.
Второй шаг подготовительного этапа
Наша задача на этом шаге — получить фосфотриозы.
Четвёртая реакция. Начнём двигаться к образованию пирувата. А в нём все-таки три углеродных атома, а не шесть. Для этого расщепим фруктозо-1,6-бисфосфат с помощью фермента альдолазы. Этот фермент относится к классу лиаз.
Альдолаза раскрывает циклическую форму фруктозо-1,6-бисфосфата. Она действует на середину молекулы — образуется две триозы: дигидроксиацетонфосфат и глицеральдегид-3-фосфат. Если мы знаем формулу фруктозы, то легко можем написать эти продукты. Одна триоза будет кетонной, а другая альдегидной.
В этой реакции кроется причина превращения глюкозо-6-фосфата в фруктозо-6-фосфат. Это тот, который образовался во время второй реакции. Представьте, что мы забили на превращение глюкозо-6-фосфата. И просто отправили его на альдолазную реакцию. Мы бы не получили две триозы. Дело в том, что альдолаза действует через один атом углерода, у которого находится двойная связь.
Все реакции начиная с четвёртой и до десятой будут обратимые. Поэтому я дальше не буду заострять на этом внимание. А может и буду, кто знает)))
Пятая реакция. Хоть мы и получили две триозы, но не каждая может пойти дальше по пути гликолиза. Глицеральдегид-3-фосфат может, а вот дигидроксиацетонфосфат — нет. Нам нужна альдегидная группа для следующих реакций гликолиза. Если внимательно посмотреть на эти молекулы, то можно сказать: «Да они почти одинаковые, может превратим одну в другую?»
Это можно сделать! С помощью фермента триозофосфатизомеразы. Он переводит дигидроксиацетонфосфат в глицеральдегид-3-фосфат. Давайте я переверну молекулу дигидроксиацетонфосфата. Так будет понятнее.
При этой реакции устанавливается константа равновесия. Возьмём за сто процентов количество молекул дигидроксиацетонфосфата (ДГАФ) и глицеральдегид-3-фосфата. 96 % молекул будут в виде ДГАФ, и только 4 % виде глицеральдегид-3-фосфата. Но это не проблема, потому что глицеральдегид-3-фосфат постепенно тратится на реакции гликолиза. Количество его молекул уменьшается. Нужно поддержать константу равновесия, поэтому ДГАФ изомеризуется. Так постепенно ДГАФ превращается в глицеральдегид-3-фосфат.
Смысл второго шага подготовительного этапа — образовать две молекулы глицеральдегид-3-фосфата. Он может превратиться в пируват — нашу конечную цель.
Получается, что в ходе подготовительного этапа клетка затратила две молекулы АТФ, но при этом получила две молекулы глицеральдегид-3-фосфата. На следующем этапе из глицеральдегид-3-фосфата будет образовываться АТФ. Ведь клетка не глупышка. Она не будет тратить энергию просто так.
Энергетический этап гликолиза
Время получать молекулы АТФ из наших глицеральдегид-3-фосфатов. Дальше будут реакции с одним глицеральдегид-3-фосфатом. Но помните о том, что их два. Позже мы всё удвоим, но не стоит выбрасывать это из головы.
Откуда взять энергию для получения АТФ в этой молекуле?
Можно подумать, что фосфатная группа у третьего атома будет участвовать в синтезе АТФ. Но это не так — пока не так. Для того, чтобы синтезировать АТФ из АДФ нужно разрушить ковалентную связь, но необычную. Она должна быть макроэргической.
Макроэргическая связь — это связь, при гидролизе которой выделяется большое количество энергии. Эта энергия используется для присоединения фосфатной группы к молекуле АДФ — мы получаем АТФ. Этот процесс называется субстратное фосфорилирование.
Есть и другое фосфорилирование — окислительное. Там для синтеза АТФ будет использоваться градиент концентрации протонов. Но мы поговорим об этом подробнее, когда доберёмся до дыхательной цепи. Пока что остановимся на субстратном.
Не каждая связь будет макроэргической. Чаще всего эти связи есть в ангидридах фосфорных и карбоновых кислот. Ангидрид состоит из двух кислотных остатков, которые соединены через атом кислорода. Давайте посмотрим на молекулу АТФ — в ней две макроэргических связи.
И это как раз фосфорный ангидрид — в нём соединены три фосфорных остатка. Два из них — это ангидриды. Теперь вы догадались, что мы сделаем с глицеральдегид-3-фосфатом. Превратим его в ангидрид!
Получился смешанный ангидрид фосфорной и карбоновой кислот — 1,3-бисфосфоглицерат. Ура, у нас есть макроэргическая связь.
У этой реакции есть плюсы и минусы. Плюсы:
А о минусе мы поговорим ниже.
Седьмая реакция. Время получить молекулу АТФ. В этом нам поможет фермент — фосфоглицераткиназа. Она катализирует разрыв макроэргической связи в 1,3-бисфосфоглицерате. Энергия разрыва этой связи идёт на присоединение фосфорной группы к АДФ — образованию макроэргической связи. Получаем АТФ и 3-фосфоглицерат. Это и есть субстратное фосфорилирование.
Фермент назван по обратной реакции. Потому что АТФ находится справа. Все киназы получают название в зависимости от того, где находится АТФ. Эта реакция обратима, потому что с двух сторон есть макроэргические связи — нет резкого изменения свободной энергии. Такое изменение было в первой и третьей реакциях, но не здесь.
Восьмая реакция. В 3-фосфоглицерате ещё остаётся фосфатная группа. Она связана с третим атомом углерода с помощью ковалентной связи. Попробуем превратить эту связь в макроэргическую. Для этого придётся перенести фосфатную группу на второй атом углерода. Катализирует реакцию фосфоглицератмутаза.
Реакция протекает в два этапа: вначале фосфоглицератмутаза отдаёт фосфатную группу 3-фосфоглицерату — образуется 2,3-бисфофоглицерат. Потом фосфоглицератмутаза забирает фосфатную группу с третьего атома углерода. В клетке образуется 2-фосфоглицерат. Зачем я про это рассказываю? Потому что вы уже встречались с этой молекулой. 2,3-бисфосфоглицерат снижает сродство гемоглобина к кислороду. Вспомнили? Ну да ладно, сейчас не об этом.
Девятая реакция. У нас не получится превратить 2-фосфоглицерат в ангидрид, но есть другой вариант. Для этого нам понадобится фермент — енолаза. Она занимается отщеплением воды от молекулы с образованием двойной связи по месту разрыва — класс лиазы. Образуется фосфоенолпируват.
Эта реакция увеличивает энергетический потенциал молекулы — в ней появляется енолфосфатная связь. Это макроэргическая связь. Фосфоенолпируват теперь может отдать фосфорную группу молекуле АДФ в следующей реакции.
Десятая реакция. Её катализирует фермент пируваткиназа. Гидролиз макроэргической связи приводит к высвобождению энергии, которая идёт на присоединение фосфорной группы к АДФ. Образуется АТФ и пируват. И снова субстратное фосфорилирование.
Опять фермент назван по обратной реакции. Но есть ли вообще тут обратная реакция? Если есть, то почему я нарисовал стрелочку в одну сторону. Дело в том, что пируват может находиться в енольной или кетонной формах. Это зависит от положения двойной связи.
После отщепления фосфорной группы образуется енольная форма. Но эта форма менее стабильна, чем кетонная. Поэтому быстро происходит таутомерия — переход изомеров друг в друга. Образуется стабильная кето-форма пирувата. За счёт этого реакция становится необратимой!
На этом энергетический этап гликолиза заканчивается. Да и сам гликолиз тоже.
Сделаем выводы
Давайте посмотрим на общую схему гликолиза. Всего три реакции из десяти необратимы: первая, третья и десятая.
Почему они необратимы? В этих трёх реакциях происходит значительное изменение свободной энергии. Если сказать проще, то при первой, третьей и десятой реакции выделяется большое количество энергии. Это экзотермические реакции. Поэтому для того, чтобы повернуть эти реакции в обратную сторону нужно затратить энергию. Это невозможно при физиологических клеточных условиях.
Другие семь реакций обратимы. В них свободная энергия меняется незначительно. Некоторые из этих реакций экзотермические, а некоторые эндотермические. При физиологических условиях в клетке можно легко провести реакции в другую сторону. Достаточно ферментов, которые снизят энергию активации этой реакции.
Это полезно, потому что иногда клетка хочет синтезировать глюкозу из продуктов гликолиза. Всё зависит от условий внутри клетки. Катаболизм глюкозы и её синтез работают по типу выключателя. Когда клетка включает синтез, то отключается распад. И наоборот. Синтез глюкозы из продуктов гликолиза и других молекул — это глюконеогенез. Но я отвлёкся, давайте вернёмся к гликолизу.
На подготовительном этапе мы затратили две молекулы АТФ для активации глюкозы — первая и третья реакция. В конце этапа у нас есть две молекулы глицеральдегид-3-фосфата. Дальше эти две молекулы вступят в энергетический этап.
В энергетическом этапе из каждой молекулы глицеральдегид-3-фосфата мы получили две молекулы АТФ. Первую в седьмой реакции, а вторую в десятой реакции. Обе были получены с помощью субстратного фосфорилирования. Так как молекул глицеральдегид-3-фосфата две, то всего мы получили четыре молекулы АТФ.
Общий выхлоп гликолиза (пока что) = получено на энергетическом этапе (АТФ) — затрачено на подготовительном этапе (АТФ) = 4-2 = 2 молекулы АТФ. Как то не густо….
Но ещё мы получили две молекулы пирувата, которые отправятся в цикл трикарбоновых кислот (ЦТК). А потом и в дыхательную цепь. Для этого две молекулы пирувата переносятся в митохондрию, где находятся ЦТК и дыхательная цепь. Там из пирувата, через серию реакций, образуются молекулы АТФ.
Ах да, есть ещё две важные молекулы, которые были получены в ходе гликолиза. Это 2 НАДH. Они образовались в шестой реакции, и я обещал вам рассказать про её минусы. Время выполнять обещание.
Значение НАДH для гликолиза
Тут нужно поговорить об аэробном и анаэробном гликолизе. Я не стал пихать их в начало статьи для того, чтобы разобраться с ними сейчас.
Аэробный гликолиз
Дыхательная цепь находится в митохондриях. НАДH не может проникнуть через двойную биологическую мембрану. Это можно сделать с помощью челночных механизмов (подробнее здесь). Челночные механизмы окисляют НАДH до НАД + — при этом он остаётся в цитоплазме. А его протон и два электрона переносятся внутрь митохондрии. Ещё для этого используется протон водорода из цитоплазмы, но их там не мало — от цитоплазмы не убудет. После этого НАД + присоединяется к активному центру глицеральдегидфосфатдегидрогеназы.
Челночные механизмы нужны не только для того, чтобы окислить НАДH. После того, как протоны и электроны были перенесены в митохондрию, они попадают в дыхательную цепь. Там из них синтезируется три или пять молекул АТФ. Это зависит от челночного механизма, который был использован клеткой.
Вы можете найти инфу, что в в ходе гликолиза синтезируется восемь молекул АТФ. Потому что каждый НАДH идёт на образование трёх молекул АТФ. Но если говорить строго, то из каждого НАДH может синтезироваться только 2,5 молекулы. Наверное, они округляют или пользуются старыми данными. Так что тут вам решать. Я считаю по 2,5 молекулы, поэтому:
Общий выход аэробного гликолиза: пять или семь молекул АТФ и две молекулы пирувата. Количество АТФ зависит от челночного механизма
Уравнение аэробного гликолиза:
Но что случится, если дыхательная цепь прекратит свою работу?
Анаэробный гликолиз
При анаэробном гликолизе челночные механизмы останавливаются. Это случается при недостатке кислорода (ого!) — дыхательная цепь перестает работать. В митохондрии накапливаются протоны и электроны. Для наших уже просто не хватает места.
Но клетка делает кое-что интересное. Она превращает пируват в лактат с помощью лактатдегидрогеназы. Фермент использует НАДH и протон водорода на эту реакцию. Далее он присоединяет их к пирувату. Та-дам! Клетка получает НАД + и лактат. НАД + снова идёт в шестую реакцию.
Выхлоп энергии здесь намного меньше — всего две молекулы АТФ. Протон и электроны с НАДН не отправляются в митохондрию, а значит мы не получим дополнительные три или пять молекул АТФ. Пируват не отправляется в ЦТК, а превращается в лактат. В общем, невыгодно как-то. Клетка слишком много теряет на этом.
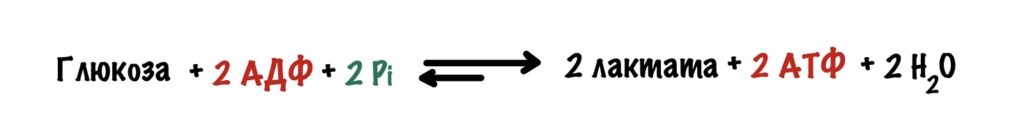
Общий выход анаэробного гликолиза: две молекулы АТФ и две молекулы лактата
Уравнение анаэробного гликолиза:
Зачем тогда нужен анаэробный гликолиз? Некоторые клетки не могут получать энергию по-другому. Вот у эритроцитов просто нет митохондрий, поэтому единственный вариант получить энергию — анаэробный гликолиз.
Ещё он протекает в мышцах при резкой физической нагрузке. Представьте, что мы побежали за автобусом. У нас небольшой запас кислорода в мышцах — в виде миоглобина. Он сгорит очень быстро, а мышцам нужна энергия. Запускается анаэробный гликолиз с образованием лактата. Потом к мышцам увеличивается кровоток — переход на аэробный гликолиз.
С мышцами бывает и другая ситуация. Они частенько сокращаются, а это иногда приводит к сдавлению сосудов. Кровоток снижается, а энергию на сокращения где-то брать нужно. Снова включается анаэробный гликолиз. Так что анаэробный гликолиз незаменимая штука для эритроцитов и мышц.
Опухоли тоже пользуются гликолизом, но это не хорошая инфа. А так анаэробный гликолиз больше характерен для бактерий: клостридий и других облигатных анаэробов.
Но вернёмся к нашему организму. В мышцах лактат не лежит просто так, а отправляется в кровь. Там он циркулирует, пока не попадёт в печень или почки. Зачем? Эти органы могут превратить лактат в глюкозу с помощью глюконеогенеза. В них идёт обратная реакция, которую катализирует лактатдегидрогеназа — образование пирувата из лактата. Далее пируват вступает в глюконеогенез — через серию реакций образуется глюкоза. Печень/почки отправляют её в кровь. Дальше глюкоза попадёт в другие клетки, где будет использована на их нужды. Часть глюкозы снова окажется в мышцах, где из неё опять образуется лактат. Цикличненько. У этого цикла есть своё название — цикл Кори.
Другие субстраты гликолиза
Только что мы разобрали гликолиз на примере глюкозы. Она попадает в клетку из крови, а потом фосфорилируется. И так далее. Но откуда она там взялась? Есть два варианта:
Мы сытно поели, и в ЖКТ началось пищеварение. Большая часть полисахаридов и дисахаридов состоит из глюкозы. Глюкоза попадёт из кишечника в кровь, а потом в клетку. Там глюкоза будет использоваться для синтеза АТФ — гликолиза, либо запасаться в виде гликогена. Она может использоваться и для других процессов, но пока не будем запариваться.
Второй вариант — образование глюкозы из гликогена.
Гликоген
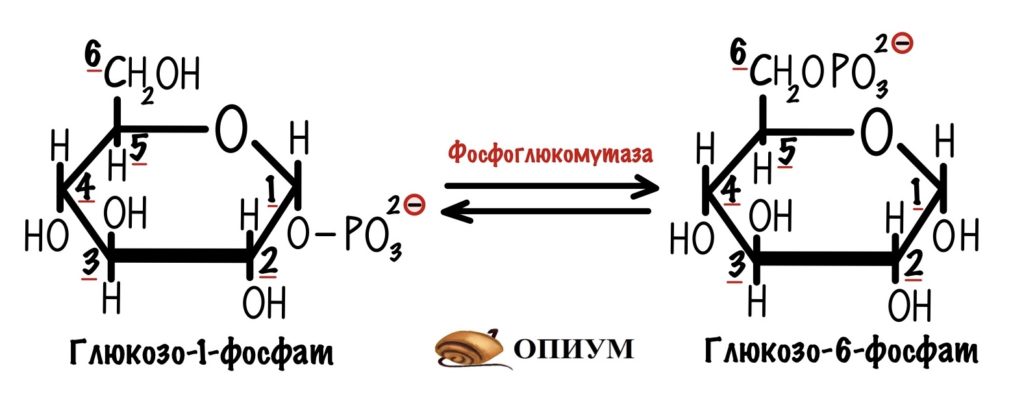
В мышцах и печени можно получить молекулу глюкозо-6-фосфата, продукт первой реакции, по-другому. Через разрушение гликогена — гликогенолиз. Под действием гликогенфосфорилазы от гликогена отщепляется молекула глюкозы. Эта реакция идёт с помощью фосфоролизиса — альфа-1-4-гликозидная связь разрушается с участием неорганического фосфата. Клетка получает глюкозо-1-фосфат и гликоген, в котором меньше на одну молекулу глюкозы.
Далее глюкозо-1-фосфат превращается в глюкозо-6-фосфат с помощью фермента фосфоглюкомутазы. А вот и наш глюкозо-6-фосфат, который можно запихнуть в гликолиз.
Но такая тема работает только в мышечной ткани — глюкозо-6-фосфат идёт на гликолиз. В печени глюкозо-6-фосфат превратится в глюкозу с помощью глюкозо-6-фосфатазы. Из клеток печени она пойдёт в кровь. Так происходит между приёмами пищи, когда падает уровень глюкозы в крови. Печень заботится об уровне глюкозы в крови между приёмами пищи, поэтому она не использует глюкозу самостоятельно. Но давайте вернёмся к пищеварению.
При пищеварении мы получали не только глюкозу, но и другие моносахариды: фруктозу и галактозу. Можно ли их отправить в гликолиз? А давайте посмотрим.
Фруктоза
Фруктоза образуется при гидролизе сахарозы во время пищеварения. Сахароза — это дисахарид, который состоит из глюкозы и фруктозы. В начале пути глюкозы и фруктозы схожи. Фруктоза тоже всасывается в кишечнике, а потом попадает в кровь. Оттуда фруктоза захватывается клетками. А дальше начинаются отличия. Фруктоза может вступать в гликолиз двумя разными путями.
Первый путь. Фруктоза фосфорилируется с помощью гексокиназы. Фосфорная группа присоединяется к шестому атому углерода. При этом затрачивается молекула АТФ.
Удобно, клетка получила продукт второй реакции гликолиза. Даже не нужно проводить изомеризацию. Можно сразу фосфорилировать фруктозо-6-фосфат фосфофруктокиназой.
Второй путь. Фруктоза фосфорилируется с помощью фруктокиназы. Фосфорилирование идёт по первому атому углерода, а не шестому. Уже можно не писать, что на это тратится молекула АТФ?
Дальше клетка превращает фруктоза-6-фосфат в две триозы. Очень похоже на четвертую реакцию гликолиза, но только одна будет фосфотриозой. Фермент тоже называется альдолазой, но с приставкой — фруктозо-1-фосфатальдолаза.
Дигидроксиацетонфосфат может пойти на гликолиз через изомерию. Триозофосфатизомераза превращает его в глицеральдегид-3-фосфат. Далее он вступает в гликолиз.
Глицеральдегид в гликолиз не отправить. Сначала нужно прицепить к нему фосфатную группу. Катализирует реакцию — триозокиназа. Получаем ещё один глицеральдегид-3-фосфат.
Оба глицеральдегид-3-фосфата попадают на энергетический этап гликолиза. Очень похоже на классический гликолиз. Просто он идёт немного в обход. При этом оба пути одинаковы в энергетическом плане — клетка тратит на них две молекулы АТФ.
Галактоза
Галактоза образуется при гидролизе лактозы. Лактоза — это дисахарид, который состоит из галактозы и глюкозы. Галактоза всасывается из кишечника, а потом попадает в клетку. Ну и куда же без фосфорилирования. Ведь нужно загнать галактозу в ловушку и увеличить её реакционную способность. Фермент галактозокиназа фософрилирует первый атом углерода.
Дальше идёт вот такой интересный цикл:
В итоге мы получаем глюкозо-1-фосфат, который можно превратить в глюкозо-6-фосфат с помощью фосфоглюкомутазы. Где мы уже встречались с УДФ-глюкозой? Да, в синтезе гликогена.
Вот общая табличка со всеми субстратами гликолиза.
Регуляцию гликолиза и глюконеогенеза разбираем здесь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.