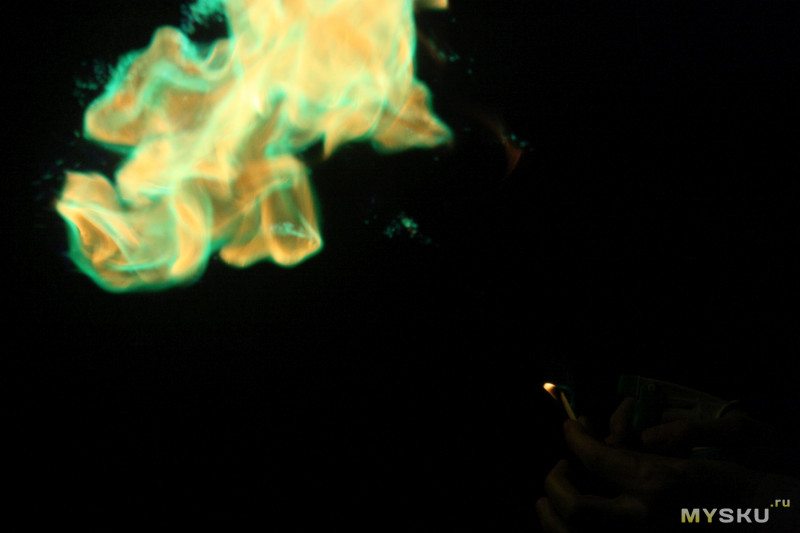что горит зеленым огнем
 masterok
masterok
Мастерок.жж.рф
Хочу все знать
Создатели фантастических миров питают особую страсть к зеленому пламени. В мире Warcraft есть зеленая плазма скверна (Fel), а в «Игре Престолов» — Дикий огонь, с помощью которого плавят крепости и сжигают корабли. Достичь похожих визуальных эффектов можно и в нашем земном мире, не прибегая к компьютерной обработке видео.
Для того, чтобы к небу поднялись языки нездешнего зеленого пламени, достаточно поджечь триметилборат — триметиловый эфир борной кислоты (CH3O)3B. Его можно купить, а можно получить из метилового спирта и борной кислоты в присутствии концентрированной серной кислоты — если у вас есть простейшее оборудование. Имея дело с эфирами, особенно важно иметь вытяжной шкаф — если у вас его нет, возможно, не стоит и браться за эксперимент. Не забудьте также о рукавицах и защитных очках.
Триметилборат, конечно, не Дикий огонь: температура пламени чистого вещества — 40 градусов Цельсия; при этой температуре вы стираете джинсы. Однако и в покупном эфире, и тем более в полученном самостоятельно содержится некоторый процент метилового спирта, а он горит бесцветным пламенем уже при 87 градусах. Поэтому протягивать руки в зеленые всполохи не стоит: можно обжечься пламенем метанола.
Posts from This Journal by “Химия” Tag
Кто знает, что это? Люминол был синтезирован в Германии в 1902 году, но своё настоящее название получил позднее. Он представляет собой кристаллы…
Кто из динозавров интернета помнит мем «сам топи урановые ломы в ртути»? А мне вот попалась на глаза вот такая гифка. Согласитесь,…
В кислороде.
Светяща яся надпись
По одной из библейских легенд, на стене дворца вавилонского царя Валтасара во время пира вдруг возникли светящиеся письмена.
Химики доказали, что такое чудо возможно: на черной стене может вспыхнуть, а потом погаснуть надпись или рисунок. Для этого надо приготовить специальные фосфорные «карандаши». В пробирку вносят 1 г белого фосфора Р4 (осторожно, он ядовит и огнеопасен!) в виде нескольких горошин и добавляют 2 г стеарина или парафина. Закрывают пробирку тампоном из стекловаты и нагревают на водяной бане, периодически взбалтывая. После расплавления содержимого пробирки ее охлаждают в холодной воде. Когда смесь затвердеет, пробирку разбивают и извлекают застывший стержень (это надо делать, предварительно надев резиновые перчатки). Хранить его можно только под слоем воды, в закрытой склянке. Если таким «карандашом» сделать надпись на куске картона, то в темноте она будет светиться, а потом постепенно исчезнет.
Стеарин защищает белый фосфор от быстрого окисления кислородом воздуха и тем самым увеличивает продолжительность свечения. А само свечение вызвано реакцией медленного окисления фосфора:
с образованием в конечном счете оксида фосфора( V ) Р4010, вступающего во взаимодействие с влагой воздуха. При этом получаются мельчайшие капельки ортофосфорной кислоты Н3Р04, образующие легкий белый дымок.
И вдруг вс пыхнула свеча!
За 2000 лет до н. э. жрецы Древнего Египта во время богослужений вызывали внезапное возгорание огней в храмах и этим повергали молящихся в ужас. Простые люди полагали, что с огнем в храм входит сам верховный бог Аммон — создатель сущего, творец плодородия.
Внезапное возгорание свечи легко может показать учитель химии или руководитель химического кружка. Этот опыт состоит из двух операций. Вначале в склянке с пришлифованной пробкой готовят раствор белого фосфора Р4 (3 — 4 кусочка, каждый размером с горошину) в 10— 15 мл сероуглерода (дисульфида углерода) CS 2. Затем фитиль свечи «разлохмачивают» на отдельные ниточки и пропитывают их полученным раствором из капельницы так, чтобы он не потек по самой свечке. После этого наступает время ожидания. Дисульфид углерода быстро испаряется, оставляя на фитиле свечи мельчайшие частички белого фосфора. Фосфор окисляется на воздухе с выделением значительного количества теплоты, а это через некоторое время (обычно 15—10 минут) вызывает «внезапное» воспламенение свечи.
Свеча и вол шебная палочка
Зажечь свечу без спичек можно вполне безобидным способом, но то же под контролем преподавателя или руководителя химического кружка. Для этого потребуется сначала имитировать настоящую свечу — тонкую стеклянную пробирку облить снаружи расплавленным парафином или стеарином (можно даже просто накапать парафин с горящей свечи, держа ее наклонно). В пробирку наливают на 1/2 ее объема этанол С2Н5ОН (этиловый спирт) и надевают на нее металлический колпачок с отверстием, через которое пропущен фитиль из 5 — 10 ниток бумажной пряжи. Колпачок тоже надо облить расплавленным парафином.
Цветное пла мя свечи
Пламя свечи можно сделать зеленым, красным, синим, если поступить следующим образом. Надо расплавить обычную свечу в металлической миске, вынуть из расплава фитиль, а в расплав внести немного (1/2 чайной ложки на одну свечу) соли, вызывающей окраску пламени.
Спир товые огни
Если соль, способную окрашивать пламя, внести в горящий этиловый спирт С2 H 5ОН, то пламя станет цветным. Для этого поступают следующим образом. В три небольшие чашки кладут тампоны из волокнистых веществ — пакли, ваты или асбеста, пропитанные концентрированными водными растворами солей, окрашивающих пламя, а затем отжатые и высушенные. После этого тампоны обливают этиловый спиртом в таком количестве, чтобы часть его осталась в чашке, и поджигают. Если такие чашки расставить в разных местах комнаты, то можно получить «гирлянду» зеленых, красных, желтых, малиновых и синих огней без дыма и запаха. «Букет» из цветных огней получают, располагая чашки с горящим спиртом друг около друга на разной высоте. По мере выгорания следует добавлять в чашки спирт, пользуясь длинной пипеткой емкостью 15—25 мл и погружая ее конец под тампон в жидкость.
Вместо солей, перечисленных ранее, можно использовать нитраты лития, стронция, меди и натрия. Однако эффект будет гораздо слабее из-за того, что эти соли менее летучи.
Вода вместо спичек, или Пер оксид-воспламенитель
Цветное пламя можно получить и совсем другим способом. Особенно интересно, что в роли «спичек», поджигающих горючую смесь, будет. вода!
Для этого опыта потребуются три фарфоровые тарелки, в которые мы поместим соответственно:
· смесь равных объемов (например, по 1 чайной ложке) сухого пероксида натрия Na 2 O 2 и алюминиевой пудры, смешанной со щепоткой соли, окрашивающей пламя;
· c месь, состоящую из двух объемов (две чайные ложки) сухого пероксида натрия и одного объема (одна чайная ложка) сухих древесных опилок;
· втрое сложенный листок фильтровальной бумаги, на которую насыпают немного (1 чайную ложку) сухого пероксида натрия Na 2 O 2.
Во вторую и третью тарелки (с опилками и с бумагой) тоже добавляют понемногу соли, вызывающей окраску пламени. После этого, поставив тарелки подальше друг от друга, приливают на смеси по 3 — 4 капли воды из длинной пипетки. В первой тарелке смесь сгорает ослепительным цветным пламенем и со вспышкой. В остальных тарелках загораются и горят опилки и бумага, а пламя хотя и спокойное, но тоже цветное.
Механизм воспламенения смесей таков: вода разлагает пероксид натрия Na 202 до гидроксида натрия NaOH и кислорода O 2:
с таким большим выделением теплоты, что от этого загорается не только алюминиевая пудра, но также целлюлоза бумаги и древесины.
При сгорании алюминия образуются оксид алюминия и оксид натрия, которые взаимодействуют между собой с образованием алюмината натрия:
Горящая ки слота
Химическая реакция горения кислоты не отличается особой сложностью: ее продукты — гидроксид натрия NaOH и монооксид углерода СО:
2 Na 2 O 2 + CH 3 COOH = 4 NaOH + 2СО ↑
Пероксид натрия впервые получил французский химик Жозеф Гей-Люссак в 1811 г. Он же наблюдал вспышки концентрированной уксусной кислоты при контакте с Na 2 O 2.
Огненный до ждь. взаперти
На дно большой бутыли (емкостью 3 — 5 л) насыпают слой сухого речного песка толщиной 2—3 см и затем наполняют ее хлором. Хлор, как известно, можно получить действием концентрированной соляной кислоты на диоксид марганца или перманганат калия. Для этого в круглодонную колбу насыпают на 1/4 ее объема Мп02 или КМ nO 4 и вставляют резиновую пробку с капельной воронкой и отводной стеклянной трубкой. Колбу закрепляют в штативе и помещают в вытяжной шкаф. Затем наливают в капельную воронку соляную кислоту и начинают по каплям добавлять ее в круглодонную колбу. Начинается реакция:
М nO 2 + 4НС l = М n С l 2
(или 2 KMnO 4 + 16НС1 = 2КС1 + 2М n С l 2 + 5 C 12 ↑ + 8 H 2 O )
Длинную газоотводную трубку погружают в большую бутыль до самого ее дна. Хлор тяжелее воздуха и будет постепенно вытеснять его. Чтобы узнать, наполнена ли бутыль хлором, подносят к ее горловине фильтровальную бумажку, смоченную водным раствором иодида калия. В результате реакции:
выделяется иод I 2 и бумажка чернеет. Бутыль, наполненную хлором, закрывают пробкой. Выполнив эти операции, растирают в фарфоровой ступке сурьму Sb до порошкообразного состояния и наполняют этим порошком небольшую пробирку на 1/4 ее объема. Вынув пробку, осторожно постукивая по пробирке пальцем, небольшими порциями высыпают порошок сурьмы в бутыль с хлором. Сурьма тотчас же воспламеняется и сгорает, образуя «огненный дождь» и разбрасывая во все стороны искры. Склянка наполняется белым дымом продуктов взаимодействия сурьмы и хлора:
Железо гори т!
Для получения самовоспламеняющихся («пирофорных») порошков Железа применяется термическое разложение соли щавелевой кислоты Н2С2 O 4 — оксалата железа(П) FeC 2 O 4∙2Н2О. Эту соль надо заранее получить, сливая растворы сульфата железа(П) FeSO 4 и оксалата аммония ( NH 4)2 C 2 O 4. Выпадает лимонно-желтый осадок:
Осадок отфильтровывают и высушивают между листами фильтровальной бумаги. Сухой порошок FeC 2 O 4∙2Н20 засыпают в пробирку на 1/4 ее объема и прокаливают, держа ее в пламени газовой горелки с небольшим наклоном в сторону отверстия. Прокаливание ведут при умеренной температуре (150—200 °С). Разложение FeC 2 O 4∙2 H 2 O отвечает уравнению:
Капли воды снимают со стенок пробирки трубочкой, свернутой ид фильтровальной бумаги. Как только лимонно-желтый порошок почернеет, нагревание прекращают, а пробирку закрывают пробкой, Еще теплое содержимое пробирки высыпают порциями в трубку высотой 1 м в шириной 3—4 см, установленную на асбестовом или металлическом листе. Черный порошок железа, высыпаясь из пробирки, самовоспламеняется и сгорает, образуя красивый сноп искр:
3 F е + 2 O 2 = ( Fe II Fe 2 III ) O 4
И с помощью лимонной кислоты.
Пирофорный порошок железа получается и из цитрата железа. Чтобы получить цитрат железа( II ) Fe 3( C6H 3 O 7)2, в водный раствор лимонной кислоты Н3<С6Н5О7) вносят небольшими порциями мелкие железные опилки, а смесь нагревают. При этом железо химически растворяется, выделяя водород:
Раствор цитрата железа( II ) упаривают до начала кристаллизации соли, охлаждают, затем отфильтровывают и сушат выпавшие кристаллы. Реакция термического разложения Fe 3( C 6 H 5 O 7)2∙Н2О сопровождается выделением монооксида углерода СО и углерода:
Пламя — и с ноп искр
Горящи й снег
Возьмите жестяную консервную банку, наполните ее на 3/4 объема снегом и положите в середину 3—4 гранулы карбида кальция. Сверху засыпьте гранулы СаС2 снегом и поднесите к банке горящую спичку. Снег вспыхивает и горит коптящим пламенем.
Суть этого опыта в том, что при реакции СаС2 с водой (взятой в виде снега) выделяется ацетилен. Именно ацетилен горит коптящим пламенем, создавая иллюзию горения снега.
Зеленое пламя
В фарфоровой чашке смешайте 10 мл этилового спирта С2Н5ОН, 10 мл концентрированной серной кислоты и 2 г буры Na 2 B 4 O 7∙10Н2О. Теперь подожгите смесь. Она будет гореть красивым зеленым пламенем.
который горит, образуя пламя зеленого цвета
Факе л из эфира
Очень эффектный опыт – горение борно-этилового эфира на выходе простой установки, состоящей из конической колбы, пробки и газоотводной трубки. Для опыта следует подготовить 5—10 г борной кислоты — гидроксида бора В(ОН)3, 50 мл этилового спирта С2Н5ОН и 50 мл концентрированной серной кислоты H 2 SO 4. Смешивают в колбе гидроксид бора со спиртом, вносят туда же серную кислоту, закрывают пробкой с трубкой и ставят нагревать на электрическую плитку. Как только в жидкости начнут появляться пузырьки газа, содержимое колбы перемешивают, вращая ее, и после этого подносят горящую лучинку к выходному отверстию газоотводной трубки. Появляется зеленое пламя, которое лучше всего наблюдать, выключив свет в помещении.
Фейерверк на д тиглем
Смешайте на сухой бумаге одинаковые объемы (не больше чем по одной ложечке) порошков перманганата калия, древесного угля и порошка железа. Смесь насыпьте в пробирку из тугоплавкого стекла или железный тигель, поместите в кольцо или в лапку штатива (пробирку — выходным отверстием вверх) и нагревайте пламенем спиртовки или газовой горелки.
Вскоре из смеси начинает вылетать поток ярко светящихся частиц! настоящий «звездный дождь». Уголь и железо окисляются кислородом, выделяющимся при термическом разложении перманганата калия.
Огни в жидк ости
В небольшой стеклянный цилиндр на высоту 10—12 см налейте концентрированную серную кислоту. Сверху осторожно налейте этиловый спирт С2Н5ОН, наполнив цилиндр почти до верха. Затем в цилиндр всыпьте предварительно измельченные кристаллы перманганата калия.
Падающие крупинки КМ n О4 достигают границы, разделяющей спирт и серную кислоту, и вызывают вспышки огней, так что в течение нескольких минут можно наблюдать в жидкости настоящий фейерверк!
Огни в жидкости возникают, когда этанол мгновенно воспламеняется при контакте с оксидом марганца( VII ), который образуется при реакции КМ nO 4 и H 2 SO 4.
Небе сный огонь
Химик-«факир» может одним движением руки зажечь костер без спичек. Конечно, подобного рода спектакль должен быть тщательно подготовлен.
На железный лист или на кирпичи кладут несколько кристаллов перманганата калия и смачивают их концентрированной серной кислотой. Вокруг раскладывают древесные щепки, устраивая «костер». Важно, чтобы щепки не касались кристаллов КМп O 4. «Факир» смачивает этиловым спиртом небольшой клочок ваты и незаметно зажимает его между пальцами. В момент, когда нужно зажечь «костер», вполне достаточно выдавить капли спирта из ватного тампона — так, чтобы они попали на смесь перманганата калия с серной кислотой, где в соответствии с уравнением реакции, приведенным ранее, образуется оксид марганца( VII ) — сильнейший окислитель, поджигающий этанол.
«Костер» мгновенно загорается. Надо иметь в виду, что «факир» должен сразу же убрать руку с ватным тампоном, иначе тампон тоже может загореться.
Натри й-колдун
В кучку деревянных палочек, которая будет изображать костер, за пять минут до демонстрации опыта помещают гранулу натрия размером с горошину, а затем поливают ее водой, но не очень обильно (чтобы палочки не намокли и могли гореть). Этого будет достаточно, чтобы прошла реакция с выделением водорода и образованием большого количества теплоты:
Все это приводит к возгоранию «костра».
Хромова я зажигалка
Чтобы зажечь костер без спичек, можно использовать красные кристаллы оксида хрома( VI ) CrO 3. Надо только очень тщательно просушить это вещество. Чтобы «костер» загорелся, нужно полить Сг O 3 небольшим количеством этилового спирта. При соприкосновении с сильным окислителем спирт вспыхивает, а пламя мгновенно охватывает костер:
Волш ебное пламя
Сожгите немного (10—15 мл) этилового спирта в фарфоровой чашке. Обратите внимание: спирт горит почти бесцветным пламенем. Когда горение закончится, в ту же чашку налейте еще 10 мл спирта и 1 мл насыщенного раствора гидроксида бора В(ОН)3. Подожгите смесь, и вы тут же обнаружите: пламя стало ярко-зеленым! Зеленое пламя, получаемое при горении борно-этилового эфира, — отличная качественная реакция на присутствие соединений бора в пробе сжигаемого вещества.
Проб ирка-факел
Налейте в пробирку 1 мл концентрированной уксусной кислоты. Пробирку надо закрыть пробкой с газоотводной трубкой и закрепить в лапке штатива в наклонном положении, а потом осторожно нагреть. После того как уксусная кислота закипит и пары ее начнут выходить из отверстия пробирки, подожгите их лучинкой. Появятся длинные языки слабо светящего пламени, похожие на огненный веер.
Горение уксусной кислоты отвечает уравнению реакции:
С прекращением образования паров уксусной кислоты горение заканчивается и огонь гаснет.
Самово згорание?
На железном листе или в фарфоровой чашке смешайте гранулы пероксида натрия с мелко разорванной фильтровальной бумагой. На приготовленную смесь нанесите несколько капель воды. Бумага тотчас воспламенится. Если «фокусник» сумеет внести в смесь воду незаметно для зрителей, произнося при этом таинственные «заклинания», то опыт произведет замечательное впечатление.
Возгорание смеси пероксида натрия с целлюлозой (фильтровальная бумага) вызвано выделением большого количества теплоты при реакции Na 2 O 2 с водой и получением атомного кислорода:
В ки слороде.
Если гранулу фосфора или немного магниевой стружки сжигать в кислороде, то можно наблюдать ярчайшее пламя. Получить кислород можно весьма простым образом.
Приготовьте большую стеклянную банку, химический стакан или широкий цилиндр и на дно этого сосуда насыпьте слой сухого речного песка высотой 1 см. Затем поставьте на песок чашку с концентрированным раствором пероксида водорода и внесите в нее порошкообразный диоксид марганца. Тотчас начнется выделение кислорода, который заполнит весь приготовленный вами сосуд (кислород немного тяжелее воздуха). Теперь можно поджечь красный фосфор или магниевую стружку в ложечке для сжигания и внести ее в сосуд с кислородом.
«Волшебный» порошок для создания разноцветного огня
Лирическо-познавательное вступление.
Нетерпеливые могут листать до первой фотографии товара.
Как часто бывает, то, что мы сейчас используем для развлечения, когда то было результатом великого научного открытия. Я не нашел информации, как давно люди использую разные вещества для окрашивания огня. Но научно этот эффект исследовал и систематизировал результаты в 1858 году немецкий химик Роберт Бунзен. Результатом его опытов стало открытие спектрографии, благодаря которой были обнаружены неизвестные до этого химические элементы, а сегодня ученые имеют возможность определять химический состав космических объектов на расстоянии многих тысяч световых лет от нас. Как все начиналось, отлично описал еще в 30-е годы прошлого века талантливый физик и популяризатор науки Матвей Бронштейн в своем сборнике научно-популярных рассказов «Солнечное вещество».
Я же узнал о способности разных веществ окрашивать огонь лет в 10, перебирая у бабушки на чердаке отцовские номера Юного техника 60-70-х годов. В номере 6 за 1966 год была такая заметка:
Как на ребенка постчернобыльской эпохи предложение поискать соединения стронция в школьной лаборатории произвело на меня впечатление, как 1,21 джигаватта на Дока Брауна — уран в каждой аптеке и все вот это вот.
Кстати, то, что природный стронций неопасен, мне объяснили только недавно здесь на муське. Но это уже совсем лирика.
Так что же нам предлагают китайские друзья?
Пакетики разного веса с порошком внутри. Пакеты рекомендуется целиком бросать в костер. Состав указан на обороте: медный купорос, хлорид меди, поливинилхлорид. Также есть предупреждение, что нельзя готовить еду над цветным огнем.
Я заказал сначала один большой пакет на 25 грамм, потом подумал и купил еще два по 10. В итоге меньшие пакеты сжег в костре, а больший вскрыл и оставил для эксперИментов.
Порошок представляет из себя смесь трех видов кристаллов. Больше всего синих — медного купороса. Крупным планом выглядит, как мет:)
Во время следующей поездки в село захватил пакетики с собой и вечером разложил небольшой костер. Разгорался порошок довольно долго, минуты три. Я сначала бросил в костер один пакет, за время, пока он разгорался, успел испугаться отсутствия эффекта и бросил второй. Когда порошок выходит в «штатный режим» горения, выглядит это очень красиво. Больше всего в огне зеленого цвета, синего и красного меньше (что логично, поскольку в порошке больше всего медного купороса). Цвета могут смешиваться, в огне появляются лиловые, салатовые отблески. Короче, зачем пытаться подыскать слова, если можно показать.



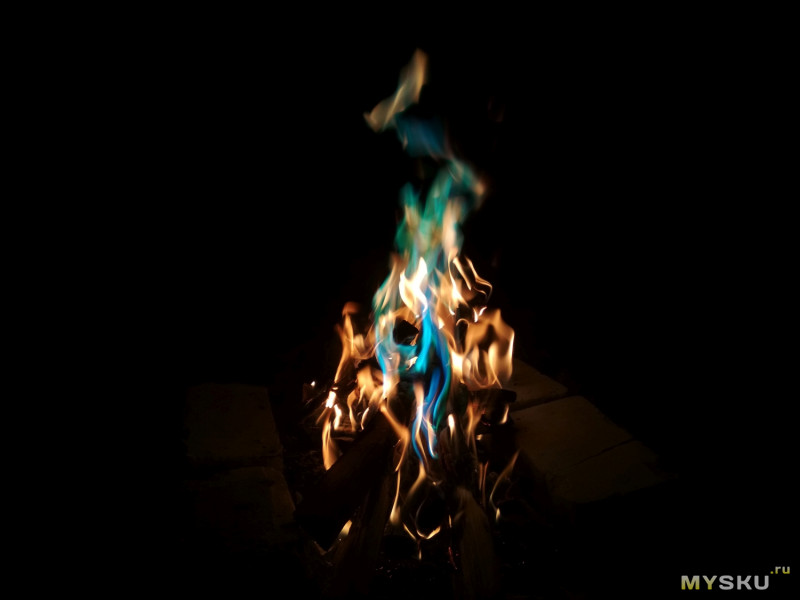


Вот, как все это выглядит в динамике. В телефоне камера не очень, в живую, конечно, смотрится значительно лучше. Первое видео неинтересное — оно скорее для демонстрации, сколько времени порошок разгорается. На втором горение уже идет в полную силу.
В общей сложности активная фаза горения длилась около 15 минут.
Однозначно, супер, вау-эффект и куча восторга. Нашел лот с десятком пакетов, буду летом радовать дочку и племянников.
С порошком из распотрошенного пакета решил повторить рецепт из «Юного техника» — растворил порошок в воде, вымочил в нем несколько листиков бумаги и дал высохнуть. Результат не впечатлил — бумага горит ровным синим пламенем без других оттенков. Выглядит симпатично, но не больше.


Также попробовал растворить порошок в спирте. Получилась веселого цвета жидкость с осадком из не растворившихся компонентов.
Сначала попробовал поджечь раствор просто в металлической крышке — получил сине-зеленое пламя, напоминающее северное сияние.



А потом попробовал повторить фокус из первого эпизода «Во все тяжкие».
Этот эксперимент понравился, пламя выглядит очень круто.




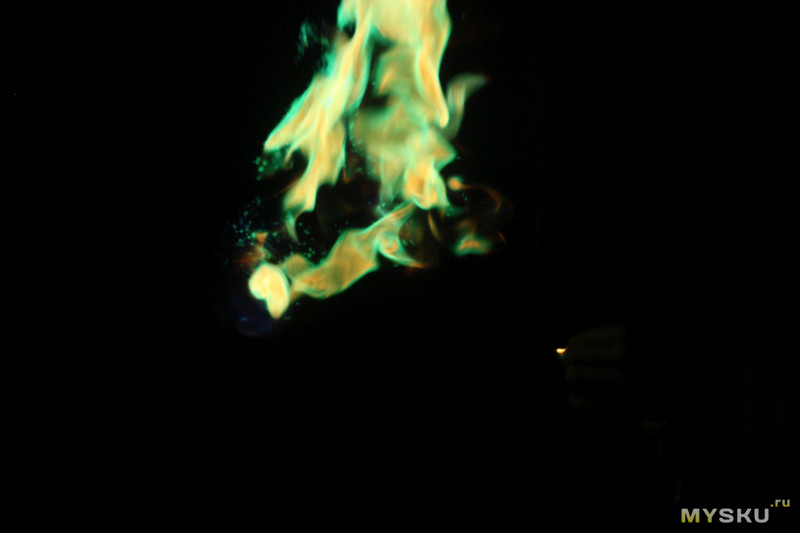
Что сказать в заключение — штука классная, при использовании по назначению выглядит очень красиво, также позволяет проявить фантазию и немного подурачиться.
 masterok
masterok