что делать если ты хромаешь
Хромота причины, способы диагностики и лечения
Хромота — измененная походка человека в результате прогрессирования заболевания нижних конечностей. Страдающий от синдрома старается быстрее перенести вес на здоровую ногу. При поражении обеих нижних конечностей заметно раскачивание и неуверенность походки. У многих синдром ассоциируется с пожилыми людьми, объясняется это ослаблением опорно-двигательного аппарата и хроническими болезнями суставных тканей. Однако перемежающаяся хромота может возникнуть у человека любой возрастной категории. Данный синдром — следствие развития опасных болезней, которые требуют диагностики и лечения.
Причины хромоты
Синдром развивается при заболевании ног. Однако нарушения функционирования нижних конечностей могут быть вторичным поражением. Выделяют следующие возможные причины.
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 24 Декабря 2021 года
Содержание статьи
Типы хромоты
Альтернативное название — синдром Шарко. Отличается развитием дискомфорта и боли в ногах во время ходьбы на небольшие расстояния. Болезненные ощущения исчезают после небольшого отдыха, однако быстро возвращаются при ходьбе. В зависимости от причины развития выделяют несколько видов:
Каудогенная хромота
Развивается в результате сужения канала спинного мозга в области поясницы. Синдром может быть как с рождения, так и развиться при остеохондрозе. Нарушается передача импульсов к ногам, взаимодействие с центральной нервной системой. При ходьбе характеризуется ощущением мурашек по поверхности тела.
Васкулярная хромота
Развивается при атеросклерозе. Сужение просвета артериального канала провоцирует нарушения в системе кровообмена, возникает нехватка кислорода в мышцах, развивается ишемия.
Основное различие с каудогенной формой — во время ходьбы развиваются сильные боли.
Методы диагностики
Синдром диагностируется на основании тестирования, какое расстояние способен преодолеть человек без болезненных ощущений. При подтверждении хромоты определяют причину возникновения. Назначается ультразвуковое исследование сосудов ног, допплерография. Используется ангиография, в сосудистые каналы вводится контрастное вещество. При необходимости применяется компьютерная томография и МРТ. Специалисты клиник ЦМРТ проводят комплексное обследование, которое подразумевает выполнение следующих процедур:
Почему появляется боль в коленном суставе?
Боль в коленном суставе мы чаще всего списываем на травмы: случайные растяжения, вывихи, неловкие движения. Но причина не всегда так очевидна. В новой статье мы решили разобраться, из-за чего еще может появится боль в колене.
При дискомфорте в колене мы редко задумываемся о повреждении суставов. После сорока и вовсе кажется, что беспокоиться не о чем: в этом возрасте суставы неизбежно будут болеть. На самом деле очень важно вовремя узнать, почему появляется боль в коленном суставе: это может быть сигнал травмы, заболевания или даже проблем с нервной системой.
Что может быть повреждено в колене?
Колено — один из самых крупных суставов в человеческом теле. Оно состоит из:
Все эти части могут быть повреждены, хоть и не все могут болеть: в костях нет нервных окончаний.
Болью в колено могут отдавать повреждения бедренной и берцовой костей, а также близлежащих мышц.
Части повреждений, например, вывих сустава, повреждение или разрыв мениска, снизят подвижность. Повреждения даже мелких сосудов вызовут гематому и воспаления, которые будут причинять дискомфорт при попытке пошевелить ногой. Суставная сумка — отличная среда для заражения: после вирусных и бактериальных инфекций пациенты часто жалуются на осложнения и боли в суставах. А при заболевании нервов пациент будет ощущать острую простреливающую боль в колене даже при полностью здоровом суставе.
Боль в колене из-за травм
Травмы — одна из самых распространённых причин болей. Колени можно повредить при неудачном падении, занятии спортом, резком движении, даже неудобная обувь может спровоцировать осложнения.
Такие повреждения может диагностировать хирург или травматолог. Часто достаточно визуального осмотра, но вас могут отправить на рентген (при подозрении на перелом или вывих) или томографию, если врач заподозрил повреждение связок или мениска.
Какие заболевания суставов могут вызвать боль?
Любое поражение сустава, будь это разрушение хряща, инфекция в суставной сумке или воспаление костей, будут вызывать ноющую боль и снижение подвижности. Не всегда болезнь локализована именно в колене: общие заболевания суставов будут поражать всё тело. Колени же при этом будут разрушаться быстрее из-за высокой нагрузки.
Для диагностики этих заболеваний проводят рентген, магнитно-резонансную или компьютерную томографию, на которых видно все части поражённого сустава. При подозрениях на воспаление врач посоветует сдать общий и биохимический анализ крови, возьмёт пункцию синовиальной жидкости. Для исключения инфекционных болезней вас могут направить на дополнительные анализы и флюорографию.
Боль в коленном суставе из-за повреждения нервов
Намного реже боль в коленях появляется из-за нарушения нервной ткани. Оно сопровождается резкими простреливающими болями, может начаться онемение и покалывание в ноге.
Для диагностики нервных заболеваний применяют МРТ или КТ, в зависимости от противопоказаний пациента. Если боль вызвана защемлением нерва, то, возможно, потребуются анализ крови и синовиальной жидкости, чтобы определить причину деформации сустава.
Можно ли определить по симптому, почему появляется боль в коленном суставе?
Точную причину боли можно будет понять только у специалиста и после соответствующих анализов. Однако примерно определить хотя бы область поражения вполне возможно:
Примерно определив причину боли, можно подготовиться к посещению врача, сделать необходимые анализы и снимки. Это сократит время диагностики и ускорит восстановление. Не пытайтесь лечить больное колено самостоятельно, так как можно ошибиться с причиной возникновения болезни и усугубить состояние. Сильную боль можно снять анальгетиками, а по поводу противовоспалительных средств, хондропротекторов, бандажа и физиотерапии лучше проконсультироваться у доктора.
Хромота после эндопротезирования тазобедренного и коленного суставов: причины и что делать
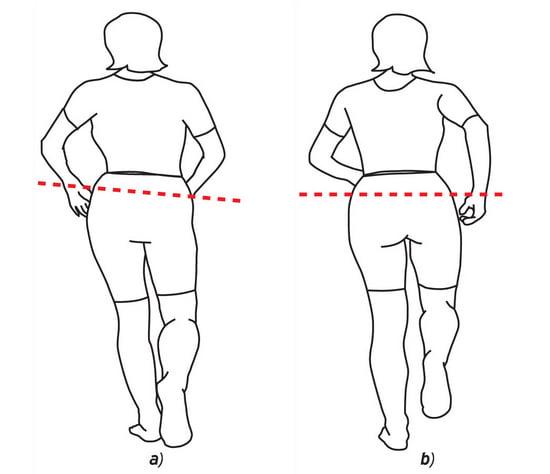
Хромота — патологическое изменение походки, возникающее вследствие поражения костей, мышц или суставов нижних конечностей. При данном нарушении человек старается как можно меньше наступать на больную ногу и стремится побыстрее перенести вес на здоровую. Походка больного становится резко асимметричной.
После эндопротезирования у пациентов развивается «падающая хромота». Человек резко переносит весь свой вес на прооперированную конечность. Подобное явление обычно говорит об удлинении ноги.
Причины хромоты в послеоперационном периоде
Хромота в первые недели после хирургического вмешательства – это нормально. Основная причина — незажившая послеоперационная рана, неполная адаптация к установленному эндопротезу и рефлекторные попытки «защитить» ногу от чрезмерной нагрузки.
При наличии качественной полноценной реабилитации хромота полностью проходит в течение 4-6 месяцев.
Перекос таза во время ходьбы.
Таблица 1. Основные причины хромоты и методы ее коррекции.
| Причина | Механизм развития | Принципы лечения |
| Ранний послеоперационный период | Наличие послеоперационной раны, неполное восстановление функциональной активности мышц и замененного сустава. | Ранняя активизация пациента с полной или дозированной нагрузкой на прооперированную ногу. |
| Патологический стереотип походки | Сохранение мышечной контрактуры, которая сформировалась у пациента еще до операции. | Проведение качественных реабилитационных мероприятий в позднем и отдаленном послеоперационном периоде. |
| Отсутствие качественной реабилитации | Неполное восстановление мышечной силы и тонуса из-за отсутствия достаточной физической нагрузки. | Больному требуется помощь квалифицированного реабилитолога или специалиста по восстановительной медицине. |
| Ошибки в установке протеза | Укорочение нижней конечности вследствие неправильной ориентации компонентов эндопротеза в ходе операции. Причиной также может быть установка неподходящего импланта. | Использование специальных каблуков, набоек или подкладок под пятку. |
| Развитие осложнений | Развитие инфекционных осложнений или асептическое расшатывание протеза. | Пациенту требуется серьезное лечение. В особо тяжелых случаях больному рекомендуют ревизионную (повторную) замену сустава. |
Стереотип патологической походки
Всех людей с длительнотекущими дегенеративными заболеваниями суставов беспокоят хронические боли. Это вынуждает их щадить больную конечность, сокращая время опоры на нее. Со временем это приводит к патологической походке.
При отсутствии медицинской помощи в предоперационном периоде у больного развиваются контрактуры (мышечные спазмы). Это ведет к рефлекторному перекосу таза, искривлению позвоночника и еще большей асимметрии походки. Вскоре нужно использовать дополнительную опору – трости или костыли. Хромота становится не просто плохой привычкой, а приспособительной реакцией организма.
Факт! После эндопротезирования мышечные контрактуры сами по себе никуда не деваются. Убрать их можно лечебной физкультурой и методами физиотерапии. При отсутствии хорошей реабилитации такая хромота может сохраниться на всю жизнь.
Отсутствие полноценной реабилитации
Неправильное поведение в послеоперационном периоде нередко приводит к снижению мышечной силы и постепенной мышечной атрофии. Из-за этого человек начинает хромать даже при нормальном функционировании установленного протеза.
Основные ошибки в реабилитации:
В РФ отсутствие реабилитации является настоящей проблемой. Практически все государственные больницы и частные клиники выписывают своих пациентов уже через несколько дней после операции. Как правило, врачи дают своим пациентам рекомендации и отпускают их в «свободное плаванье». Естественно, человека никто не контролирует и не проверяет, правильно ли он все делает. Это и приводит к нарушению функционирования мышц и сохранению хромоты.
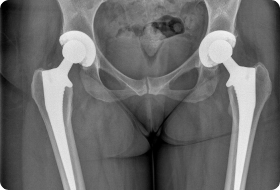
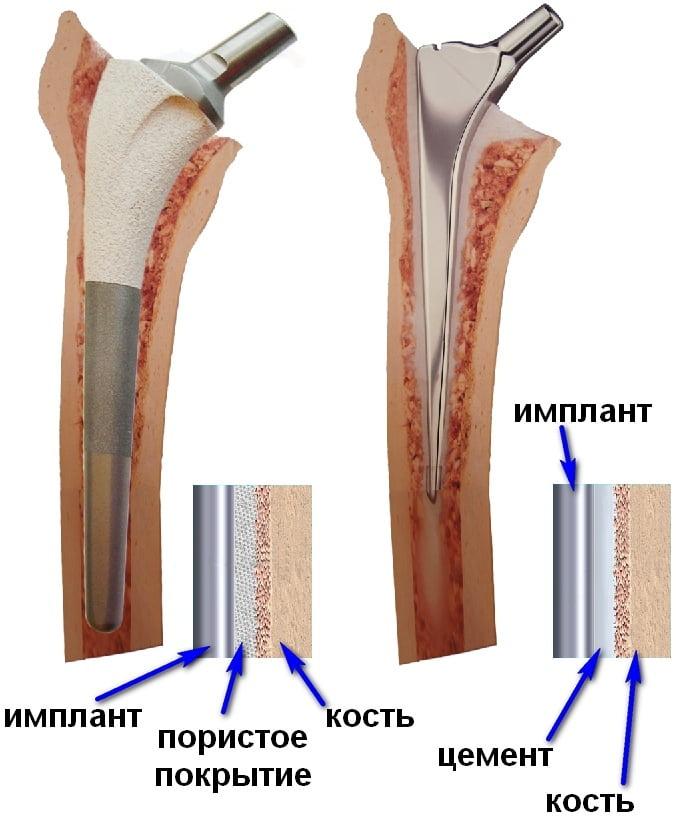
Неправильная установка эндопротеза
Осложнение возникает при использовании моноблочных эндопротезов с бесцементной фиксацией. Именно такие импланты ставят жителям РФ, которые оперируются «по квоте». Несоответствие размеров ножки эндопротеза каналу бедренной кости вынуждает хирурга низводить бедро, из-за чего нога становится длиннее.
Разница в длине нижних конечностей может возникать из-за неправильного подбора эндопротеза или ошибок врача в его установке.
В первые месяцы после операции некоторым пациентам кажется, что их ноги имеют разную длину. Как правило, подобное ощущение вскоре проходит. Однако нередко хромота и асимметрия конечностей сохраняется долгое время. Подобное явление может указывать на неправильный подбор и установку импланта.
Развитие инфекционных или неинфекционных осложнений
Появление хромоты, сильных болей, гиперемии и других признаков воспаления в раннем послеоперационном периоде указывает на инфекционные осложнения. Отметим, что парапротезная инфекция чаще всего развивается в первый год после хирургического вмешательства. Она очень опасна и требует немедленного лечения.
В более поздние сроки развивается асептическое расшатывание компонентов эндопротеза. Патология вызывает нестабильность сустава, что нередко ведет к хромоте и трудностям при ходьбе. Осложнение возникает как минимум через 5-10 лет после операции. Причина — системный остеопороз или остеолиз.
Как выяснить причину хромоты
Из-за контрактур после эндопротезирования кажется, что прооперированная нога короче здоровой. Чтобы выяснить, так ли это, необходимо измерить длину конечностей и проанализировать результаты рентгенографии. Ориентиром при измерении ног должны служить исключительно костные структуры.
Факт! Для выявления инфекционных и неинфекционных осложнений необходимы дополнительные лабораторные и инструментальные методы исследования. Больному назначают сдачу анализов, рентгенографию, рентгенофистулограцию, денситометрию, микробиологические исследования.
Методы профилактики и лечения хромоты
Избежать развития хромоты после замены сустава можно путем адекватного планирования и проведения операции. Во всем этом большую роль играет квалификация врача и медперсонала, занимающегося лечением пациента. Значение имеет и количество средств, которые человек планирует потратить на операцию и реабилитацию.
Основные меры, помогающие избежать хромоты:
Вывод: если имплант установлен корректно и не диагностировано других осложнений, то вероятнее всего, хромота является приобретенным стереотипом, избавится от которого можно путем ежедневных тренировок ровной симметричной походки. Это можно сравнить с тренировкой походки топ-моделей, когда внимание полностью сосредоточено на симметричности движений.
Можно ли получить инвалидность
Хромота после замены любого крупного сустава не является основанием для получения инвалидности. Группу могут давать только людям, которые перенесли двухстороннее эндопротезирование коленного или тазобедренного сустава, у которых возникли тяжелые осложнения. Так что если вы просто хромаете, но у вас нет никаких других тревожных симптомов – инвалидность вам не дадут.
Перемежающаяся хромота: лечебная тактика практикующего врача
Рассмотрены направления комплексного лечения пациентов с перемежающейся хромотой атеросклеротической этиологии и ее осложнением в виде критической ишемии нижних конечностей, в том числе с применением генно-терапевтических ангиогенных препаратов.
The directions of the complex treatment of patients with the intermittent lameness of atherosclerotic etiology and its complication in the form of critical ischemia of lower limbs are examined, including application of the henna-therapeutic angyo-genic preparations.
В текущем 2013 г. вышел в свет новый пересмотр Национальных рекомендаций по ведению пациентов с заболеваниями периферических артерий. Важное место в нем уделено заболеваниям сосудов ног. Несмотря на отсутствие полноценных статистических данных можно констатировать, что расчетное число страдающих данным заболеванием исходя из распространенности (0,9–7% от популяции в зависимости от возрастной группы) в России не менее 1,5 млн, значит, у 100 000 граждан выявляют терминальную (критическую) форму заболевания; что ежегодно приводит только по данному показанию к выполнению 20 000–40 000 ампутаций.
Перемежающаяся хромота (ПХ) — основной клинический синдром атеросклеротического поражения артерий нижних конечностей [1]. К сожалению, большая часть специалистов забывает об актуальности данного заболевания; возможно, на фоне драматического течения других проявлений атеросклероза данная форма незаслуженно не приковывает пристального внимания. Вместе с тем распространенность ПХ в зависимости от возраста составляет от 0,9% до 7,0%. Согласно авторитетным изданиям и крупным популяционным исследованиям (группа SAGE, 2010; Российский согласительный документ, 2013; исследование PANDORA, 2012) распространенность заболеваний периферических артерий является высокой, варьируя от 5,8% в США и 7% в России до 12,2% и 22,9% во Франции и Италии соответственно. Важно, что до 50% больных с ПХ никогда не обращались к врачам по поводу этих симптомов, но при этом они испытывают дискомфорт из-за болей в ногах. Медицинские специалисты при осмотре таких пациентов в случае их обращения в лечебно-профилактические учреждения по поводу других жалоб не опрашивают их на наличие ишемических болей в ногах при ходьбе [2].
Установлено, что именно атеросклероз является причиной поражения периферических артерий в 80–90% случаев [3], остальную часть составляет «чистая» диабетическая ангиопатия (без фонового значимого атеросклероза сосудов нижних конечностей) и поражение сосудов аутоиммунного генеза. Давно известно, что у больных с ПХ существует высокий риск развития инфаркта миокарда (ИМ) и острого нарушения мозгового кровообращения. Так, по сравнению с обычной популяцией, риск ИМ у них повышен от 20% до 60%, а риск смерти от коронарной патологии от 2 до 6 раз. При ПХ риск развития острого нарушения мозгового кровообращения повышается на 40% [2].
Больше чем у половины больных с заболеваниями периферических артерий уже на момент обращения регистрируется IIБ (хирургическая) стадия заболевания по классификации А. В. Покровского–Фонтейна, что соответствует перемежающейся хромоте, возникающей при прохождении 50–200 м [4]. Такие пациенты являются кандидатами для проведения эндоваскулярного открытого либо гибридного оперативного лечения [5]. Тем не менее, высокий уровень развития современной реконструктивной хирургии артерий нижних конечностей не может решить всех проблем у данной группы пациентов. Успех реконструктивных вмешательств напрямую зависит от состояния т. н. путей оттока — сосудов, расположенных ниже паховой складки [6]. По некоторым данным, до 40% пациентов, нуждающихся в оперативном лечении, не может быть выполнена артериальная реконструкция вследствие дистального либо распространенного мультифокального поражения артериального русла [7].
Появление болей покоя и язвенно-некротических изменений кожных покровов вплоть до гангрены у пациентов с ПХ свидетельствует о развитии критической ишемии нижних конечностей (КИНК), состояния декомпенсации артериального кровотока. Лечение КИНК требует более активного подхода как в отношении фармакотерапии, так и хирургических вмешательств. Динамика и статистика КИНК такова, что в течение первых 6 месяцев после диагностирования КИНК конечность удается сохранить лишь в 40% случаев, так как 20% больных умрут, а остальным будет выполнена большая ампутация. В результате к концу первого года после верификации диагноза лишь 45% больных имеют шанс сохранения конечности, около 30% продолжают жить после ампутации бедра или голени, четверть пациентов не переживут этот временной рубеж (рис. 1) [2].
Признано (А. В. Гавриленко и др., 2010), что при установлении диагноза заболеваний периферических артерий у пациента с ПХ или КИНК консервативная терапия показана вне зависимости от локализации и распространенности сосудистого поражения и назначается пожизненно [9]. После выполнения эндоваскулярных или оперативных вмешательств на артериях необходимость в консервативном лечении также сохраняется. В случаях, когда нет возможности достигнуть адекватной компенсации кровообращения хирургическими методами, изолированное использование терапевтического лечения остается единственной лечебной тактикой врача.
Современные подходы к консервативной терапии
Согласно руководству Американской ассоциации кардиологов (2005) основная цель консервативной терапии у пациентов с ПХ и КИНК — это улучшение качества жизни и снижение риска развития фатальных сердечно-сосудистых событий [10]. Для этого лечебная тактика врача должна включать как коррекцию факторов риска, так и назначение эффективных лекарственных препаратов. Одним из ведущих направлений коррекции факторов риска является отказ от курения, что включает в себя модификацию поведения, никотин-заместительную терапию, терапию бупропионом) (класс доказательности I) [2] (рис. 2).
Всем пациентам с ПХ показана эффективная физическая нагрузка — дозированная ходьба, то есть ходьба до появления почти максимальной ишемической боли (класс доказательности I). Программа лечебной физкультуры рекомендуется в качестве первоначальной формы лечения пациентов с перемежающей хромотой как основного проявления хронической ишемии нижних конечностей (ХИНК) (уровень доказательности A). Продолжительность занятий лечебной физкультурой составляет от 30 до 45 мин минимум, занятия проходят 3 раза в неделю, минимальный курс — 12 недель. Максимальная эффективность дозированной ходьбы проявляется через 1–2 месяца и сохраняется через 3 и более месяцев. Благоприятный эффект объясняется улучшением метаболизма скелетной мускулатуры, увеличением мышечной массы, а также улучшением функции эндотелия и, в меньшей степени, формированием коллатерального кровообращения [2].
Важным направлением является контроль за уровнем липидов в крови. Лечение ингибиторами гидроксиметилглутарил-ацетил-коэнзим А-редуктазы (статины) показано всем пациентам с заболеваниями периферических артерий (ЗПА) для достижения целевого уровня липопротеинов низкой плотности (ЛПНП) менее 100 мг/дл (класс доказательности I). Лечение дислипидемии снижает риск развития нежелательных сердечно-сосудистых событий у пациентов с атеросклерозом. Однако клиническая картина тяжелого поражения артериального русла нижних конечностей не всегда строго коррелирует с изменениями липидного спектра крови и уровнем холестерина и ЛПНП [2].
Всем пациентам с ЗПА, как с ПХ, так и КИНК, показан контроль уровня глюкозы крови (уменьшение уровня гликозилированного гемоглобина до 7%), а при наличии сахарного диабета — интенсивная терапия антигипергликемическими препаратам либо инсулином, а также тщательный уход за кожей стоп и голеней (класс доказательности I) [2].
Помимо контроля за уровнем глюкозы, важным направлением в коррекции факторов риска ЗПА является контроль уровня артериального давления (АД). Оптимальным у пациентов без сопутствующей патологии следует считать уровень АД менее 140/90 мм рт. ст., в то время как наличие таких состояний, как артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность, сахарный диабет и почечная недостаточность, обусловливают необходимость поддержания цифр АД на уровне менее 130/80 мм рт. ст. (класс доказательности I). Целевыми препаратами являются ингибиторы ангиотензинпревращающего фермента (АПФ), достоверно снижающие риск развития ИМ, инсульта и смерти из-за сердечно-сосудистых событий у пациентов с ЗПА [2].
Антиагрегантная (антитромбоцитарная) терапия в виде приема Аспирина в дозировке 75–325 мг/сутки либо клопидогреля 75 мг/сутки показана пациентам с атеросклерозом артерий нижних конечностей для снижения риска сердечно-сосудистых событий (класс доказательности I). Практическому врачу следует помнить, что у пациентов с ЗПА пероральные антикоагулянты с целью профилактики нежелательных сердечно-сосудистых ишемических событий применяться не должны [2].
Целесообразным является назначение пациентам с ПХ ингибитора фосфодиэстеразы III — цилостазола, обладающего вазодилатирующим, метаболическим и дезагрегантным эффектом (класс доказательности I). В дозировке 100 мг два раза в день препарат увеличивает дистанцию безболевой ходьбы (ДБХ) на 40–60% по сравнению с плацебо после 12–24 недель лечения [2, 10]. Цилостазол, однако, на территории Российской Федерации не зарегистрирован. Другим препятствием к его широкому применению служит необходимость отсутствия у пациента сопутствующей патологии в виде хронической сердечной недостаточности любого класса по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association, NYHA) [12], а также ограничения, введенные европейским медицинским агентством на его использование в 2013 г. в связи с высокой вероятностью побочных эффектов [13].
Пентоксифиллин в дозе 1200 мг в сутки может рассматриваться как один из основных препаратов для увеличения максимально проходимой дистанции (МПД) у пациентов с ПХ (класс доказательности IIB). Пентоксифиллин улучшает микроциркуляцию и реологические свойства крови, оказывает сосудорасширяющее действие, блокирует фосфодиэстеразу и способствует накоплению циклического аденозинмонофосфата в клетках, что приводит к минимальному, но статистически значимому увеличению ДБХ на 21–29 метров и максимально проходимой дистанции на 43–48 метров [2, 14, 15].
Сулодексид (250 ЛЕ перорально 2 раза в день), ранее рекомендованный к применению у пациентов с КИНК, в настоящее время рекомендован пациентам с ПХ. У данной когорты пациентов сулодексид увеличивает ДБХ до 95% при курсовом применении в сочетании с парентеральным введением (класс доказательности IIА). Эффективность препарата объясняется комплексным воздействием на основные звенья патогенеза заболевания: коррекция дисфункции эндотелия, нормализация реологии крови и микроциркуляторного русла, повышение фибринолитической активности.
Перспективным направлением в комплексном лечении пациентов с ПХ атеросклеротической этиологии является коррекция дисфункции эндотелия, направленная на стимуляцию синтеза оксида азота (NO) клетками эндотелия. Дисфункция эндотелия выражается в повышенной проницаемости и адгезивности, а также в увеличенной секреции прокоагулянтных и сосудосуживающих факторов, что может рассматриваться в качестве раннего этапа развития сосудистого поражения [16]. NO является важным регулятором метаболизма клеток и играет важную роль в патогенезе эндотелиальной дисфункции [17]. Положительное влияние, направленное на коррекцию дисфункции эндотелия, может иметь интермиттирующая пневмокомпрессия, в том числе у пациентов с критической ишемией нижних конечностей [18–20]. Другим вектором коррекции эндотелиальной дисфункции является применение препаратов группы ингибиторов ангиотензинпревращающих ферментов, преимущественно периндоприла, блокаторов рецепторов ангиотензина II, преимущественно лозартана [21–23], а также бета-адреноблокаторов, преимущественно небиволола [24–26]. Это особенно важно, учитывая высокую распространенность артериальной гипертензии, а также ишемической болезни сердца и хронической сердечной недостаточности у пациентов с ХИНК. Бета-адреноблокаторы являются эффективными антигипертензивными препаратами и не противопоказаны пациентам с заболеванием артерий нижних конечностей, как это представляется большинству практических врачей [2].
Коррекция дисфункции эндотелия также возможна за счет стимуляции секреции NO экзогенными факторами системы L-аргинин — NO — гуанилатциклазы, в частности, при использовании предшественника оксида азота L-аргинина [27–29]. Терапия, направленная на коррекцию эндотелиальной дисфункции, является чрезвычайно перспективной, однако в настоящее время находится большей частью на стадии клинических исследований.
Как указано в Национальных рекомендациях (2013), к высокому классу доказательности IIA относится применение генно-терапевтических препаратов [2]. Данная группа препаратов активно исследуется последние два десятилетия. Они являются агентами т. н. «терапевтического ангиогенеза» — новой лечебной тактики, призванной путем введения генно-терапевтических препаратов, кодирующих синтез различных короткоживущих и короткодистантных молекул (факторов роста, транскрипционных факторов) индуцировать развитие микрососудистой сети, а в дальнейшем привести к образованию коллатералей. Считается, что развитие микроциркуляторного русла в ишемизированном мышечном массиве нижних конечностей способствует оксигенации тканей, снижает общее периферическое сосудистое сопротивление, а образованные на уровне окклюзии новые сосуды способны эволюционировать в функциональные коллатерали. В качестве потенциальных лекарственных средств испытываются неинтегрирующиеся в геном плазмидные и аденовирусные генные конструкции. Большим количеством клинических исследований показана их безопасность, в том числе онкологическая [30, 31]. На уровне II фазы клинических исследований значимые результаты по увеличению дистанции безболевой ходьбы были получены с генами, кодирующими эндотелиальный cоcудистый фактор роста (vascular endothelial growth factor, VEGF165), основный фактор роста фибробластов (basic fibroblast growth factor, bFGF), фактор роста гепатоцитов (hepatocyte growth factor, HGF) и др. [30–34]. Однако на этапе III фазы эффективность для лечения была установлена не для всех конструкций. В частности, применение препарата на основе гена bFGF у пациентов с IV стадией заболевания (по А. В. Покровскому–Фонтейну) не влияло на продолжительность жизни и сохранность конечности [35]. В то же время плазмидная конструкция с геном HGF, примененная по тем же показаниям, достоверно снижала выраженность болевого синдрома, положительно влияла на качество жизни, способствовала заживлению язв, что явилось основанием к признанию ее эффективности [36].
В настоящее время в Государственный реестр лекарственных средств России включен генно-терапевтический препарат Неоваскулген, активным веществом которого является сверхскрученная плазмида с геном VEGF165. Его безопасность и эффективность были исследованы в ходе мультицентровых контролируемых рандомизированных исследований, показавших достоверное увеличение дистанции безболевой ходьбы, а также ряд иных эффектов, включающих увеличение тканевого напряжения кислорода, в некоторой степени — линейной скорости кровотока, лодыжечно-плечевого индекса [37, 38]. Препарат предназначен для включения в комплексную терапию пациентов с IIa-III степени ПХ (по Покровскому–Фонтейну) атеросклеротического генеза. Препарат вводится по 1,2 мг местно внутримышечно двукратно с интервалом в 14 суток. Возможности препарата реализуются в составе комплексной терапии. В рамках клинических исследований эффективность препарата была оценена у пациентов, которым не выполнялись хирургические методы реваскуляризации и которым не назначалась терапия препаратами группы простагландинов. Установлено, что в течение полугода у пациентов детектировали прирост дистанции безболевой ходьбы в среднем на 110,4%, а через год на 167,2%. В большей степени отвечали на терапию больные с более тяжелой стадией процесса — III, для них установлены приросты 231,2 и 547,5% соответственно. Также статистически значимые сдвиги регистрируются при контроле чрескожно определяемого напряжения кислорода. В меньшей степени меняются показатели макрогемодинамики — лодыжечно-плечевой индекс и линейная скорость кровотока. Немаловажно, что при оценке качества жизни у таких пациентов установлен значимый прирост по шкале «физический компонент здоровья» (p = 0,001).
При лечении КИНК, в случае невозможности выполнения эндоваскулярной или открытой артериальной реконструкции, терапевтический подход отличается от лечения ПХ. Простаноиды, препараты простагландина Е1 (PGE1) и простациклина I2 (PGI2), наиболее изучены при лечении КИНК. Многочисленные исследования показали, что парентеральное их введение в течение 7–28 дней может уменьшить боли в покое и способствовать заживлению трофических язв и, в ряде случаев, позволяет избежать или отсрочить ампутацию конечности (класс доказательности IIB, уровень доказательности А) [2].
Генно-терапевтические ангиогенные препараты, рекомендованные к применению в лечении ПХ, считаются потенциально эффективными в лечении больных КИНК. Показана их роль в комплексном лечении пациентов с КИНК в плане улучшения отдаленных результатов реконструктивных вмешательств [39]. Появляются первые данные (И. Н. Бродский, 2013) об успешном сочетании препаратов простациклинового ряда с индукцией развития микроциркуляторного русла Неоваскулгеном у тяжелых пациентов с КИНК.
Данные по эффективности гипербарической оксигенации, спинальной нейростимуляции, а также применяемых на территории России традиционных видов физиотерапии (лазеротерапия, магнитотерапия) в лечении КИНК являются противоречивыми, в связи с чем четких рекомендаций в отношении их применения не существует [2]. Обнадеживающие данные получены в отношении проведения регионарного катетерного тромболизиса в комплексной терапии КИНК при диабетической ангиопатии. Целью локального тромболизиса у данной когорты пациентов служит лечение и профилактика микротромбообразования, стабилизация коагуляционных свойств крови [2].
Эффективное лечение пациентов с перемежающейся хромотой и ее грозным осложнением в виде критической ишемии нижних конечностей является актуальной проблемой практической медицины в связи с недостаточно уделяемым вниманием, высокой морбидностью, трудностями лечения. Авторы статьи надеются, что приведенный в работе материал будет полезен в работе не только ангиохирургов, но и врачей других медицинских специальностей.
Литература
* ГБОУ ВПО РязГМУ МЗ РФ, Рязань
** ОАО Институт стволовых клеток человека, Москва




.jpg)
.gif)