что делать если пробили печень
Алкогольное поражение печени
Алкогольное поражение печени возникает на фоне регулярного употребления спиртного даже в небольших дозах. Этанол повреждает клетки органа, из-за чего нарушаются его функции, могут появляться воспалительные, некротические процессы. На начальной стадии алкогольное поражение протекает почти бессимптомно, не проявляет себя. В этом — опасность заболевания. Когда человек перестает употреблять спиртное, клетки печени восстанавливаются, но первый же запой спровоцирует новое поражение, причем в более тяжелой степени.
Начальное поражение клеток печени алкоголем провоцирует появление более серьезных заболеваний — цирроза, алкогольного гепатита.
Виды алкогольного поражения печени
Жировая дистрофия. На этой стадии процесс обратим даже без специального лечения — достаточно перестать употреблять спиртное. Стеатоз возникает под действием этанола, нарушающего функционирование и структуру гепатоцитов. Внутри них начинается накопление жира, который смещает ядро клеток. Постепенно размеры печени увеличиваются.
Стеатогепатит. Это — гепатит, обусловленный регулярным употреблением спиртного и развивающийся на фоне жировой дистрофии. При появлении воспалительного процесса гепатоциты продолжают увеличиваться в размерах, их структура меняется. Если повреждения оказываются тяжелыми, клетки гибнут, может начаться некротический процесс. Это влияет на структуру всего органа, нарушает его функции.
Цирроз. Продолжается накопление жиров, появляются фиброзные изменения ткани. Нарушается процесс регенерации — попытки самовосстановления приводят к формированию узелков ткани. Размеры органа уменьшаются. Фиброзная ткань разрастается, формирует широкие полосы, делит ткани на крупные узлы.
Работаем круглосуточно, опытные врачи, 100% анонимно.
Последовательное развитие трех этих состояний может приводить к летальному исходу: печень перестает выполнять свои функции, и человек погибает.
Главной причиной алкогольного поражения печени является регулярное употребление спиртного. Заболевание может появиться даже при небольшой ежедневной дозе (от 10 г чистого спирта, что соответствует 0,5 л пива или 0,2 л вина). Процесс может ускориться при приеме метаболизирующихся в печени препаратов, снижении иммунитета, поражении гепатотропными вирусами, нарушении питания, ослаблении иммунитета.
Признаки
На ранних стадиях симптоматика может отсутствовать. В редких случаях появляется болезненность в правом боку, проблемы с аппетитом, быстрая утомляемость.
Если заболевание прогрессирует, возникают общие симптомы:
Со временем на коже рук и ног могут появляться покраснения, сосудистые звездочки.
При развившемся алкогольном поражении печени меняется стул (темнеет, может становиться кровавым), появляется рвота с кровью, возможны кровотечения из носа, кровоточивость десен.
Ухудшается психическое состояние пациента, появляются провалы в памяти, снижается способность к концентрации, внимание становится рассеянным. Возможны частые смены эмоционального состояния, появление галлюцинаций, вялость и апатия или, напротив, возбуждение, раздражительность. Симптомы со стороны психики и ЦНС обусловлены и ухудшением работы органа, и формированием зависимости на фоне регулярного употребления алкоголя.
Диагностика и лечение
До составления плана лечения врач оценивает степень поражения клеток печени, ее состояние, общее состояние здоровья. В ходе диагностики выполняют лабораторную диагностику:
Дополнительно может потребоваться биопсия, проведение пункций.
До начала лечения пациент должен отказаться от употребления алкоголя. Любая доза спиртного будет провоцировать новое поражение гепатоцитов, ухудшать состояние печени. Для отказа от спиртного может использоваться медикаментозная кодировка (если нет противопоказаний), гипнотическое, психотерапевтическое кодирование, прием препаратов, снижающих тягу к спиртному.
Полное восстановление функций возможно при условии, что у пациента еще не развился цирроз. В план влечения включают детоксикацию (вывод продуктов распада, накопившихся токсинов из кровотока), витаминотерапию, прием гепатопротекторных препаратов.
Если заболевание дошло до стадии цирроза, важно стабилизировать состояние пациента, предупредить развитие осложнений (асцита, онкологии и т.п.). При тяжелой форме заболевания возможна трансплантация органа при условии, что пациент воздерживается от употребления спиртного. На любой стадии поражения важно соблюдение диеты, применение поддерживающей терапии, общее укрепление здоровья.
Медицинский центр «НаркоДок» выполняет лечение пациентов с алкогольным поражением печени. Срочная помощь врача нужна, если:
Врачи медицинского центра «НаркоДок» организуют комплексную диагностику, помогут пациенту отказаться от употребления спиртного, сформируют индивидуальную программу реабилитации. Если он отказывается от посещений клиники, возможен вызов нарколога на дом. Отказ от алкоголя и адекватная медикаментозная терапия помогут восстановить и сохранить здоровье человека даже после нескольких лет алкогольной зависимости.
Работаем круглосуточно, опытные врачи, 100% анонимно.
Симптомы и лечение дисфункции печени
Заболевание под названием «дисфункция печени» – не на слуху. Гораздо чаще мы слышим об избыточном весе или нарушении обмена веществ, хотя за симптомами этих недугов могут скрываться именно проблемы с печенью. В результате человек годами сидит на разных диетах и принимает лекарства, а лишние килограммы никуда не уходят, да еще и продолжают накапливаться.
Рано или поздно пациент разочаровывается во всех испробованных методах похудения и нормализации обмена веществ. Многие начинают с диет и спорта, затем переходят на лекарственные препараты, а порой доходит и до хирургических вмешательств с целью уменьшить объем желудка. Тратятся огромные деньги, прикладываются колоссальные усилия, а результата нет.
Что такое дисфункция печени? Как она влияет на вес?
Основная роль печени – ликвидировать жир. Эта «неутомимая труженица» занимается очисткой организма. Если печень по каким-то причинам начинает работать с перебоями, то возникают симптомы, схожие с признаками ожирения: избыточный вес, одышка, сосудистые заболевания. Поэтому лишние килограммы свидетельствуют не только о превышении среднесуточной калорийности рациона, но и о возможных неполадках с печенью.
Почему возникает дисфункция печени? Это влияние нашего образа жизни и пищевых привычек, а также наследственных факторов. Печень – это наша маленькая «мусоросжигательная фабрика». Если «мусор» поступает в умеренных количествах, то печень работает в штатном режиме и хорошо справляется с нагрузкой. А если «мусора» оказывается больше, чем печень способна переработать, то она начинает функционировать в «аварийном режиме», и в организме откладывается жир.
Фастфуд, полуфабрикаты, обилие сладкой, мучной и жирной пищи, алкоголь – это огромная ежедневная нагрузка на печень. Если такой рацион сохраняется годами, то печень начинает «барахлить» и провоцирует жировые отложения в проблемных зонах. И наоборот, если придерживаться принципов здорового питания, ограничивать вредную пищу и алкоголь, соблюдать специальную диету для печени, то обмен веществ постепенно нормализуется, и Вы начнете худеть.
ПЕЧЕНОЧНАЯ ЭНЦЕФАЛОПАТИЯ в практике врача скорой медицинской помощи
Какие клинические симптомы позволяют диагностировать ПЭ? Каковы проявления неврологических нарушений на разных стадиях развития ПЭ? В чем заключаются особенности развития ПЭ при алкоголизме? Каких ошибок должен избежать врач при лечении ПЭ?
Какие клинические симптомы позволяют диагностировать ПЭ?
Каковы проявления неврологических нарушений на разных стадиях развития ПЭ?
В чем заключаются особенности развития ПЭ при алкоголизме?
Каких ошибок должен избежать врач при лечении ПЭ?
Этиология и патогенез
Печеночная энцефалопатия (ПЭ) представляет собой потенциально обратимое расстройство нервной и психической деятельности, возникающее при любом из заболеваний печени, протекающем с недостаточностью печеночно-клеточной функции. В большинстве случаев ПЭ осложняет течение терминальной стадии хронических диффузных заболеваний печени или острого некротизирующего (фульминантного) гепатита. Установлено, что при поражении печени любой этиологии ПЭ может привести к развитию комы и стать непосредственной причиной смерти пациента (см. таблицу 1).
| Таблица 1. Причины развития ПЭ. | ||
| Вариант энцефалопатии | Выживаемость | Этиология |
| Острая энцефалопатия без фиброза/цирроза печени | 20–45% | Вирусный гепатит. Алкогольный гепатит. Острые отравления (химические и биологические яды, лекарства). Абстинентный синдром |
| Острая энцефалопатия на фоне фиброза/цирроза печени | 70-80% | Форсированный диурез Рвота, понос Кровотечение ЖКК Инфекции Прием алкоголя Абстинентный синдром Запор Избыток белка в рационе Хирургические вмешательства Прием седативных средств |
| Хроническая портосистемная энцефалопатия при терминальном заболевании печени | 100% | Портосистемное шунтирование Контраминация кишечника Избыток белка в рационе |
 |
| Рисунок 1. Механизм развития ПЭ. |
Патогенез ПЭ не до конца установлен. Считается, что развитие ПЭ является результатом сочетанного влияния на ЦНС нескольких механизмов, активность которых инициируется и поддерживается выраженным нарушением печеночного клиренса токсинов и метаболитов (см. рисунок 1). Наиболее существенным для развития ПЭ считают:
Клинические симптомы и диагноз ПЭ. Тип и количество избыточных, «токсических» метаболитов, циркулирующих в плазме и ЦНС, в той или иной степени коррелируют с различными симптомами ПЭ, к числу которых относят:
Механизм развития ПЭ
К ранним признакам нарушений сознания (НС) при ПЭ относят уменьшение спонтанных движений, фиксированный взгляд, заторможенность, апатию. Для нарушения сознания при ПЭ в принципе характерны сонливость и инверсия нормального ритма сна и бодрствования. При этом ухудшение состояния и переход сонливости в кому могут произойти в течение очень короткого времени. Для определения степени НС нередко применяют шкалу Глазго (см. таблицу 2). Однако в клинической практике для оценки глубины НС именно при ПЭ используют более простую качественную шкалу, в соответствии с которой:
Неврологические нарушения при ПЭ в целом не носят специфического характера и могут также развиваться при уремии, выраженной дыхательной и сердечной недостаточности. Однако одним из наиболее патогномоничных неврологических симптомов ПЭ считают развитие «хлопающего» тремора (астериксиса), отличительной чертой которого является неспособность пациента удерживать фиксированную позу. Наибольшая выраженность гиперкинеза мышц конечностей при поддержании постоянной позы и его уменьшение при движении позволяют дифференцировать астериксис от тремора при алкогольном делирии и нейроэнцефалопатии.
Наиболее надежным способом определить степень нарушений интеллекта при ПЭ является проведение теста связывания чисел (тест Рейтана). Изменения личности и интеллекта при ПЭ наиболее трудны для диагностики, поскольку всегда накладываются на конституциональные, приобретенные ранее нарушения и всегда требуют оценки в динамике. Наибольшие трудности в клинической практике встречаются при дифференциальной диагностике ПЭ и нарушений личности, развивающихся при хроническом злоупотреблении алкоголем (токсическая или алкогольная энцефалопатия, наличие которой прямо не влияет на исход острой ПЭ, однако определяет риск развития делирия на фоне алкогольного абстинентного синдрома). Важно, что при алкоголизме острая ПЭ может развиться при любой из клинико-морфологических форм алкогольной болезни печени (см. рисунок 2).
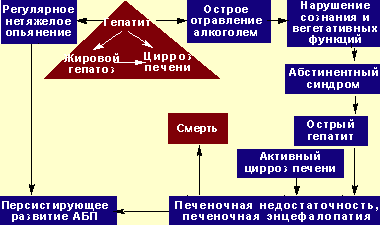 |
| Рисунок 2. Естественная история развития алкогольной болезни печени при хроническом злоупотреблении алкоголем. |
ПЭ у больных алкоголизмом в целом имеет те же характерные признаки, что и в остальных случаях, однако у них часто наблюдается мышечная ригидность, гиперрефлексия, клонус стоп. Алкогольный делирий отличается от «чистой» ПЭ продолжительным двигательным возбуждением, повышенной активностью вегетативной нервной системы, бессонницей, устрашающими галлюцинациями и быстрым мелким тремором (см. таблицу 3). Часто наблюдается выраженная анорексия, сопровождающаяся тошнотой и рвотой.
Характерной особенностью ПЭ является изменчивость клинической картины. Диагностировать ПЭ легко, например, у больного с циррозом печени,
с массивным желудочно-кишечным кровотечением или сепсисом, при обследовании которого определяют спутанность сознания и хлопающий тремор. В случае, когда очевидных причин ухудшения состояния выявить не удается и признаков цирроза печени также нет, распознать начало ПЭ невозможно, если не придать должного значения малозаметным признакам синдрома. Большое значение при этом могут иметь данные анамнеза, полученные от членов семьи, заметивших изменения в состоянии или поведении больного.
У больных с острой ПЭ без признаков хронической портальной гипертензии (варикозные вены передней стенки живота, отечно-асцитический синдром, спленомегалия, заболевание печени или алкоголизм в анамнезе) диагностика на догоспитальном этапе особенно затруднена. В этих случаях она должна базироваться, во-первых, на тщательном изучении анамнеза, если это возможно; во-вторых — на анализе эффективности применения стандартной неспецифической терапии комы. Дифференциальный диагноз у больных без цирроза печени необходимо проводить с рядом заболеваний, приводящих к внезапному и выраженному нарушению сознания (см. таблицу 4).
| Таблица 4. Причины острых нарушений сознания у больных без признаков портосистемного шунтирования. | ||
| Заболевание | Характерные симптомы и анамнестические данные | Неотложная терапия |
| Гипогликемия | Гипотония, брадикардия, сахарный диабет или сахаросни-жающая терапия в анамнезе | Введение концентри-рованной декстрозы |
| Острое отравление алкоголем | Запах алкоголя, гипертония, одышка, гиперемия лица, тахикардия, указания на прием алкоголя | Массивная инфузионная и поддерживаю-щая терапия |
| Алкогольный синдром отмены с делирием | Хроническое злоупотребление алкоголем, последний прием алкоголя не более трех-пяти дней назад, острый психоз с возбуждением и галлюцинациями | Введение маннитола концентри-рованной глюкозы и диазепама, поддерживаю-щая терапия |
| Острое отравление диазепинами | Глубокое нарушение сознания, указание на психоэмоцио-нальные проблемы, попытки самоубийства | Введение флумазенила, поддерживаю-щая терапия |
| Острое отравление парацетамолом | Указание на недавнее воспалительное заболевание, психоэмоцио-нальные проблемы, попытки самоубийства | Введение ацетил-цистеина, поддерживаю-щая терапия |
| Острое отравление опиатами | Указание на наркоманию, симптомы опиатного опьянения | Введение налоксона, поддерживаю-щая терапия |
| Энцефалопатия Вернике | Нистагм, двусторонний парез отводящих мыщц, указания на голодание, алкоголизм в анамнезе | Введение тиамина |
| Внутричерепные патологические процессы (травма, инфаркт, аневризма, менингит, энцефалит) | Анамнестические указания, характерные сипмтомы, отсутствие эффекта от экстренной терапии комы | Поддерживаю-щая терапия, экстренная госпитализация |
| Эндогенные интоксикации и гипоксические состояния (уремия, ОРДС, острые инфекционные заболевания) | Анамнестические указания, характерные симптомы, отсутствие эффекта от экстренной терапии комы | Поддерживаю-щая терапия, экстренная госпитализация |
У больных циррозом печени и активным портосистемным шунтированием важнейшим вопросом диагностики также является определение причин, приведших к развитию ПЭ (см. таблицу 5).
В большинстве случаев любой из перечисленных выше факторов либо напрямую подавляет функции ЦНС, либо нарушает их опосредованно — угнетая функцию печени, увеличивая концентрацию азотсодержащих продуктов в кишечнике и количество крови, протекающей, минуя печень, через портокавальные анастомозы.
Лабораторные данные занимают довольно скромное место в диагностике ПЭ. Известно, что ни функциональные печеночные пробы, ни повышенная концентрация аммиака в плазме прямо не коррелируют с выраженностью нарушений сознания.
Лечение ПЭ
Лечение ПЭ преследует три базовые цели:
Схематично лечение ПЭ (III и IV стадии) представлено в таблице 6.
Объем лечебных мероприятий при ПЭ относится к числу стандартных и выверенных клинической практикой алгоритмов неотложной помощи, поскольку эффективность лечения прямо зависит от как можно более раннего начала терапии. В этом смысле фармакотерапия ПЭ прямо относится к презумпции скорой медицинской помощи. Тем не менее на практике оказывается, что пациенты с ПЭ, как на догоспитальном этапе, так и в условиях стационара, нередко не получают адекватного лечения. Более того, во многих случаях больным назначают фармакотерапию, которая способна спровоцировать ухудшение состояния сознания и нарушение вегетативных функций. К числу наиболее распространенных ошибок лечения можно отнести:
Одной из наиболее существенных причин проведения неадекватного лечения нередко является часто неудовлетворительная диагностика ПЭ. Как ни парадоксально, сегодня во всех звеньях здравоохранения на фоне реально существующих регламентирующих врачебную деятельность документов выявление и точная квалификация ПЭ как угрожающего жизни осложнения основного заболевания печени в значительной степени утратила практический смысл. Например, при алкогольной болезни печени и в практике СМП, и в стационаре ПЭ нередко вообще не диагностируется, поскольку включена в редко используемые рубрики «острая или подострая печеночная недостаточность», «острый гепатит», «острое отравление алкоголем» или «абстинентное состояние». В подавляющем большинстве случаев при выявлении алкогольной болезни печени с нарушением сознания на практике ставятся диагнозы, соответствующие рубрикам К.70.0 — К.70.2, что нисколько в случае с ПЭ не отражает реального положения дел (см. таблицу 7). Кроме того, термин «ПЭ» при диагностике часто подменяется термином «токсическая (алкогольная) энцефалопатия», что влечет за собой недооценку тяжести состояния больного и риска летального исхода и позднее начало специфического лечения.
При выявлении ПЭ на догоспитальном этапе пациенты с III и IV стадиями нарушения сознания должны быть немедленно госпитализированы в отделение интенсивной терапии.
Прогноз ПЭ
Прогноз ПЭ всецело зависит от выраженности печеночно-клеточной недостаточности и времени начала лечения. При циррозе печени у больных с относительно сохранной функцией паренхимы и интенсивным коллатеральным кровообращением прогноз лучше, а у больных с острым гепатитом — хуже. Прогноз существенно улучшается, если удается быстро устранить факторы, ведущие к усугублению ПЭ: инфекцию, передозировку диуретиков или кровопотерю. Однако наиболее эффективным способом улучшить прогноз является как можно более точная диагностика и раннее начало лечения ПЭ.
Литература
Е. И. Вовк
МГМСУ, ННПОСМП, Москва
Что делать если пробили печень
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Закрытая травма живота. Повреждения печени. Часть 1
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(12): 5-13
Смоляр А. Н. Закрытая травма живота. Повреждения печени. Часть 1. Хирургия. Журнал им. Н.И. Пирогова. 2015;(12):5-13.
Smoliar A N. Closed abdominal trauma. Liver injuries. Part 1. Khirurgiya. 2015;(12):5-13.
https://doi.org/10.17116/hirurgia2015125-13
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Статистические данные о летальности при закрытой травме отсутствуют. Косвенную информацию о ней можно получить, анализируя летальность от «Внешних причин» (МКБ, глава XX, разделы V01-V99 («Транспортные происшествия») и W00-X59 («Другие происшествия»), частью которых является закрытая травма. «Внешние причины» устойчиво сохраняют 4—5-е место по частоте среди причин смерти в России и США [4, 5, 36, 47, 72]. Хотя смертность от внешних причин в России с 2000 по 2012 г. снизилась на треть (табл. 1), она все еще составляет почти 200 тыс. человек в год [5].

Повреждения печени при закрытой абдоминальной травме по частоте стоят на 2-м месте после повреждения селезенки (примерно 15—20%), а по летальности — на 1-м [17, 23, 28]. Причиной смерти пострадавших с массивной кровопотерей в ранние сроки после травмы является «летальная триада» — ацидоз, коагулопатия, гипотермия. Эти патогенетические механизмы доказаны как в экспериментальных [25, 57], так и в клинических работах [13, 21].
Повреждение печени чаще бывает у мужчин трудоспособного возраста, его причиной обычно служит дорожно-транспортное происшествие [58, 74].
Типичный механизм повреждения печени — ее сдавление между ребрами и позвоночником или задней брюшной стенкой. Резкое торможение туловища приводит к возникновению сил сдвига в области связочного аппарата печени, а внезапное повышение давления в системе нижней полой или воротной вены за счет передачи давления на внутриорганные вены — к «внутрипеченочному взрыву». Быстрое повышение давления в правой плевральной полости может приводить к повреждению диафрагмальной поверхности печени.
Поскольку элементы портальной триады находятся в плотной фиброзной капсуле, предотвращающей их повреждение, разрывы печени чаще всего располагаются параллельно портальным щелям или непосредственно в них. Печеночные вены и их притоки не имеют фиброзной капсулы, поэтому повреждаются чаще [3, 9]. Почти в 85% наблюдений повреждения печени располагаются в более массивной правой доле, обычно в VI, VII и VIII сегментах.
В России разработано несколько классификаций повреждений печени [3, 6, 8, 9]. В иностранной литературе чаще используют классификацию Organ Injury Scaling [59], созданную American Association for the Surgery of Trauma (AAST). Эту классификацию иногда ошибочно называют классификацией E. Moore. Считаем необходимым полностью привести ее раздел, касающийся повреждения печени (табл. 2).

Клиническая картина травмы печени неспецифична. Внимательный клинический осмотр, особенно пострадавшего, находящегося в тяжелом состоянии, играет важную роль [52]. Сочетание клинических признаков кровопотери и наличия жидкости в брюшной полости делает диагноз внутрибрюшного кровотечения весьма вероятным. Чем интенсивнее внутрибрюшное кровотечение, тем отчетливее клиническая картина. Наличие следов травмы в проекции печени (ссадины, гематомы), перелом IV—XII ребер справа или соответствующий механизм травмы (например, падение с высоты на правый бок) заставляет предположить разрыв печени в качестве источника внутрибрюшного кровотечения, но не является ни необходимым, ни достаточным условием для установления этого диагноза. Небольшой гемоперитонеум может не проявляться клиническими признаками и диагностироваться только при инструментальном обследовании.
R. Afifi [12] разделяет пострадавших на три группы: нуждающиеся в немедленной лапаротомии, нуждающиеся в дополнительном обследовании, нуждающиеся в дальнейшем наблюдении без дополнительного обследования. Любой пострадавший с травмой живота сразу после поступления должен быть отнесен к одной из групп в зависимости от показателей гемодинамики. В НИИ скорой помощи им. Н.В. Склифосовского дополнительное инструментальное обследование проводят всем пациентам с закрытой травмой живота. Объем обследования зависит от предполагаемого диагноза, тяжести состояния пострадавшего и технической оснащенности стационара.
Хирург обязан знать точность, возможности и ограничения любого метода диагностики, назначать их по показаниям. Целью обследования является обнаружение повреждений, угрожающих жизни (тяжелая черепно-мозговая или позвоночно-спинальная травма, множественные переломы ребер, гемо- или пневмоторакс, продолжающееся внутрибрюшное кровотечение, перелом костей таза и длинных трубчатых костей).
Пострадавших с нестабильной гемодинамикой (систолическое АД менее 90 мм рт.ст., шоковый индекс Альговера более 1,0, другие признаки шока) госпитализируют в реанимационное отделение, их немедленно осматривают хирург, травматолог и нейрохирург. Обследование надо проводить с одновременной интенсивной терапией или реанимационными мероприятиями. Обследование включает только «прикроватные» диагностические методы, по возможности неинвазивные, и проводится в максимально короткий срок.
Ультразвуковое и рентгенологическое исследования удовлетворяют перечисленным выше критериям. Они обладают достаточной точностью, являются неинвазивными, повторяемыми, не требуют транспортировки и перекладывания пострадавшего, занимают мало времени.
Рентгенография груди выполняется всем пострадавшим, она позволяет обнаружить перелом костного каркаса груди, гемо- и пневмоторакс, расширение средостения, перемещение органов брюшной полости в плевральную. Показания к рентгенологическому исследованию других областей определяют с учетом клинической картины и типичного спектра повреждений при определенном механизме травмы (например, пешеход сбит автомобилем или падение с высоты на выпрямленные нижние конечности).
Следует подчеркнуть, что точность УЗИ зависит от опыта врача, проводящего исследование [65], и составляет примерно 95% в определении свободной жидкости в брюшной и плевральной полости [53] и около 60% для верификации травмы паренхиматозных органов. Точность УЗИ увеличивается при повторных исследованиях и при повреждении органов III и более степени по Organ Injury Scaling (OIS). Существенно усложняют исследование и делают его менее информативным тканевая эмфизема в зоне эхолокации, вздутие кишечника, невозможность изменить положение тела пострадавшего.
Первичное УЗИ проводят по программе FAST (существуют две расшифровки этой аббревиатуры: focused abdominal sonography for trauma [24] и focused assessment with sonography in trauma [48]). В любом случае УЗИ по программе FAST включает осмотр печеночно-почечного углубления (карман Морисона), левого верхнего квадранта (поддиафрагмальное пространство, селезеночно-почечное углубление), латеральных каналов и таза. Мы считаем обязательным также осмотр обеих плевральных полостей, что позволяет выявить гемоторакс, а также заподозрить травму диафрагмы и легкого. При максимальном разобщении париетальной и висцеральной брюшины (4 см в одной анатомической области, 2 см в двух областях и 1 см в трех областях) примерное количество крови в брюшной полости составляет 500 мл. Пострадавшим с клинико-лабораторной картиной продолжающегося внутрибрюшного кровотечения и жидкостью в брюшной полости в количестве более 500 мл по данным FAST показана экстренная лапаротомия, продолжение УЗИ приводит к ненужной задержке операции и дополнительной кровопотере.
При стабильной гемодинамике и возможности продолжить исследование проводят осмотр органов брюшной полости и забрюшинного пространства. Прямым эхографическим признаком травмы печени является изменение структуры ее паренхимы (диффузное — контузия и очаговое — разрыв) или наличие подкапсульной гематомы. Хирургам, желающим более тщательно изучить эхосемиотику повреждений органов брюшной полости и забрюшинного пространства, рекомендуем ознакомиться со специальными работами [48, 65].
Первое упоминание о диагностическом перитонеальном лаваже при травме живота принадлежит, по-видимому, H. Root и соавт. [62]. Внедрение лапароцентеза и диагностического перитонеального лаважа в 60-е годы способствовало существенному улучшению диагностики внутрибрюшного кровотечения и соответственно результатов лечения. Недостатками лапароцентеза являются его инвазивность, ложноотрицательные результаты при травме забрюшинного пространства, центральных и подкапсульных гематомах печени и селезенки, разрыве диафрагмы, невысокая специфичность, приводящая к увеличению частоты диагностических лапаротомий [30, 41], а также риск ятрогенных осложнений и искажение результатов УЗИ и КТ, выполняющихся после лапароцентеза. Пострадавшие с нестабильной гемодинамикой и положительным результатом лапароцентеза нуждаются в экстренной операции.
В НИИ скорой помощи им. Н.В. Склифосовского в настоящее время лапароцентез при травме живота применяют крайне редко. Его выполняют при необходимости исключить или подтвердить внутрибрюшное кровотечение, если УЗИ неинформативно из-за массивной подкожной эмфиземы передней брюшной стенки, а гемодинамика пострадавшего нестабильна.
Пострадавшим со стабильной гемодинамикой и любыми (прямыми и косвенными) признаками травмы органов брюшной полости и забрюшинного пространства показано выполнение КТ живота. При возможности КТ проводят после предварительного контрастирования желудочно-кишечного тракта, в экстренных случаях это не является обязательным. Внутривенное болюсное введение контрастного вещества выполняют всегда. С 90-х годов прошлого века КТ считается «золотым стандартом» диагностики при абдоминальной травме, обладает почти 100% точностью и позволяет определить степень повреждения паренхиматозных органов и продолжающееся кровотечение [18, 45]. Недостаток К.Т. заключается в необходимости транспортировки и перекладывания пострадавшего, что невозможно при нестабильной гемодинамике и без предварительной иммобилизации переломов. Визуализация ухудшается при наличии металлических имплантов и аппаратов наружной фиксации.
В настоящее время установлено, что у пострадавшего со стабильной гемодинамикой только экстравазация контрастного вещества в свободную брюшную полость или паренхиму печени является компьютерно-томографическим признаком продолжающегося интенсивного кровотечения [38] и показанием к экстренной операции (открытой или эндоваскулярной).
Всем гемодинамически стабильным пациентам с любой степенью травмы печени показана консервативная терапия [49, 73]. Дополненная эндоваскулярной эмболизацией, она оказывается успешной в 50—94% наблюдений [28, 54, 60]. Все авторы отмечают, что чем тяжелее травма печени, тем больше риск неудачи консервативной терапии. Появление или рецидив кровотечения служит показанием к прекращению консервативной терапии и экстренной лапаротомии. Переход от оперативного лечения повреждений печени, основанного на результатах лапароцентеза, к избирательно-консервативному, основанному на данных КТ, способствовал уменьшению летальности с 29,3 до 3,4% [64] и стоимости лечения [31]. B. Gaspar и соавт. [28] считают, что только хирурги, обладающие соответствующим опытом, могут использовать подобную тактику.
Видеолапароскопия — это дополнительное диагностическое мероприятие. Она показана при наличии по данным УЗИ более 500 мл свободной жидкости в брюшной полости. Другими показаниями к лапароскопии, не имеющими прямого отношения к нашей лекции, являются подозрение на разрыв полого органа брюшной полости и травматический панкреатит. Следует подчеркнуть, что противопоказаниями к лапароскопии служат указанные выше гемодинамические нарушения, признаки перитонита, предполагаемый спаечный процесс в брюшной полости [1].
Преимущество лапароскопии состоит в возможности осуществить остановку кровотечения (однако это удается только при разрывах, расположенных на передней и частично на диафрагмальной поверхностях и сопровождающихся паренхиматозным неинтенсивным кровотечением) и выполнить дренирование брюшной полости. В остальных случаях лапароскопия дает только косвенные сведения об остановившемся или продолжающемся кровотечении и не может использоваться для его остановки.
Ангиография при травме печени позволяет установить источник кровотечения и выполнить эндоваскулярный гемостаз [19, 67]. Частота использования ангиографии для диагностики травмы печени уменьшилась с 3,3% в период с 1996 по 2002 г. до 0,8% в период с 2003 до 2010 г., при этом частота эндоваскулярной остановки кровотечения увеличилась с 25 до 100% [63]. Показания к эндоваскулярной эмболизации: 1) компьютерно-томографические признаки продолжающегося кровотечения; 2) сохраняющаяся гипотония после тампонады или пакетирования печени; 3) посттравматические ложные аневризмы печеночной артерии и ее ветвей.
Типичными осложнениями эндоваскулярной эмболизации являются рецидив кровотечения, некроз или абсцесс печени, билиарные свищи, абдоминальные гнойно-септические осложнения [11, 32].
Как уже было сказано, показанием к лапаротомии служит продолжающееся внутрибрюшное кровотечение. Успех операции у пострадавшего с интенсивным внутрибрюшным кровотечением зависит от знаний хирурга, правильности и быстроты принятия решения, четкости выполнения операции. Универсальным доступом в хирургии повреждений живота является верхне-средне-срединная лапаротомия. После ревизии органов брюшной полости принимается решение о расширении разреза. При необходимости проведения оперативного приема на заднедиафрагмальной поверхности печени и недостаточном обзоре срединную лапаротомию дополняют поперечным разрезом вправо от уровня пупка до передней или средней подмышечной линии с коррекцией разреза ранорасширителями (например, Сигала). При повреждении ретрогепатического отдела нижней полой вены и печеночных вен крайне редко требуется продление лапаротомного разреза на правую половину грудной клетки в седьмом или восьмом межреберье и пересечение диафрагмы (доступ Петровского—Почечуева). Этот доступ позволяет выполнить полную сосудистую изоляцию печени или сформировать временный атриокавальный шунт.
Дальнейший ход операции при тяжелой травме печени представлен на схеме (рис. 1). При наличии в брюшной полости большого количества крови, которая не позволяет выполнить полноценную ревизию, ассистент выполняет бимануальную компрессию печени (см. рис 1, блок 1).

После эвакуации крови с помощью аппарата для реинфузии и визуализации гепатодуоденальной связки хирург осуществляет временный гемостаз с помощью приема Прингла (см. рис. 1, блок 2). Он позволяет прекратить приток крови к печени по печеночной артерии и воротной вене, однако гораздо удобнее и надежнее наложить на гепатодуоденальную связку турникет. Для этого изогнутый зажим (типа Федорова) проводится через гепатодуоденальную связку, а затем выводится в отверстие Винслоу. Тесьма захватывается зажимом, после чего зажим извлекается. Оба конца тесьмы протягиваются через короткий отрезок дренажной трубки, которая сдвигается в сторону гепатодуоденальной связки до полного пережатия всех ее элементов и фиксируется к тесьме зажимом Бильрота. Менее удобно для временного гемостаза наложить на гепатодуоденальную связку сосудистый зажим.
Наибольшее время постоянного пережатия гепатодуоденальной связки, по данным литературы, составляет 60 мин [27]. Некоторые авторы считают, что прекращение портального кровотока на время более 40 мин приводит к необратимым изменениям печени и слизистой оболочки кишечника [3].
Следующим этапом необходимо обнаружить кровоточащий сосуд и осуществить прицельный гемостаз. Следует подчеркнуть, что ушить разрыв печени непросто, поскольку затягивание узлов с силой, достаточной для компрессионного гемостаза, нередко приводит к прорезыванию ткани. Для ушивания дефектов печени предложено большое количество швов, с которыми можно ознакомиться в книге Ю.М. Дедерера и Н.П. Крыловой [2]. С помощью таких швов нельзя полностью остановить кровотечение из ветвей печеночной артерии и крупных вен, вследствие продолжающегося кровотечения формируются внутрипеченочные гематомы с последующим их нагноением. Кроме того, швы приводят к ишемии и иногда к некрозу ткани печени. При длине разрыва менее 5—6 см можно накладывать отдельные вертикальные или горизонтальные П-образные швы, при большей длине разрыва предпочтителен непрерывный матрасный шов.
Паренхиматозное кровотечение, которое обычно возникает при травме I—III степени по OIS, лучше остановить с использованием бесшовных способов гемостаза: физических (аргоноплазменная или электрокоагуляция, придавливание тупфером или тампоном, пропитанным горячим изотоническим раствором натрия хлорида) или химических (аппликация гемостатических агентов Surgicel или Tachocomb). Уместно сказать, что подкапсульная гематома (травма II или III степени) обычно возникает вследствие разрыва паренхимы. Всегда существует риск внезапного разрыва капсулы с рецидивом весьма интенсивного внутрибрюшного кровотечения, поэтому капсула печени над гематомой должна быть вскрыта, кровотечение остановлено одним из методов. Целесообразно укрытие декапсулированного участка печени сеткой Surgicel.
Если кровотечение после применения приема Прингла останавливается, это означает, что его источником являются элементы портальной триады (см. рис. 1, блок 3). Мобилизуют соответствующую долю печени путем рассечения треугольной, венечной, круглой и серповидной связок. Для мобилизации правой доли печени необходимо пересечь также печеночно-почечную связку. Поврежденную долю печени выводят в лапаротомную рану или максимально близко к ней и ассистент удерживает ее. Обнаружить кровоточащий сосуд позволяет способ, предложенный вьетнамским хирургом Ton That Tung (finger fracture technique) и поэтому названный И. Литтманном «восточным» [7]. Эта техника состоит в «разделении паренхимы печени ручкой скальпеля или раздавливании паренхимы между I и II пальцами. Ручка скальпеля или палец хирурга наталкивается на крупные сосуды и желчные пути, которые перед пресечением перевязывают внутри паренхимы». Разделение печени проводят по ходу разрыва (см. рис 1, блок 4) без повреждения сегментарных элементов.
Кровотечение из сосудов печени удобно останавливать путем наложения клипс, а при отсутствии клипаппликатора — 8-образных швов нерассасывающейся нитью примерным размером USP 3/0 на атравматической игле (см. рис. 1, блок 5). Паренхиматозное кровотечение останавливают одним из изложенных ранее бесшовных способов.
Обязательный элемент операции при тяжелой закрытой травме печени — удаление нежизнеспособных и свободно лежащих фрагментов, т. е. хирургическая обработка. Ее выполняют тупым путем, раздавливая паренхиму пальцами или зажимом, разделяя ручкой скальпеля (см. рис. 1, блок 6). Паренхиматозные «мостики» перевязывают нерассасывающимися нитями.
Как уже было сказано ранее, свести края разрыва печени швами непросто, а оставленная в печени полость быстро заполняется кровью, желчью с формированием гематомы, биломы или абсцесса. В связи с этим полость в печени следует уменьшить. Для этого выкраивают прядь большого сальника соответствующего размера (см. рис. 1, блок 7) и укладывают ее внутрь разрыва печени. Дистальный конец пряди большого сальника фиксируют к месту разрыва капсулы печени отдельным швом рассасывающейся нитью. Питающим сосудом пряди большого сальника является одна или несколько ветвей правой желудочно-сальниковой артерии [26]. Края разрыва печени сводят или сближают вертикальными П-образными рассасывающимися швами размером USP 0 или 2/0. Лучше использовать атравматические иглы с тупым концом.
Операцию заканчивают дренированием правого поддиафрагмального, подпеченочного пространств и малого таза трубками диаметром не менее 8 мм и послойным ушиванием раны (см. рис. 1, блок 8).
Если прием Прингла не уменьшает интенсивность кровотечения, а разрыв или его часть расположены по задней поверхности органа поблизости от нижней полой вены, то источником кровотечения скорее всего является разрыв ретрогепатического отдела нижней полой вены или печеночных вен (см. рис. 1, блок 9). Для скорейшей остановки кровотечения целесообразно выполнить тугую тампонаду печени (см. рис. 1, блок 10). Этот метод у пострадавших с травмой печени IV—V степени и интенсивным кровотечением применяют чаще всего [42, 61]. Необходимое количество (примерно 10—20) тампонов (в странах Европы и в США используют стерильные полотенца) туго укладывают на диафрагмальную и висцеральную поверхности печени (рис. 2) до момента остановки кровотечения. На переднюю брюшную стенку тампоны не выводят, оставляя их целиком вокруг печени. Следует подчеркнуть, что мобилизация печени путем рассечения ее связок уменьшает эффект тампонады за счет увеличения расстояния между печенью и диафрагмой.

Если кровотечение после тугой тампонады остановилось, то операцию заканчивают дренированием брюшной полости (обычно подпеченочного пространства и малого таза), на кожные края лапаротомного разреза накладывают швы (см. рис. 1, блок 11). Эта концепция этапного лечения тяжелых повреждений, в том числе печени, в англоязычной литературе получила название damage control surgery. Желающим более подробно ознакомиться с damage control surgery рекомендуем статьи J. Asensio, M. Bashir, S. Germanos, M. Walker [14, 16, 29, 71]. Следует подчеркнуть, что тампонаду применяют у пострадавших в крайне тяжелом состоянии с тяжелой травмой печени, при этом летальность остается очень высокой — 30, 54 и 79% при III, IV и V степенях по OIS соответственно [55]. Тяжесть состояния таких пострадавших характеризует объем трансфузионной терапии, включающий более 10 единиц эритроцитной массы, свежезамороженной плазмы и примерно 3—5 единиц тромбоцитной массы за 1-е сутки [15, 37, 75]. Решение о тампонаде печени надо принять как можно раньше, лучше всего сразу после ревизии органов брюшной полости. Тампонада, начатая после возникновения ДВС-синдрома, имеет гораздо меньше шансов на успех. Реже в качестве метода временной остановки кровотечения применяют пакетирование печени [3, 44].
После коррекции ацидоза, гипотермии, коагулопатии, которые осуществляют в реанимационном отделении (см. рис. 1, блок 12), выполняют релапаротомию. Эта операция должна быть окончательной, ее объем соответствует ранее изложенному (см. рис. 1, блоки 5, 6, 7, 8). Альтернативой релапаротомии является перевод пострадавшего для дальнейшего лечения в стационар, располагающий опытом и техническими возможностями лечения тяжелой травмы печени.
Если тугая тампонада печени не привела к остановке кровотечения, то тампоны немедленно удаляют. У оперирующего хирурга остается три варианта. Каждый из них является последним шансом спасти пострадавшего, применение любого из них не гарантирует успех и сопровождается летальностью не менее 50%.
Первый вариант: не снимая турникета с гепатодуоденальной связки, максимально быстро применить прием finger fracture technique и, обнаружив источник кровотечения, остановить его.
Второй вариант: сосудистая изоляция печени [34]. Этот метод технически непрост и для его выполнения требуется до 30 мин. Для этого разрез расширяют (если это не было сделано раньше) до торакофренолапаротомии [10] и выделяют нижнюю полую вену выше и ниже печени. Для выделения нижней полой вены ниже печени необходимо мобилизовать и отвести влево правую половину ободочной кишки. После этого инфраренальный отдел нижней полой вены становится доступным осмотру и оперативному приему (наложение турникета или сосудистого зажима). Пережатие нижней полой вены только ниже печени не приводит к остановке кровотечения из-за интенсивного ретроградного тока крови из правого предсердия. Для выделения супрагепатического отдела нижней полой вены ассистент ротирует правую долю печени вперед и влево [56]. Это позволяет визуализировать нижнюю полую вену и короткие печеночные вены. Брюшину над ними порционно перфорируют диссектором с острыми концами (под визуальным контролем!), бранши диссектора разводят и натянувшуюся над ними брюшину пересекают коагулятором. Короткие печеночные вены перевязывают. Это позволяет выделить нижнюю полую вену на коротком промежутке между перикардом и печенью, а также место впадения в нее правой печеночной вены. Если дефект вены визуализирован, его ушивают непрерывным обвивным швом нитью USP 3/0 или 4/0 нерассасывающейся монофиламентной нитью (см. рис. 1, блок 15).
Если на выделенном участке супрагепатического отдела нижней полой вены повреждений не обнаружено, на него накладывают турникет, осуществляя тем самым полную сосудистую изоляцию печени. К сожалению, пострадавшие в критическом состоянии плохо переносят подобный объем операции [33], при этом летальность приближается к 80%.
Третий вариант — атриокавальное шунтирование (см. рис. 1, блок 14), которое было разработано T. Schrock [66]. Для его выполнения на ушко правого предсердия накладывают кисетный шов, внутри которого ушко отрезают. Торакальный дренаж диаметром 36—40 Fr или интубационную трубку № 8—9 с дополнительными отверстиями диаметром 7—9 мм вводят через отверстие в ушке правого предсердия и продвигают до супраренального отдела нижней полой вены. Кисетный шов затягивают, на выступающую из предсердия часть трубки накладывают зажим. Вокруг нижней полой вены в любом участке выше печени и выше почечных вен завязывают тесемки. Этот прием обеспечивает ток крови из нижней полой вены в правое предсердие вне поврежденного участка сосуда, т. е. венозный возврат к сердцу (рис. 3). Затем продолжают реанимационные мероприятия и после стабилизации состояния пострадавшего осуществляют поиск и ушивание разрыва вены. Количество успешных операций составляет 19—22% [22, 50].

Анатомические резекции [20] и трансплантация печени [43] для лечения пострадавших являются казуистикой.
Частота послеоперационных осложнений и осложнений при консервативном лечении травмы печени одинакова и в большей степени зависит от тяжести травмы органа. Чем тяжелее травма, тем больше вероятность осложнений. Осложнения представлены повторным внутрибрюшным кровотечением [55], внутрипеченочной гематомой, ложными артериальными и венозными аневризмами [46], гемобилией, желчным свищом [39], биломой [68], внутрипеченочным абсцессом [40]
Лечение осложнений травмы печени на современном этапе развития медицины осуществляют с использованием ангиографии с эндоваскулярной эмболизацией или стентированием, пункции и дренирования под контролем УЗИ, лапароскопии, эндоскопического стентирования [69, 70]. Проводить такое лечение лучше в соответствующем стационаре, куда может быть переведен пострадавший после оказания ему квалифицированной медицинской помощи и стабилизации состояния.
Эта лекция была предназначена для студентов и хирургов, редко встречающихся с закрытой травмой, поэтому она посвящена основам диагностики и лечения травмы печени. В ней автор попытался учесть различную техническую оснащенность стационаров, в соответствии с этим предложив различные диагностические подходы, однако независимо от технической оснащенности больницы и опыта хирурга пострадавшему с абдоминальной травмой должна быть оказана помощь, в том числе должен быть осуществлен хирургический гемостаз. В своей книге «Здравый смысл в неотложной абдоминальной хирургии» (которую мы рекомендуем прочесть всем студентам, мечтающим стать хирургом, и тем, кто уже стал им) Моше Шайн пишет: «Дрожь в руках в какой-то степени затрудняет выполнение операции, но дрожь в мозгах делает операцию безнадежной». Если в результате знакомства с лекцией «дрожи в мозгах» станет меньше, то ее автор будет считать свою цель достигнутой.