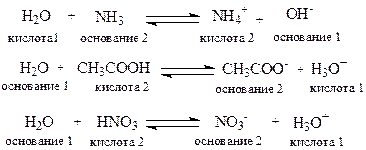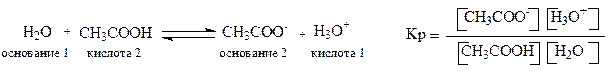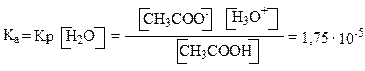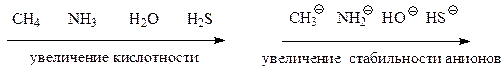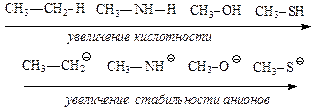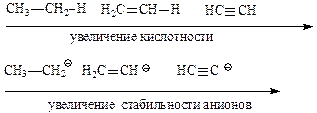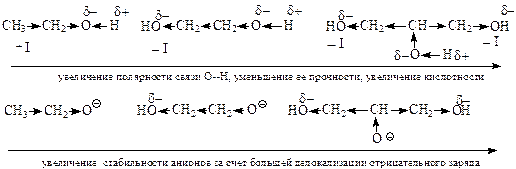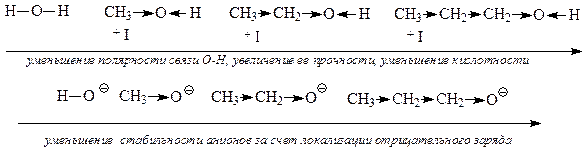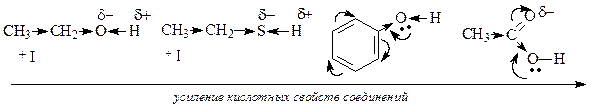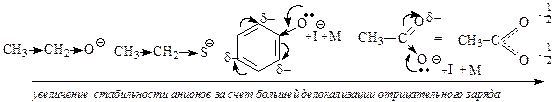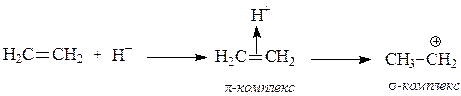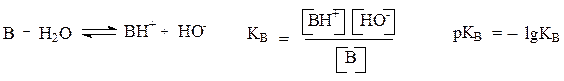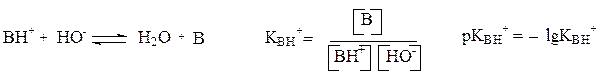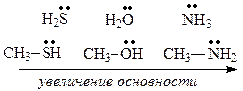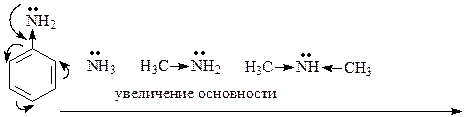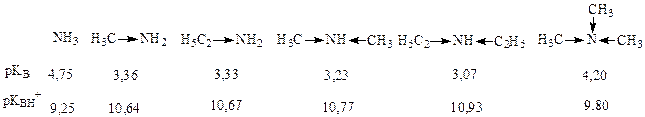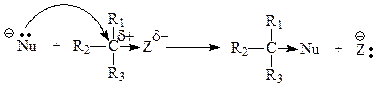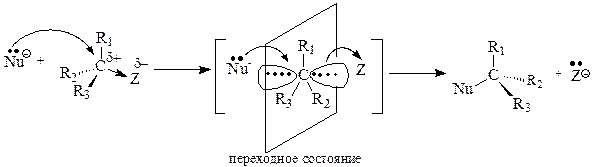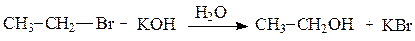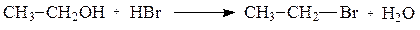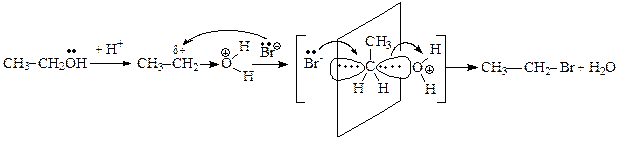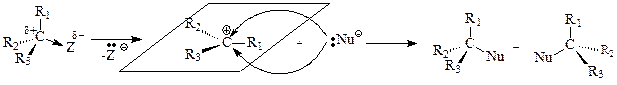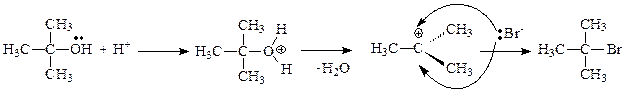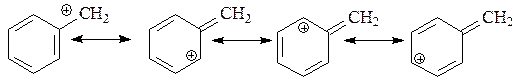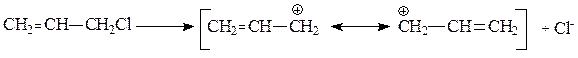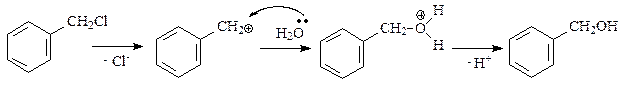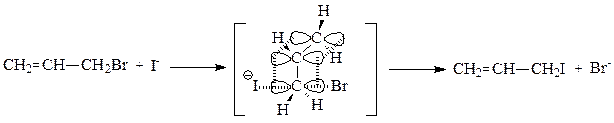чем стабильнее анион тем сильнее сопряженная кислота
Органическая химия
Информативные ответы на все вопросы курса «Органическая химия» в соответствии с Государственным образовательным стандартом.
Оглавление
Приведённый ознакомительный фрагмент книги Органическая химия предоставлен нашим книжным партнёром — компанией ЛитРес.
5. Кислоты Бренстеда
Для характеристики кислотности и основности органических соединений применяют теорию Бренстеда.
Основные положения этой теории.
Кислота — это частица, отдающая протон (донор Н+); основание — это частица, принимающая протон (акцептор Н-).
Кислотность всегда характеризуется в присутствии оснований и наоборот.
А-Н(кислота) +В(основание) — А (сопряженное основание) + В-Н+ (сопряженная кислота).
Кислоты Бренстеда делятся на 4 вида в зависимости от кислотного центра:
2) ОН-кислоты (спирты, фенолы, карболовые кислоты);
3) НЗ-кислоты (амины, амиды);
В этом ряду сверху вниз кислотность уменьшается. Сила кислоты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее кислота. Стабильность аниона зависит от делока-лизации (распределения) «отрицательного» заряда по всей частице (аниону). Чем больше делокализован «отрицптельный» заряд, тем стабильнее анион и сильнее кислота.
Делокализация заряда зависит:
1) от электроотрицательности (ЭО) гетероатома. Чем больше ЭО гетероатома, тем сильнее соответствующая кислота. Например: R-OH и R-NH2.
Спирты более сильные кислоты, чем амины, т. к. ЭО (0) → 30(N);
2) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая кислота. Например: R-SH и R-ОН.
Тиолы более сильные кислоты, чем спирты, т. к. атом S более поляризован, чем атом О;
3) от характера заместителя R (его длины, наличия сопряженной системы, делокализации электронной плотности).
Например: СН3-ОН, СН3-СН2-ОН, СН3-СН2-СН2-ОН. Кислотность меньше, так как увеличивается длина радикала.
При одинаковом кислотном центре сила спиртов, фенолов и карбоновых кислот не одинакова. Фенолы являются более сильными кислотами, чем спирты за счет р, s-сопряжения (+М) группы (-ОН). Связь О—Н более поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FeC13) — качественная реакция на фенолы. Карбоновые кислоты по сравнению со спиртами, содержащими одинаковый R, являются более сильными кислотами, так как связь О—Н значительно поляризована за счет — М-эффекта группы > С = О. Кроме того, карбоксилат-анион более стабилен, чем анион спирта за счет р, s-сопряжения в карбоксильной группе;
4) от введения заместителей в радикал. ЭА-замести-тели увеличивают кислотность, ЭД-заместители уменьшают кислотность;
Лекция № 4



Кислотно-основные свойства органических соединений, ионизация. Роль ионизации в проявлении биологической активности
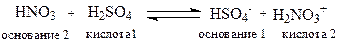
В протолитической теории понятия кислот и оснований относятся лишь к функции, которую выполняет вещество в данной реакции. Одно и то же вещество, в зависимости от реакционного партнера, может выполнять функцию как кислоты, так и основания:
Обычно кислотность определяется по отношению к воде как основанию. Количественная оценка кислотности (силы кислоты) проводится сравнением констант равновесия реакций по переносу протона от кислоты к основанию.
Концентрация воды практически не изменяется, поэтому, умножив правую и левую части этого равенства на [Н2О], получим следующее выражение:
Сравнительный анализ силы кислот (качественная оценка) проводят путем сопоставления устойчивости соответствующих кислотам сопряженных оснований (анионов). Чем стабильнее сопряженный кислоте анион (основание), тем сильнее сопряженная ему кислота. Стабильность анионов зависит от степени делокализации отрицательного заряда – чем в большей степени делокализован отрицательный заряд, тем стабильнее анион, тем сильнее сопряженная кислота.
Степень делокализации отрицательного заряда зависит от следующих факторов:
от природы атома кислотного центра, т.е. от его электроотрицательности и радиуса (поляризуемости);
от характера связанного с ним радикала;
от электронного строения аниона;
4) от влияния растворителя.
Влияние природы атома кислотного центра
Аналогичная картина наблюдается и для соединений, в которых атом кислотного центра связан с одинаковым органическим радикалом:
С-Н кислоты проявляют самые слабые кислотные свойства, хотя алканы, алкены и алкины несколько различаются по кислотности.
Влияние заместителей, связанных с кислотным центром
Электроноакцепторные заместители увеличивают кислотность соединений. Смещая на себя электронную плотность, они способствуют увеличению полярности и уменьшению прочности связи атома кислотного центра с атомом водорода, облегчают отщепление протона. Смещение электронной плотности к электроноакцепторному заместителю приводит к большей делокализации отрицательного заряда в анионе и увеличению его стабильности.
Электронодонорные заместители уменьшают кислотность соединений, так как смещают электронную плотность от себя, что приводит к локализации отрицательного заряда на атоме кислотного центра в анионе и уменьшению его устойчивости, увеличению его энергии, что затрудняет его образование.
Влияние электронного строения анионов
На степень делокализации отрицательного заряда в анионе и его стабильность оказывает сильное влияние наличие сопряженной системы и проявление мезомерного эффекта. Делокализация отрицательного заряда по системе сопряжения приводит к стабилизации аниона, т.е к усилению кислотных свойств молекул.
Молекулы карбоновых кислот и фенола образуют более стабильные анионы и проявляют более сильные кислотные свойства, чем алифатические спирты и тиолы, в которых не проявляется мезомерный эффект.
На проявление кислотных свойств соединения влияние растворителя может быть значительным. Так, например, соляная кислота, являющаяся сильной кислотой в водном растворе, практически не проявляет кислотных свойств в бензольном растворе. Вода, как эффективный ионизирующий растворитель, сольватирует образующиеся ионы, тем самым стабилизирует их. Молекулы бензола, являясь неполярными, не могут вызвать значительной ионизации молекул хлороводорода и не могут стабилизировать за счет сольватации образующиеся ионы.
В протолитической теории кислот и оснований различают два типа оснований – p-основания и n-основания (ониевые основания).
p-Основания – это соединения, которые для образования связи с протоном предоставляют пару электронов p-связи. К ним относятся алкены, диены, ароматические соединения. Они являются очень слабыми основаниями, так как пара электронов не свободна, а образует p-связь, т.е принадлежит обоим атомам. Для образования s-связи с протоном сначала нужно разорвать p-связь, что требует затрат энергии.
n-Основания (ониевые основания) – это молекулы или ионы, которые для образования связи с протоном предоставляют неподеленную пару р-электронов. По природе оснóвного центра различают: аммониевые основания, оксониевые основания и сульфониевые основания.
Аммониевые основания – это соединения, в которых центром основности является атом азота с неподеленной парой р-электронов (амины, амиды, нитрилы, азотсодержащие гетероциклы,имины и др.)
Оксониевые основания – это соединения, в которых центром основности является атом кислорода с неподеленной парой р-электронов (спирты, простые и сложные эфиры, альдегиды, кетоны, карбоновые кислоты и др.)
Сульфониевые основания – это соединения, в которых центром основности является атом серы с неподеленной парой р-электронов (тиоспирты, тиоэфиры и др.).
Cилу основания В в воде можно оценить, рассматривая равновесие:
Константу основности КВ, так же как и константу кислотности Ка, для удобства выражают величиной рКВ, численно равной отрицательному десятичному логарифму константы основности. Чем больше константа основности КВ и чем меньше рКВ, тем сильнее основание.
Сила оснований зависит от: 1) природы атома основного центра – электроотрицательности и поляризуемости (от радиуса атома); 2) от электронных эффектов заместителей, связанных с основным центром; 3) от влияния растворителя.
Влияние природы атома основного центра
С увеличением электроотрицательности атома основного центра сила оснований уменьшается, так как чем больше электроотрицательность, тем сильнее атом удерживает свою неподеленную пару электронов, и таким образом труднее ее предоставляет для образования связи с протоном. Исходя из этого, оксониевые основания слабее аммониевых, содержащих одинаковые заместители у основного центра:
Сульфониевые основания, содержащие одинаковые заместители у основного центра, проявляют еще более слабые основные свойства. Атом серы, хотя и менее электроотрицателен, чем атомы кислорода и азота, имеет больший атомный радиус и характеризуется большей поляризуемостью, поэтому труднее предоставляет неподеленную пару электронов внешнего слоя для образования связи с протоном.
Влияние заместителей, связанных с основным центром
Электронодонорные заместители, смещая электронную плотность к атому основного центра, облегчают присоединение протона, тем самым усиливают основные свойства. Электроноакцепторные заместители, смещая на себя электронную плотность, уменьшают ее на основном центре, чем затрудняют присоединение протона и ослабляют основные свойства:
Поскольку увеличение силы основания связано с возрастанием способности присоединять протон и, следовательно, с увеличением на основном центре частичного отрицательного заряда, можно ожидать повышения основности в ряду аммониевых оснований NH3 + :
Реакционная способность субстрата зависит:
Нуклеофильное замещение может идти по одному из двух механизмов – SN2 или SN1. По механизму бимолекулярного нуклеофильного замещения SN2 реагируют субстраты, содержащие уходящую группу, связанную с первичным атомом углерода.
В качестве субстратов в реакциях, идущих по механизму SN2, могут выступать алкилгалогениды, спирты, тиолы, амины, содержащие первичные углеводородные радикалы.
Общая схема бимолекулярного нуклеофильного замещения SN2 :
Реакции бимолекулярного нуклеофильного замещения представляют собой согласованный процесс, так как образование связи с нуклеофилом и разрыв связи с уходящей группой происходит одновременно, атакующая нуклеофильная частица постепенно вытесняет уходящую группу. При этом часть энергии, необходимая для разрыва связи С-Z, возмещается за счет энергии, выделяющейся при образовании связи С-Nu. Эти реакции являются бимолекулярным процессом, так как в образовании переходного состояния (самая медленная стадия) участвуют обе частицы и скорость реакции зависит от концентрации как нуклеофила, так и субстрата.
В переходном состоянии изменяется тетраэдрическое расположение связей атома углерода, подвергающегося нуклеофильной атаке: три заместителя R1, R2, R3 располагаются в одной плоскости, перпендикулярной плоскости рисунка, а уходящая группа и нуклеофильная частица расположены на одной линии, перпендикулярной этой плоскости. Наличие объемных заместителей R1, R2, R3, связанных с атакуемым атомом углерода, затрудняет нуклеофильную атаку, так как атаке подвергается тыльная сторона связи С-Z.
Увеличение полярности растворителя также снижает скорость реакции. Это объясняется тем, что полярный растворитель стабилизирует нуклеофильную частицу, имеющую отрицательный заряд, лучше, нежели переходное состояние, в котором отрицательный заряд распределен между нуклеофилом и уходящей группой. Это приводит к тому, что реакционная способность нуклеофила уменьшается и увеличивается разность энергий исходного вещества и переходного состояния, что ведет к увеличению энергии активации реакции.
Рассмотрим в качестве примеров реакции гидролиза галогеналканов и реакции превращения спиртов в галогеналканы.
Гидролиз галогеналканов осуществляется действием водных растворов щелочей. В качестве нуклеофильной частицы в этой реакции выступает гидроксид-ион, образующийся при диссоциации щелочи.
Однако превращение спиртов в галогенпроизводные не удается осуществить действием на спирты солями галогеноводородных кислот:
Ион водорода протонирует атом кислорода гидроксильной группы (быстрая стадия), что приводит к возникновению на атоме кислорода полного положительного заряда. Вследствие этого связь С®ОН становится более полярной, а на атоме углерода увеличивается частичный положительный заряд, что делает его более восприимчивым к нуклеофильной атаке.
В качестве субстратов в реакциях, идущих по механизму мономолекулярного нуклеофильного замещения SN1, могут выступать алкилгалогениды, спирты, тиолы, амины, содержащие третичные углеводородные радикалы.
Общая схема мономолекулярного нуклеофильного замещения SN1:
Реакция протекает в три последовательные стадии: 1) протонирование спирта – быстрая стадия; 2) гетеролитический разрыв связи С-О, приводящий к отщеплению воды и образованию карбкатиона – медленная стадия реакции, определяющая скорость реакции в целом; 3) нуклеофильная атака бромид-ионом образовавшегося на предыдущей стадии карбкатиона, в результате которой образуется конечный продукт – быстрая стадия.
Механизм реакции:
На механизм нуклеофильного замещения большое влияние оказывают заместители при электронодефицитном атоме углерода. При изучении реакций гидролиза в ряду галогеналканов
При переходе от бензилхлорида к дифенилхлорметану и трифенилхлорметану эффект стабилизации карбкатиона становится все более отчетливо выраженным и атака по механизму SN1 облегчается еще сильнее, так как возможность делокализации положительного заряда возрастает. Аналогичная стабилизация наблюдается также для аллильных карбкатионов:
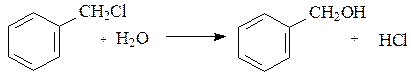
Схема реакции гидролиза бензилхлорида имеет вид:
Реакция протекает в три последовательные стадии:
1) гетеролитический разрыв связи С-Сl, протекающий под действием полярных молекул растворителя – медленная стадия реакции;
2) нуклеофильная атака молекулой воды образующегося карбкатиона с образованием оксониевого катиона – быстрая стадия;
3) отщепление протона от оксониевого катиона с образованием спирта – быстрая стадия.
Рассмотрев оба механизма нуклеофильного замещения, можно сделать некоторые обобщения о влиянии различных факторов на механизм реакции:
Реакция протекает по SN1 механизму в случае тех соединений, которые способны образовывать достаточно стабильные катионы. Триалкилметильные и мезомерно стабилизированные катионы обеспечивают преимущественное протекание реакции мономолекулярного замещения. Увеличение числа алкильных заместителей облегчает мономолекулярное и затрудняет бимолекулярное замещение.
Растворители с высокой диэлектрической проницаемостью (Н2О, НСООН, водноорганические смеси) стабилизируют ионы и поэтому способствуют мономолекулярному замещению, растворители с низкой диэлектрической проницаемостью (диметилформамид), не вызывающие стабилизации ионов, способствуют бимолекулярному замещению.
Кислотность и основность органических соединений.
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Кислотность и основность – важнейшие понятия, определяющие многие фундаментальные физико-химические свойства и биологическую активность органических соединений.
Теории кислот и оснований:
– теория электролитической диссоциации (Аррениус);
– протолитическая теория (Бренстед-Лоури, 1923 г.);
– теория Льюиса (1925 г.).
Протолитическая теории Бренстеда
Кислота – это вещество, способное отдавать протон. Основание – это вещество, способное присоединять протон. Кислота + основание = сопряженная пара
Кислоты
Атом, с которым связан протон, – центр кислотности. Центрами кислотности могут быть атомы C, O, N, S: Соответственно – CH-, OH-, NH- и SH-кислоты.
Основания
Центрами основности являются атомы, имеющие неподеленную пару электронов (n-электроны): N, O, S. Соответственно различаются аммониевые, оксониевые и тиониевые основания (n-основания). Это могут быть нейтральные молекулы или анионы.
Существуют также π-основания – соединения с кратными связями или сопряженной системой π-связей. Они присоединяют протон, образуя сопряженные кислоты – π-комплексы.
Количественная оценка кислотности
Сила кислоты – это степень сдвига вправо следующего равновесия:
Количественная оценка основности
Сила основания – это степень сдвига вправо следующего равновесия:
Из этих соотношений следует, что для сопряженной пары мерой основности основания В может быть кислотность сопряженной кислоты ВН+: рКВ = 14 – рКВН+
Сила основания↑ → КВ↑ → рКВ↓ → рКВН+↑
Качественная оценка кислотности
Сила кислоты определяется устойчивостью сопряженного основания (аниона).
Чем стабильнее анион, тем сильнее кислота.
Устойчивость аниона, в свою очередь, зависит от следующих факторов:
– свойства атома в центре кислотности – его электроотрицательность и поляризуемость
– степень делокализации (-)-заряда в анионе в результате сопряжения;
– действие окружающих заместителей;
– способность аниона к сольватации.
Факторы, определяющие кислотность
1. Свойства атома в центре кислотности
а) электроотрицательность
С увеличением электроотрицательности атома Х полярность связи Х-Н увеличивается, прочность её уменьшается, облегчается отрыв протона. В результате кислотность увеличивается. ЭО↑ → Кислотность↑

Выделяются три типа органических оснований:
Сила основания определяется стабильностью образующегося катиона, а также доступностью
неподеленной пары электронов для присоединения протона. На силу основания влияют те же факторы, что и на силу кислоты, но направление действие их противоположно.
Амины – наиболее сильные основания. Они образуют с кислотами устойчивые соли растворимые в воде. Это свойство аминов широко применяется для их выделения и очистки, а также для получения растворимых лекарственных форм.
Ряд уменьшения основности: R-NH-R > R-O-R > R-S-R
– основность оксониевых оснований уменьшается за счет большей ЭО кислорода;
– тиониевые основания более слабые, чем оксониевые потому, что больший радиус серы увеличивает длину связи S-H в катионе, делает её менее прочной и тем самым снижает устойчивость катиона.
На силу оснований большое влияние оказывают заместители у центра основности:
а) электроноакцепторы
Электроноакцепторы увеличивают (+)-заряд на катионе, уменьшают его устойчивость и, следовательно, уменьшают основность.
б) электронодоноры
Электронодоноры уменьшают (+)-заряд на катионе, увеличивают его устойчивость и, следовательно, увеличивают основность.
Включение неподеленной электронной пары в сопряженную систему понижает её доступность для присоединения протона и снижает основность:
Из-за такого сопряжения основность амидов по сравнению с аминами резко снижена, в водных растворах амиды не протонируются (их основность ниже, чем у воды):
Теория кислот и оснований Льюиса
Кислота – акцептор электронов; Основание – донор электронов
При взаимодействии кислот и оснований образуются донорно-акцепторные комплексы: