чем регулируется деятельность сердечной мышцы сознание гормоны вегетативная нервная система
Нарушения сердечного ритма
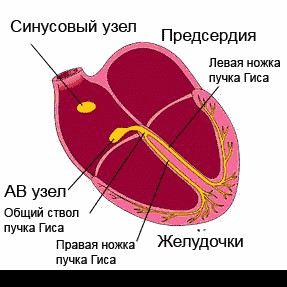
Сердце человека в нормальных условиях бьется ровно и регулярно. Частота сердцебиения в минуту при этом составляет от 60 до 90 сокращений. Данный ритм задается синусовым узлом, который называется также водитель ритма. В нем имеются пейсмекерные клетки, от которых возбуждение передается далее на другие отделы сердца, а именно на атрио-вентрикулярный узел, и на пучок Гиса непосредственно в ткани желудочков.
Данное анатомо-функциональное разделение важно с позиции типа того или иного нарушения, потому что блок для проведения импульсов или ускорение проведения импульсов могут возникнуть на любом из этих участков.
Нарушения ритма сердца и его проводимости носят название аритмий и представляют собой состояния, когда сердечный ритм становится меньше нормы (менее 60 в минуту) или больше нормы (более 90 в минуту). Также аритмией является состояние, когда ритм является нерегулярным (неправильным, или несинусовым), то есть исходит из любого участка проводящей системы, но только не из синусового узла.
Классификация
Все нарушения ритма и проводимости классифицируются следующим образом:
В первом случае, как правило, происходит ускорение сердечного ритма и/или нерегулярное сокращение сердечной мышцы. Во втором же отмечается наличие блокад различной степени с урежением ритма или без него.
В целом к первой группе относятся нарушение образования и проведения импульсов:
Причины аритмии сердца
Причины аритмии (возникновения нарушений ритма сердца) настолько многообразны, что перечислить абсолютно все является очень трудной задачей. Тем не менее, во многих случаях именно от причины аритмии зависит ее безопасность для жизни больного, дальнейшая тактика лечения.
Предложено множество различных классификаций причин аритмии, однако ни одна из них в настоящее время не является общепринятой. Наиболее приемлемой для пациента мы считаем следующую классификацию. Она основывается на признаке наличия или отсутствия у больного первичного заболевания сердца. Если имеется заболевание сердца, аритмию называют органической, а если заболевания сердца нет — неорганической. Неорганические аритмии принято также называть функциональными.
Органические аритмии
К органическим аритмиям относятся:
Функциональные аритмии
Это также достаточно большая группа, включающая:
Одинаково ли проявляются нарушения ритма сердца?
Все нарушения ритма и проводимости клинически проявляют себя по разному у разных пациентов. Часть больных никаких симптомов не ощущает и узнает о патологии только после планового проведения ЭКГ. Эта часть больных незначительна, так как в большинстве случаев пациенты отмечают явную симптоматику.
Так, для нарушений ритма, сопровождающихся учащенным сердцебиением (от 100 до 200 ударов в мин), особенно для пароксизмальных форм, характерно резкое внезапное начало и перебои в сердце, нехватка воздуха, болевой синдром в области грудины.
Некоторые нарушения проводимости, например пучковые блокады, ничем не проявляются и распознаются только на ЭКГ. Синоатриальная и атрио-вентрикулярная блокады первой степени протекают с незначительным урежением пульса (50-55 в мин), из-за чего клинически могут проявляться лишь незначительной слабостью и повышенной утомляемостью.
Блокады 2 и 3 степени проявляются выраженной брадикардией (меньше 30-40 в мин) и характеризуются кратковременными приступами потери сознания.
Кроме этого, любое из перечисленных состояний может сопровождаться общим тяжелым состоянием с холодным потом, с интенсивными болями в левой половине грудной клетки, снижением артериального давления, общей слабостью и с потерей сознания. Эти симптомы обусловлены нарушением сердечной гемодинамики и требуют пристального внимания со стороны врача.
Разновидности аритмий
Большинство людей под аритмией подразумевает беспорядочные сокращения сердечной мышцы («сердце бьется, как захочет»). Однако это не совсем так. Врач этот термин использует при любом нарушении сердечной деятельности (урежение или учащение пульса), поэтому виды аритмий можно представить следующим образом:
По частоте сердечного ритма различают 3 формы мерцательной аритмии:
На ЭКГ при МА зубец Р не регистрируется, потому что нет возбуждения предсердий, а определяются только предсердные волны f (частота 350-700 в минуту), которые отличаются нерегулярностью, различием формы и амплитуды, что придает электрокардиограмме своеобразный вид.
Причиной МА могут быть:
Частота встречаемости трепетания предсердий (ТП) в 20-30 раз ниже, чем МА. Для него также характерны сокращения отдельных волокон, но меньшая частота предсердных волн (280-300 в минуту). На ЭКГ предсердные волны имеют большую амплитуду, чем при МА.
Интересно, что на одной ЭКГ можно видеть переход мерцания в трепетание и наоборот.
Причины возникновения трепетания предсердий аналогичны причинам формирования мерцания.
Симптомы мерцания и трепетания часто отсутствуют вообще, но иногда отмечаются некоторые клинические проявления, вызванные беспорядочной деятельностью сердца или симптомы основного заболевания, В общем, яркой клинической картины такая патология не дает.
Синдром слабости синусового узла
Эта патология возраст не выбирает, однако предпочитает определенные условия:
Заподозрить синдром слабости синусового узла можно по характерным для него признакам:
Последствием синдрома дисфункции синусового узла является внезапное возникновение приступа Адамса-Морганьи-Стокса и асистолия (остановка сердечной деятельности).
Медикаментозное лечение этого синдрома сводится к применению атропина, изадрина, препаратов белладонны. Однако, учитывая, что эффект от консервативного лечения, как правило, небольшой, больным показана имплантация постоянного кардиостимулятора.
Атриовентрикулярная (АВ) блокада — нарушение проведения возбуждения в желудочки из предсердий, с задержкой или прекращением проведения импульса. Она зачастую является спутницей воспалительных и дегенеративных процессов, происходящих в сердечной мышце, инфаркта миокарда или кардиосклероза. Повышенный тонус блуждающего нерва тоже играет определенную роль в формировании атриовентрикулярной блокады.
Атриовентрикулярная блокада, являясь последствием органических поражений сердца, сама дает еще худшие осложнения, в результате которых значительно возрастает опасность летального исхода. Если атриовентрикулярная блокада 1 ст. лечится путем воздействия на основное заболевание, то АВ блокада может переходить в полную, что нарушает кровоснабжение жизненно важных органов, которое приводит к развитию сердечной недостаточности. А это уже плохое последствие, поэтому лечение откладывать нельзя, больного госпитализируют и назначают препараты, стимулирующие сердечную деятельность в инъекционных растворах с постоянным наблюдением за состоянием пациента. Если брадикардия резко выраженная, отмечается тяжелая сердечная недостаточность, больному в экстренном порядке имплантируют искусственный водитель ритма.
Молекулярная биология регуляции артериального давления и фармакологические мишени управления гемодинамикой.
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Молекулярные механизмы болезней и молекулярно-биологические исследования |
| Книга: | Молекулярная биология регуляции артериального давления и фармакологические мишени управления гемодинамикой. |
Описание
Оглавление
1. Предисловие
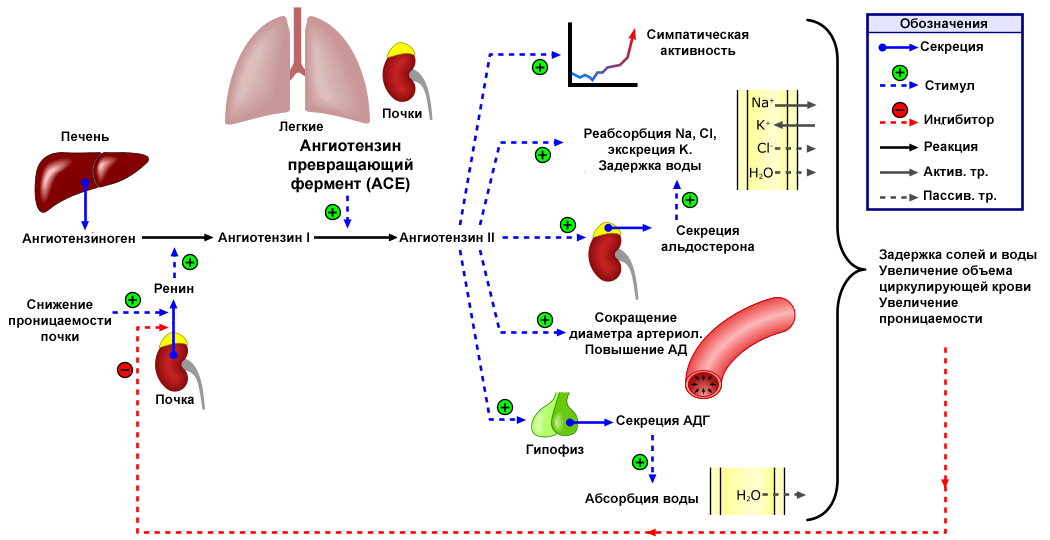
В регуляции артериального давления у человека участвует ренин-ангиотензиновая система (РАС). Работа РАС тесно связана с электролитами, они поддерживают гомеостаз, что необходимо для регуляции сердечной функции, баланса жидкости и многих других процессов. Один из компонентов РАС-системы – гормон ангиотензин II, который вызывает сужение сосудов, повышение артериального давления и является основным регулятором синтеза альдостерона, образующегося в клубочковой зоне коры надпочечников, единственного поступающего в кровь минералокортикоида человека. Конечным результатом такого действия является увеличение объема циркулирующей крови и повышение системного артериального давления.
2. Введение в регуляцию гемодинамики
Регуляция кровяного давления в норме
В соответствии с законами гидравлики АД прямо пропорционально произведению кровотока (сер дечный выброс, СВ) и сопротивления при прохождении крови через прекапиллярные артериолы (периферическое сосудистое сопротивление, или общее периферическое сопротивление — ОПС):
Физиологически как у здорового, так и больного человека АД поддерживается путем регуляции CB и ОПС в трех анатомических областях:
Рис. 1. Анатомические области, участвующие в регуляции кровяного давления
Четвертая анатомическая контрольная область — почки — вносит весомый вклад в поддержание АД, регулируя объем внутрисосудистой жидкости. Барорефлексы, реализуемые через симпатические нервы, совместно с гуморальными механизмами, включая ренин-ангиотензин-альдостероновую систему, координируют функции этих четырех контролирующих зон в под держании нормального АД. АД у больного с гипертензией регулируется теми же механизмами, что и у здорового человека с нормальными значениями АД. Регуляция АД при гипертензии отличается от нормы тем, что барорецепторы и почечный контроль давления, сопряженный с объемом крови, имеют “установочную точку” регуляции на более высоком уровне АД. Все антигипертензивные средства воздействуют на эти нормальные механизмы.
А. Постуральный барорефлекс (рис. 2). Барорефлексы участвуют в быстрой сиюминутной регуляции АД, например при переходе из горизонтального в вертикальное положение. Центральные симпатические нейроны, берущие начало в вазомоторной зоне продолговатого мозга, тонически активны. Каротидные барорецепторы стимулируются при растяжении стенки сосудов, вызванном давлением изнутри (АД). Активация барорецепторов тормозит центральные симпатические импульсы. Напротив, уменьшение растяжения ведет к снижению барорецепторной активности.
Рис. 2. Рефлекторная дуга барорефлекса
Таким образом, при переходе в вертикальное положение давление на барорецепторы снижается вследствие депонирования крови в венах ниже уровня сердца и симпатическая активность растормаживается. Рефлекторно возрастают периферическое сосудистое сопротивление (сокращение артериол) и сердечный выброс (прямая стимуляция сердца и сокращение емкостных сосудов, что ведет к увеличению венозного возврата к сердцу), и в результате восстанавливается нормальное АД. Такой же барорефлекс срабатывает в ответ на любое снижение АД, в том числе на первичное понижение периферического сосудистого сопротивления (например, вызванного сосудорасширяющим веществом) или уменьшение внутрисосудистого объема (например, из-за кровопотери или потери солей и воды через почки).
2.1. Рефлекторная (быстрая) регуляция кровообращения
В первую очередь связана с постуральным барорефлексом, который перераспределяет кровоток при каждом изменении положения тела. Он реализуется в результате взаимодействия симпатической и парасимпатической нервных систем, степень активности которых регулирует сосудодвигательный центр, расположенный на дне 4 желудочка.
2.2. Вегетативная нервная система
Вегетати́вная не́рвная систе́ма (от лат. vegetatio — возбуждение, от лат. vegetativus — растительный), ВНС, автономная нервная система, ганглионарная нервная система (от лат. ganglion — нервный узел), висцеральная нервная система (от лат. viscera — внутренности), органная нервная система, чревная нервная система, systema nervosum autonomicum (PNA) — часть нервной системы организма, комплекс центральных и периферических клеточных структур, регулирующих функциональный уровень организма, необходимый для адекватной реакции всех его систем.
Вегетативная нервная система — отдел нервной системы, регулирующий деятельность внутренних органов, желез внутренней и внешней секреции, кровеносных и лимфатических сосудов. Играет ведущую роль в поддержании постоянства внутренней среды организма и в приспособительных реакциях всех позвоночных.
Анатомически и функционально вегетативная нервная система подразделяется на симпатическую, парасимпатическую и метасимпатическую. Симпатические и парасимпатические центры находятся под контролем коры больших полушарий, гипоталамических центров и центров продолговатого мозга.
Рис.3. Вегетативная нервная система.
В симпатическом и парасимпатическом отделах имеются центральная и периферическая части. Центральную часть образуют тела нейронов, лежащих в спинном и головном мозге. Эти скопления нервных клеток получили название вегетативных ядер. Отходящие от ядер волокна, вегетативные ганглии, лежащие за пределами центральной нервной системы, и нервные сплетения в стенках внутренних органов образуют периферическую часть вегетативной нервной системы.
Симпатические ядра расположены в спинном мозге. Отходящие от него нервные волокна заканчиваются за пределами спинного мозга в симпатических узлах, от которых берут начало нервные волокна. Эти волокна подходят ко всем органам.
Парасимпатические ядра лежат в среднем и продолговатом мозге и в крестцовой части спинного мозга. Нервные волокна от ядер продолговатого мозга входят в состав блуждающих нервов. От ядер крестцовой части нервные волокна идут к кишечнику, органам выделения.
Метасимпатическая нервная система представлена нервными сплетениями и мелкими ганглиями в стенках пищеварительного тракта, мочевого пузыря, сердца и некоторых других органов.
Деятельность вегетативной нервной системы не зависит от воли человека. Это означает, что в обычных условиях человек не может волевым усилием заставить сердце биться реже или мышцы желудка — не сокращаться. Однако достичь сознательного влияния на многие параметры, контролируемые ВНС, можно с помощью специальных методов тренировки — например, с использованием методов биологической обратной связи.
Симпатическая нервная система усиливает обмен веществ, повышает возбуждаемость большинства тканей, мобилизует силы организма на активную деятельность. Парасимпатическая система способствует восстановлению израсходованных запасов энергии, регулирует работу организма во время сна.
Под контролем автономной системы находятся органы кровообращения, дыхания, пищеварения, выделения, размножения, а также обмен веществ и рост. Фактически эфферентный отдел ВНС осуществляет нервную регуляцию функций всех органов и тканей, кроме скелетных мышц, которыми управляет соматическая нервная система.
В отличие от соматической нервной системы, двигательный эффекторный нейрон в автономной нервной системе находится на периферии, и спинной мозг лишь косвенно управляет его импульсами.
Выделение автономной (вегетативной) нервной системы обусловлено некоторыми особенностями её строения. К этим особенностям относятся следующие:
Волокна автономной нервной системы выходят не сегментарно, как в соматической нервной системе, а из трёх отстоящих друг от друга ограниченных участков мозга: черепного, грудинопоясничного и крестцового.
Автономную нервную систему разделяют на симпатическую, парасимпатическую и метасимпатическую части. В симпатической части отростки спинномозговых нейронов короче, ганглионарные длиннее. В парасимпатической системе, наоборот, отростки спинномозговых клеток длиннее, ганглионарных короче. Симпатические волокна иннервируют все без исключения органы, в то время как область иннервации парасимпатических волокон более ограничена.
Автономная (вегетативная) нервная система подразделяется по топографическому признаку делятся на центральный и периферический отделы.
Центральный отдел
Периферический отдел
Симпатический, парасимпатический и метасимпатический отделы
На основании топографии вегетативных ядер и узлов, различий в длине аксонов первого и второго нейронов эфферентного пути, а также особенностей функции вегетативная нервная система подразделяется на симпатическую, парасимпатическую и метасимпатическую.
Расположение ганглиев и строение проводящих путей
Нейроны ядер центрального отдела вегетативной нервной системы — первые эфферентные нейроны на пути от ЦНС (спинной и головной мозг) к иннервируемому органу. Нервные волокна, образованные отростками этих нейронов, носят название предузловых (преганглионарных) волокон, так как они идут до узлов периферической части вегетативной нервной системы и заканчиваются синапсами на клетках этих узлов. Преганглионарные волокна имеют миелиновую оболочку, благодаря чему отличаются беловатым цветом. Они выходят из мозга в составе корешков соответствующих черепных нервов и передних корешков спинномозговых нервов.
Вегетативные узлы (ганглии): входят в состав симпатических стволов (есть у большинства позвоночных, кроме круглоротых и хрящевых рыб), крупных вегетативных сплетений брюшной полости и таза, располагаются в области головы и в толще или возле органов пищеварительной и дыхательной систем, а также мочеполового аппарата, которые иннервируются вегетативной нервной системой. Узлы периферической части вегетативной нервной системы содержат тела вторых (эффекторных) нейронов, лежащих на пути к иннервируемым органам. Отростки этих вторых нейронов эфферентного пути, несущих нервный импульс из вегетативных узлов к рабочим органам (гладкая мускулатура, железы, ткани), являются послеузелковыми (постганглионарными) нервными волокнами. Из-за отсутствия миелиновой оболочки они имеют серый цвет. Постганглионарные волокна автономной нервной системы в большинстве своем тонкие (чаще всего их диаметр не превышает 7 мкм) и не имеют миелиновой оболочки. Поэтому возбуждение по ним распространяется медленно, а нервы автономной нервной системы характеризуются бо́льшим рефрактерным периодом и большей хронаксией.
Рефлекторная дуга
Строение рефлекторных дуг вегетативного отдела отличается от строения рефлекторных дуг соматической части нервной системы. В рефлекторной дуге вегетативной части нервной системы эфферентное звено состоит не из одного нейрона, а из двух, один из которых находится вне ЦНС. В целом простая вегетативная рефлекторная дуга представлена тремя нейронами.
Первое звено рефлекторной дуги — это чувствительный нейрон, тело которого располагается в спинномозговых узлах и в чувствительных узлах черепных нервов. Периферический отросток такого нейрона, имеющий чувствительное окончание — рецептор, берёт начало в органах и тканях. Центральный отросток в составе задних корешков спинномозговых нервов или чувствительных корешков черепных нервов направляется к соответствующим ядрам в спинной или головной мозг.
Второе звено рефлекторной дуги является эфферентным, поскольку несёт импульсы из спинного или головного мозга к рабочему органу. Этот эфферентный путь вегетативной рефлекторной дуги представлен двумя нейронами. Первый из этих нейронов, второй по счёту в простой вегетативной рефлекторной дуге, располагается в вегетативных ядрах ЦНС. Его можно называть вставочным, так как он находится между чувствительным (афферентным) звеном рефлекторной дуги и вторым (эфферентным) нейроном эфферентного пути.
Физиология
Общее значение вегетативной регуляции
Вегетативная нервная система приспосабливает работу внутренних органов к изменениям окружающей среды. ВНС обеспечивает гомеостаз (постоянство внутренней среды организма). ВНС также участвует во многих поведенческих актах, осуществляемых под управлением головного мозга, влияя не только на физическую, но и на психическую деятельность человека.
Роль симпатического и парасимпатического отделов
Симпатическая нервная система активируется при стрессовых реакциях. Для неё характерно генерализованное влияние, при этом симпатические волокна иннервируют подавляющее большинство органов.
Известно, что парасимпатическая стимуляция одних органов оказывает тормозное действие, а других — возбуждающее действие. В большинстве случаев действие парасимпатической и симпатической систем противоположно.
2.3. Нейромедиаторы и клеточные рецепторы
Симпатический и парасимпатический отделы оказывают различное, в ряде случаев противонаправленное влияние на различные органы и ткани, а также перекрёстно влияют друг на друга. Различное воздействие этих отделов на одни и те же клетки связано со спецификой выделяемых ими нейромедиаторов и со спецификой рецепторов, имеющихся на пресинаптических и постсинаптических мембранах нейронов автономной системы и их клеток-мишеней (Рис.).
Преганглионарные нейроны обоих отделов автономной системы в качестве основного нейромедиатора выделяют ацетилхолин, который действует на никотиновые рецепторы ацетилхолина на постсинаптической мембране постганглионарных (эффекторных) нейронов. Постганглионарные нейроны симпатического отдела, как правило, выделяют в качестве медиатора норадреналин, который действует на адренорецепторы клеток-мишеней. На клетках-мишенях симпатических нейронов бета-1 и альфа-1 адренорецепторы в основном сосредоточены на постсинаптических мембранах (это означает, что in vivo на них действует в основном норадреналин), а аль-2 и бета-2 рецепторы — на внесинаптических участках мембраны (на них в основном действует адреналин крови). Лишь некоторые постганглионарные нейроны симпатического отдела (например, действующие на потовые железы) выделяют ацетилхолин.
Постганглионарные нейроны парасимпатического отдела выделяют ацетилхолин, который действует на мускариновые рецепторы клеток-мишеней.
При действии норадреналина и адреналина на бета-2 адренорецепторы выделение норадреналина обычно усиливается. Этот эффект наблюдается при обычном взаимодействии с G s-белком, при котором растёт внутриклеточная концентрация цАМФ. Бета-два рецепторы более чувствительны к адреналину. Поскольку под действием норадреналина симпатических нервов из мозгового слоя надпочечников выделяется адреналин, возникает петля положительной обратной связи.
Однако в некоторых случаях активация бета-2 рецепторов может блокировать выделение норадреналина. Показано, что это может быть следствием взаимодействия бета-2 рецепторов с G i/o белками и связывания (секвестирования) ими G s-белков, которое, в свою очередь, предотвращает взаимодействие G s-белков с другими рецепторами [1].
При действии ацетилхолина на мускариновые рецепторы симпатических нейронов выделение норадреналина в их синапсах блокируется, а при действии на никотиновые рецепторы — стимулируется. Поскольку на пресинаптических мембранах симпатических нейронов преобладают мускариновые рецепторы, обычно активация парасимпатических нервов снижает уровень выделения норадреналина из симпатических нервов.
На пресинаптических мембранах постганглионарных нейронов парасимпатического отдела преобладают альфа-2 адренорецепторы. При действии на них норадреналина выделение ацетилхолина блокируется. Таким образом, симпатические и парасимпатические нервы взаимно ингибируют друг друга.
2.4. Регуляция тонуса гладких мышц сосудов
Схема. Биохимические механизмы сокращения и расслабления гладкомышечного миоцита.
Модификация: Cunningham F., Leveno K., Bloom S., Hauth J., Rouse D., Spong C., Eds. Williams Obstetrics. 23rd ed., McGraw-Hill Professional, 2009, 1404 p., см.: Физиология человека: Литература. Иллюстрации.

2.5. Ненорадренергические и нехолинергические (NANC) вещества в регуляции сосудов
Кроме классических нейротрансмиттеров вегетативной нервной системы ацетилхолина и норадреналина, в литературе описаны многочисленные биологически активные вещества различного строения, модулирующие процессы передачи сигнала. К ним следует отнести серотонин (5-НТ), АТФ, кальцитонин ген связанный пептид (CGRP), допамин, ГАМК, Гонадотропин релизинг гормон (GnRH), нейропептид Y (NPY), вещество Р, вазоактивный кишечный пептид (VIP). Основные сведения о них собраны в таблице
Ганглии вегетативной нервной системы
Некоторые симпатические нервы (например, почки)
Ганглии вегетативной нервной системы
Усиливают вазоконстрикторное действие норадреналина, ингибитор высвобождения норадреналина
NANC иннервация гладких мышц дыхательных путей
парасимпатические ганглии в сфинктерах, желчном пузыре и тонкой кишке
расслабление кишечной гладкой мышцы и сфинктеров
3. Гуморальная регуляция тонуса гладких мышц сосудов и ОЦК
3.1. Ренин, ангиотензин, альдостероновая система (РААС или РАС)
Компоненты системы
3.2. Продукция и секреция ренина
Контроль секреции ренина
Активная секреция ренина регулируется четырьмя независимыми факторами:
Секрецию ренина активирует снижение перфузионного давления или уровня NaCl и повышение симпатической активности. Ренин также синтезируется и в других тканях, включая мозг, надпочечник, яичники, жировая ткань, сердце и сосудах.
Контроль секреции ренина — определяющий фактор активности РААС.
3.3. Ангиотензиноген, ангиотензины 1,2,3,4 и т.д.
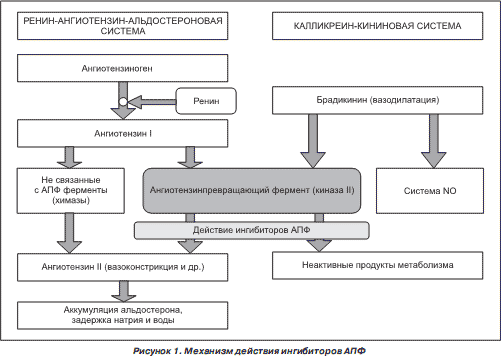
Ренин регулирует начальный, ограничивающий скорость, этап РААС путём отщепления N-концевого сегмента ангиотензиногена для формирования биологически инертного декапептида ангиотензина 1 или Ang-(1-10). Первичный источник ангиотензиногена — печень. Долговременный подъём уровня ангиотензиногена в крови, который происходит во время беременности, при синдроме Иценко-Кушинга или при лечении глюкокортикоидами, может вызвать гипертензию, хотя и существуют данные о том, что хроническое повышение концентрации ангиотензина в плазме частично компенсируется снижением секреции ренина. Неактивный декапептид Ang 1 гидролизуется ангиотензинпревращающим ферментом (АПФ), который отщепляет С-концевой дипептид и, таким образом, формируется октапептид Ang 2 [Ang-(1-8)], биологически активный, мощный вазоконстриктор. АПФ представляет собой экзопептидазу и секретируется главным образом лёгочным и почечным эндотелием, нейроэпителиальными клетками. Ферментативная активность АПФ заключается в повышении вазоконстрикции и снижении вазодилятации.
Хотя Ang2 наиболее биологически активный продукт РААС, существуют данные, что другие метаболиты агиотензинов 1 и 2 могу также могут иметь значительную активность. Ангиотензин 3 и 4 (Ang 3 & Ang 4) формируются путём отщепления аминокислот с N-конца от Ангиотензина 2 вследствие действия аминопептидаз А и N. Ang 3 и 4 наиболее часто вырабатываются в тканях с высоким содержанием этих ферментов, например, в мозге и почках. Ang 3 [Ang-(2-8)], гептапептид образующий в результате отщепления аминокислоты с N-конца, наиболее часто он встречается в центральной нервной системе, где Ang III играет важную роль в поддержании кров давления. Ang IV [Ang-(3-8)] гексапептид является результатом дальнейшего ферментативного расщепления AngIII. Предполагается, что Ang 2 и 4 работают кооперативно. В качестве примера можно привести повышение кровяного давления в мозгу, вызываемое действием этих ангиотензинов на AT1-рецептор. Причём этот гемодинамический эффект Ang 4 требует наличия как Ang2 так и самого AT1- рецептора. Пептиды, получаемые отщеплением аминокислот с С-конца, могут также иметь биологическую активность. Например, Ang-(1-7), гептапептидный фрагмент ангиотензина 2, может образовываться как из Ang2 так и из Ang1 действием ряда эндопептидаз или действием карбоксипептидаз (например, гомологом АПФ, названным АПФ2) конкретно на Ang2. В отличие от АПФ, АПФ2 не может участвовать в реакции превращения Ang1 в Ang2 и его активность не подавляется ингибиторами ACE (ACEIs). Ang-(1-7) реализующий свои функции через определённые рецепторы, впервые был описан как вазодилататор и как натуральный ингибитор ACEI. Ему также приписываются и кардиопротекторные свойства. АПФ2 может также отщеплять одну аминокислоту с С-конца, результатом такого действия является Ang-(1-9), пептид с неизвестными функциями.
3.4. Реакции, катализируемые АПФ
Превращение неактивного ангиотензина I (представляет собой декапептид – последовательность из 10 аминокислот Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu) в активный октапептид ангиотензин II (путем удаления 2 аминокислот-His-Leu) контролирует ангиотензинпревращающий фермент (АПФ) – циркулирующий во внеклеточном пространстве белок (карбоксипептидаза). Вторая важная функция АПФ – деактивация брадикинина.
Ген ACE порождает два изофермента АПФ — соматический, обнаруживаемый во многих органах и тканях, и герминальный, присутствующий только в сперме.
АПФ типичный секреторный фермент. Кроме регуляции кровяного давления, АПФ участвует в различных процессах, происходящих в организме. Его синтезируют клетки многих тканей, таких как васкулярные эндотелиальные клетки, почечные эпителиальные клетки, тестикулярные клетки Лейдига и т. д.
3.5. Уровень АПФ в крови и особенности генетики человека
В норме у разных людей уровень АПФ в плазме крови может различаться до 5 раз. У конкретного же человека уровень АПФ достаточно стабилен. Такие колебания уровня АПФ между людьми вызваны полиморфизмом гена АСЕ. В 16-м интроне гена выявлен инсерционно-делеционный (I/D) полиморфизм, заключающийся во вставке (инсерции, I) или потере (делеции, D) Alu-повтора, размером в 289 пар нуклеотидов. Делеция Alu-повтора приводит к повышению экспрессии гена ACE и увеличению концентрации АПФ в крови, лимфе и тканях, что является фактором, повышающим риск развития сердечно-сосудистых заболеваний (инфаркта миокарда, гипертрофии левого желудочка, ишемической болезни сердца), болезни почек, атеросклероза, болезни Альцгеймера.
У лиц, гомозиготных по аллелю D (генотип D/D), уровень АПФ повышен в 2 раза по сравнению с I/I генотипом. Ассоциация D/D-генотипа с гипертрофией левого желудочка сильнее у мужчин, чем у женщин, таким образом, инсерционно-делеционный полиморфизм может выступать как маркер риска развития гипертрофии левого желудочка у мужчин среднего возраста.
Выявлена ассоциация полиморфизма с возрастной макулярной дегенерацией (ВМД) – основной причиной потери зрения в пожилом возрасте. Генотип I/I встречается в 4,5 раза чаще у здоровых людей, чем у пациентов, страдающих ВМД, и, по-видимому, защищает от ВМД.
Ассоциации полиморфизма АСЕ с уровнем систолического и диастолического кровяного давления не выявлено, кроме случаев злокачественной формы гипертонической болезни (быстро прогрессирующая и тяжело протекающая, со значительным повреждением сосудов почек и сетчатки), при которой генотип D/D встречается чаще.
Также D-аллель связан с риском развития нефропатии у больных сахарным диабетом.
Аллель I ассоциирован с повышенной устойчивостью организма к физическим нагрузкам. Низкая минеральная плотность костной ткани и мышечная слабость являются основными факторами риска переломов костей у женщин при остеопорозе в постменопаузе. Выявлено, что наличие в генотипе женщины аллеля I положительно влияет на эффективность тренировки мышц (у пациенток с генотипом I/I она оказалась в 2 раза выше, чем у женщин с генотипом D/D) в ответ на физические нагрузки, на фоне гормональной терапии.
Исследования также показывают, что у высококлассных спортсменов-стайеров увеличена частота аллеля I, ассоциированная с выносливостью.
3.6. АПФ как мишень фармакологического воздействия
В 1991 году японские ученые создали первый ингибитор АПФ на молочной основе, в виде ферментированного молочного напитка, с использованием конкретных культур, чтобы освободить трипептид изолейцин-пролин-пролина (IPP) из молочного белка. Валин-пролин-пролин (VPP) также выделяется в этом процессе-другое молоко трипептиде с очень схожей химической структурой в IPP. Вместе эти пептиды теперь часто называют lactotripeptides. В 1996 году первое исследование человеческого подтвердили артериальное давление эффект снижения IPP в ферментированного молока. [57] Хотя в два раза количество VPP необходимо, чтобы достигнуть того же самого АСЕ-ингибирующей активности, как первоначально обнаружена IPP, VPP также предполагается, чтобы добавить к общему эффекту снижения кровяного давления. [58] С момента открытия первых lactotripeptides, более 20 клинических испытаний человека были проведены в разных странах
3.7. Классификация ингибиторов АПФ
Классификация ингибиторов АПФ
Препараты, содержащие сульфгидрильные группы: каптоприл, зофеноприл.
Дикарбоксилат-содержащие препараты: эналаприл, рамиприл, хинаприл, периндоприл, лизиноприл, беназеприл.
Фосфонат-содержащие препараты: фозиноприл.
Природные ингибиторы АПФ.
3.8. Функциональная активность ангиотензина II
Сердечно-сосудистая система
Ангиотензин II — сильный вазоконстриктор прямого действия. Он сужает артерии и вены, что приводит к повышению давления. Сосудосуживающая активность ангиотензина II определяется его взаимодействием с AT1 рецептором. Лиганд-рецепторный комплекс активирует НАДФH-оксидазу, образующую супероксид, который в свою очередь взаимодействует с вазорелаксирующим фактором оксидом азота NO и инактивирует его. Кроме этого, он обладает протромботическим эффектом, регулируя адгезию и агрегацию тромбоцитов и синтез ингибиторов PAI-1 и PAI-2. К отсроченным эффектам АТII гипертрофию мышечного слоя сосудов и гипертрофию левого желудочка миокарда.
Нервная система
Ангиотензин вызывает чувство жажды. Он повышает секрецию антидиуретического гормона в нейросекреторных клетках гипоталамуса и секрецию АКТГ в передней доле гипофиза, а также потенциирует высвобождение норадреналина за счёт прямого действия на постганглионарные симпатические нервные волокна.
Под действием ангиотензина кора надпочечников выделяет гормон альдостерон, вызывающий задержку натрия и потерю калия.
Почки
Ангиотензин обладает прямым эффектом на проксимальные канальцы, что увеличивает задержку натрия. В целом ангиотензин увеличивает скорость гломерулярной фильтрации за счёт сужения эфферентных почечных артериол и повышения давления в почках.
3.9. Ангиотензиновые рецепторы
Рецептор АТ1 является наиболее изученным.
Локализация. АТ1 подтип находится в сердце, кровеносные сосуды, почки, надпочечники коры головного мозга, легкое и головной мозг и опосредует сосудосуживающие эффекты. Молекулярный механизм. Активированный рецептор освобождает Gq/11 и Gi/о и тем самым активирует фосфолипазу С и повышает концентрации цитозольного Ca2+, который, в свою очередь, запускает клеточные ответы, такие как стимуляция протеинкиназы С. Активированный рецептор также ингибирует аденилатциклазу и активирует различные тирозинкиназы.
Эффекты, опосредованные АТ1 рецептора включают вазоконстрикцию, повышение секреции и синтеза альдостерона, повышение секреции вазопрессина, гипертрофию сердца, увеличение периферической норадренергической активности, сосудистой пролиферации клеток гладких мышц, снижение почечного кровотока, ингибирование высвобождения ренина, обратного захвата натрия в почечных канальцах, модуляция центральной активности симпатической нервной системы, сердечной сократимости, центрального контроля за осмотическим давлением и формирования внеклеточного матрикса.
Основные эффекты стимуляции различных типов рецепторов ангиотензина II
Рецепторы 2-го типа
Вазоконстрикция
Стимуляция синтеза и высвобождения альдостерона Повышение реабсорбции натрия в проксимальных канальцах почек
Гипертрофия миокарда и пролиферация гладкомышечных клеток сосудов Повышение центральной и периферической симпатической активности Стимуляция высвобождения вазопрессина
Вазодилатация
Антипролиферативное
действие
Дифференциация и развитие тканей эмбриона
Рост эндотелиальных клеток
Стимуляция апоптоза
АТ3 и АТ4 плохо охарактеризованые подтипы. Рецепторы АТ4 активируются метаболитом ангиотензина II ангиотензином IV, и могут играть роль в регуляции внеклеточного матрикса ЦНС, а также модуляции высвобождения окситоцина
3.10. Ангиотензиновые рецепторы как мишень фармакологического воздействия.
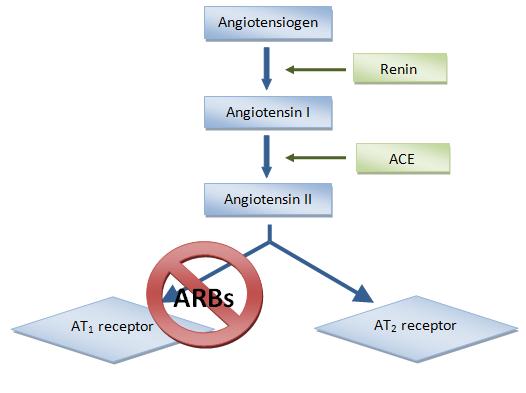
Антагонисты рецепторов ангиотензина (АРА) — относительно новый класс среди гипотензивных препаратов первого ряда, рекомендованных для лечения артериальной гипертензии ВОЗ/МОГ в 1999 году. Первый препарат АРА для перорального применения — лосартан — был синтезирован группой исследователей во главе с P.Timmermans в 1988 году и применяется в клинике с 1994 года. В целом АРА оказывают антигипертензивный эффект, аналогичный другим препаратам первого ряда, но отличаются низкой частотой побочных эффектов и очень хорошей переносимостью.
В 1970-х годах было показано, что повышение уровня Ang II может нанести вред сердцу и почкам, а люди с высоким уровнем активности ренина в плазме подвергались повышенному риску инфаркта миокарда и инсульта [4]. С введением ингибиторов ангиотензинпревращающего фермента (АПФ) в конце 1970-х годов было подтверждено, что Ang II играет важную роль в регулировании артериального давления, электролитов и баланса жидкости [5].
Ang II связывается с АТ1-рецепторами через различные сайты связывания [1]. Первичный сайт связывания находится во внеклеточной области АТ1-рецептора, где Ang II взаимодействует с остатками в N-конце рецептора AT1 и его первой и третьей внеклеточных петель. Трансмембранные спирали также способствуют связыванию через С-концевую карбоксильную группу, которая взаимодействует с Lys199 в верхней части спирали 5 рецептора, подробности см. На рисунке 1. [8]
Ионный мост, образованный между Lys199 и карбоксильной концевой группой остатка Phe8 Ang II, скорее всего, стабилизирован остатком Trp253. Кроме того, Phe259 и Asp263 в трансмембранной спирали 6 и Lys102 и Ser105 во внешней области трансмембранной спирали 3 также были вовлечены в связывание Ang II. Эта область может, возможно, участвовать в стабилизации ратификации рецептора и в образовании внутримембранного связующего кармана.
Большинство АРБ имеют один и тот же фармакофор, поэтому разница в их биохимическом и физиологическом эффектах в основном обусловлена различными заместителями. Активность лекарственного средства зависит от его сродства к сайту субстрата и продолжительности его связывания с сайтом. Липофильные заместители, такие как линейная алкильная группа в 2-положении на имидазольном кольце вместе с бифенилметильной группой, связываются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в 1-положении бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для сильной антагонистической активности [18].
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой [4].
Несколько заместителей были испытаны в 4- и 5- положениях на имидазольном кольце. Хлор и гидроксиметильные группы, связанные с этими положениями в лозартане, вероятно, не имеют большого значения при связывании рецепторов, поскольку другие АРБ не обладают этими функциональными группами и имеют сравнимые или лучшие связывающие аффинности, чем лозартан. Ирбезартан имеет карбонильную группу в 5-положении, функционирующую в качестве акцептора водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором [1] [4] [18] Структура eprosartan отличается тем, что отличается от других ARB, обычная бифенилметильная группа была заменена карбоксибензильной группой, которая более точно имитирует фенольную группу Tyr4 группы Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты существенно не улучшаются [1].
Telmisartan имеет карбоновую кислоту в 2-положении бифенилметильной группы и является более сильным, чем аналог тетразола [1]. Сообщалось, что имидазолы, которые имеют гидроксиметил- и карбоксильные группы в положении 4 и 5, обладают сильной антагонистической активностью, вызванной водородной связью и гидрофильностью гидроксиметильной группы [18]. Сообщалось также, что гидроксильная группа в 4-положении на имидазольном кольце играет важную роль в аффинности связывания и компенсирует недостаток липофильности объемной алкильной группы. [18] Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe2OH, благоприятна для заместителя 4-позиции на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для аффинности связывания [18].
Большинство АРБ имеют один и тот же фармакофор, поэтому разница в их биохимическом и физиологическом эффектах в основном обусловлена различными заместителями. Активность лекарственного средства зависит от его сродства к сайту субстрата и продолжительности его связывания с сайтом. Липофильные заместители, такие как линейная алкильная группа в 2-положении на имидазольном кольце вместе с бифенилметильной группой, связываются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в 1-положении бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для сильной антагонистической активности [18].
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой [4].
Несколько заместителей были испытаны в 4- и 5- положениях на имидазольном кольце. Хлор и гидроксиметильные группы, связанные с этими положениями в лозартане, вероятно, не имеют большого значения при связывании рецепторов, поскольку другие АРБ не обладают этими функциональными группами и имеют сравнимые или лучшие связывающие аффинности, чем лозартан. Ирбезартан имеет карбонильную группу в 5-положении, функционирующую в качестве акцептора водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором [1] [4] [18] Структура eprosartan отличается тем, что отличается от других ARB, обычная бифенилметильная группа была заменена карбоксибензильной группой, которая более точно имитирует фенольную группу Tyr4 группы Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты существенно не улучшаются [1].
Telmisartan имеет карбоновую кислоту в 2-положении бифенилметильной группы и является более сильным, чем аналог тетразола [1]. Сообщалось, что имидазолы, которые имеют гидроксиметил- и карбоксильные группы в положении 4 и 5, обладают сильной антагонистической активностью, вызванной водородной связью и гидрофильностью гидроксиметильной группы [18]. Сообщалось также, что гидроксильная группа в 4-положении на имидазольном кольце играет важную роль в аффинности связывания и компенсирует недостаток липофильности объемной алкильной группы. [18] Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe2OH, благоприятна для заместителя 4-позиции на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для аффинности связывания [18].
Candesartan и olmesartan имеют самое высокое сродство к рецепторам AT1, за которыми следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют сходные сродства, которые примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сходство. [6] Сродство ARB к рецептору AT2 обычно значительно ниже (или примерно в 10 000 раз меньше), чем для подтипа AT1. Поэтому они допускают беспрепятственную стимуляцию АТ2-рецептора [19].
Candesartan и olmesartan имеют самое высокое сродство к рецепторам AT1, за которыми следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют сходные сродства, которые примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сходство. [6] Сродство ARB к рецептору AT2 обычно значительно ниже (или примерно в 10 000 раз меньше), чем для подтипа AT1. Поэтому они допускают беспрепятственную стимуляцию АТ2-рецептора [19].
3.11. Неприлизин
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы – неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрийуретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) [3, 4]. Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома.
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида.
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате – к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1.
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием – ингибиторы вазопептидаз
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856–1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
4. Эндотелий-зависимые факторы
Эндотелий выполняет ключевую функцию в регуляции тонуса и роста сосудов. Эндотелий сосудов обладает способностью синтезировать и выделять факторы, вызывающие расслабление или сокращение гладких мышц сосудов в ответ на разного рода стимулы (табл). Общая масса эндотелиоцитов, монослойно выстилающих кровеносные сосуды изнутри (интима), у человека приближается к 500 г. Общая масса, высокая секреторная способность эндотелиальных клеток позволяют рассматривать эту «ткань» как своеобразный эндокринный орган (железу). Распределенный по сосудистой системе эндотелий, очевидно, предназначен для паракринной регуляции гладкомышечных образований сосудов. Период полужизни выделяемого эндотелиоцитами инкрета очень мал. Для NO он составляет — 6—25 с (вследствие быстрого перехода его в нитраты и нитриты), но он способен сокращать и расслаблять гладкие мышцы сосудов, не оказывая влияния на эффекторные образования других органов (кишечник, бронхи, матка).
Таблица Некоторые биологические регуляторы, секретируемые эндотелием