чем различаются между собой нуклиды 79br и 81br
Тест по теме «Атом»
Просмотр содержимого документа
«Тест по теме «Атом»»
Больше электронов, чем протонов содержит частица, символ которой:
Выберите один из 4 вариантов ответа:
В молекуле Sx содержится 64 электрона. Укажите значение х.
Чем различаются между собой нуклиды 79 Br и 81 Br?
Выберите несколько из 4 вариантов ответа:
1) числом нейтронов
2) протонным числом
3) числом электронов
Укажите символы элементарных частиц:
Выберите несколько из 4 вариантов ответа:
Один из нуклидов меди содержит 36 нейтронов, массовое число этого нуклида равно:
Выберите один из 4 вариантов ответа:
В электронейтральном атоме число протонов всегда равно:
Выберите несколько из 4 вариантов ответа:
1) сумме чисел нейтронов и электронов
3) числу электронов
4) разнице между нуклонным числом и числом электронов
Укажите символ самой тяжёлой частицы:
Выберите один из 4 вариантов ответа:
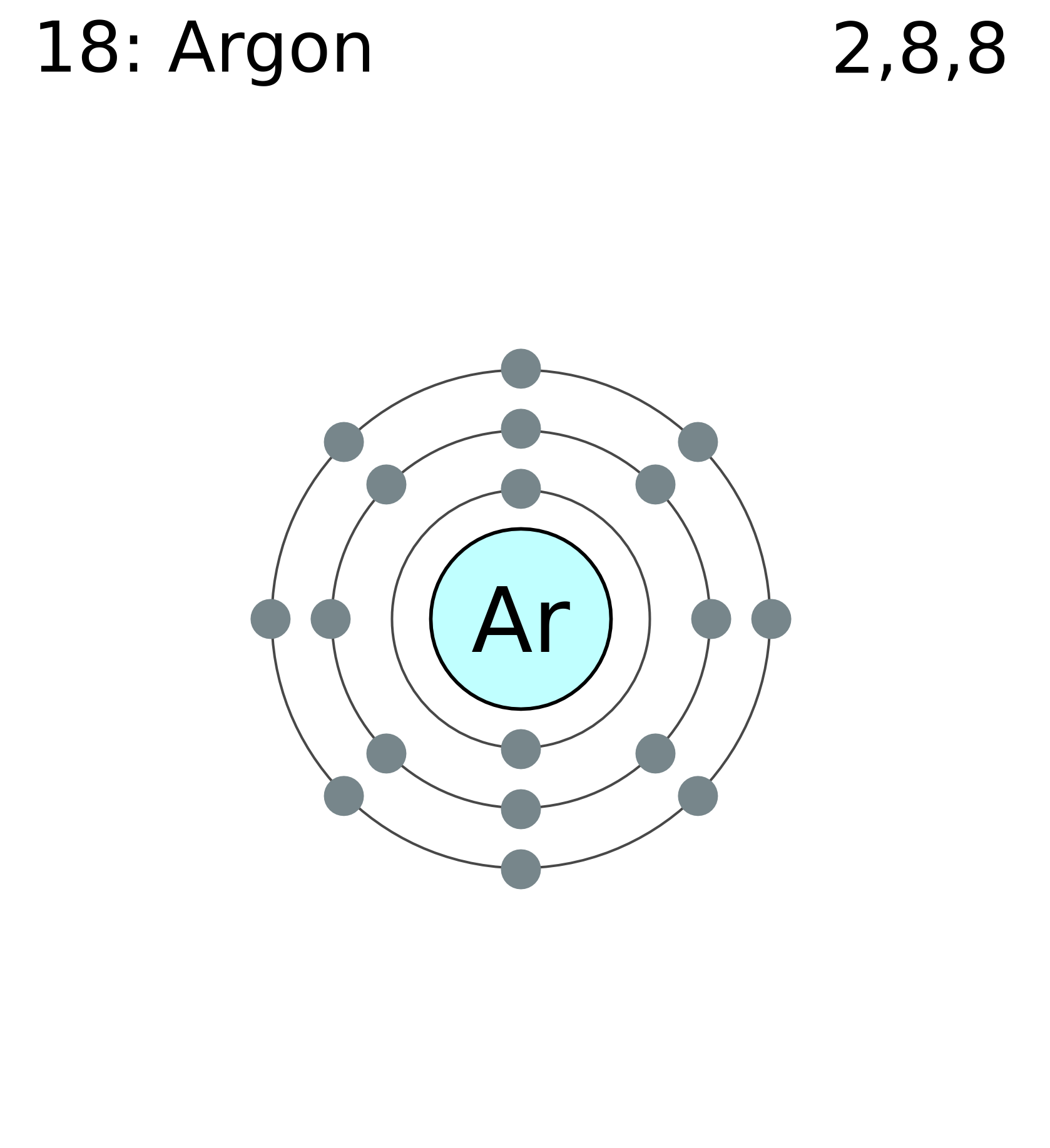
Запишите сумму всех элементарных частиц в нуклиде 40 Ar.
Массовая доля атомов водорода наибольшая в составе молекулы, формула которой:
Выберите один из 4 вариантов ответа:
Заряд ядра определяется числом:
Выберите один из 4 вариантов ответа:
Тест по теме «Атом»
Просмотр содержимого документа
«Тест по теме «Атом»»
Больше электронов, чем протонов содержит частица, символ которой:
Выберите один из 4 вариантов ответа:
В молекуле Sx содержится 64 электрона. Укажите значение х.
Чем различаются между собой нуклиды 79 Br и 81 Br?
Выберите несколько из 4 вариантов ответа:
1) числом нейтронов
2) протонным числом
3) числом электронов
Укажите символы элементарных частиц:
Выберите несколько из 4 вариантов ответа:
Один из нуклидов меди содержит 36 нейтронов, массовое число этого нуклида равно:
Выберите один из 4 вариантов ответа:
В электронейтральном атоме число протонов всегда равно:
Выберите несколько из 4 вариантов ответа:
1) сумме чисел нейтронов и электронов
3) числу электронов
4) разнице между нуклонным числом и числом электронов
Укажите символ самой тяжёлой частицы:
Выберите один из 4 вариантов ответа:
Запишите сумму всех элементарных частиц в нуклиде 40 Ar.
Массовая доля атомов водорода наибольшая в составе молекулы, формула которой:
Выберите один из 4 вариантов ответа:
Заряд ядра определяется числом:
Выберите один из 4 вариантов ответа:
Чем различаются между собой нуклиды 79br и 81br
Химия 11а. Выпуск 2021 запись закреплена
Задание #1
Вопрос:
Больше электронов, чем протонов содержит частица, символ которой:
Выберите один из 4 вариантов ответа:
1) C
2) Al3+
3) O2-
4) 188O
Задание #2
Вопрос:
В молекуле Sx содержится 64 электрона. Укажите значение х.
Запишите число:
___________________________
Задание #3
Вопрос:
Чем различаются между собой нуклиды79Br и 81Br?
Выберите несколько из 4 вариантов ответа:
1) числом нейтронов
2) протонным числом
3) числом электронов
4) массой
Задание #4
Вопрос:
Укажите символы элементарных частиц:
Выберите несколько из 4 вариантов ответа:
1) ē
2) р
3) α
4) 11H
Задание #5
Вопрос:
Один из нуклидов меди содержит 36 нейтронов, массовое число этого нуклида равно:
Выберите один из 4 вариантов ответа:
1) 65
2) 36
3) 29
4) 94
Задание #6
Вопрос:
В электронейтральном атоме число протонов всегда равно:
Выберите несколько из 4 вариантов ответа:
1) сумме чисел нейтронов и электронов
2) числу нейтронов
3) числу электронов
4) разнице между нуклонным числом и числом электронов
Задание #7
Вопрос:
Укажите символ самой тяжёлой частицы:
Выберите один из 4 вариантов ответа:
1) р
2) D
3) T
4) α
Задание #8
Вопрос:
Запишите сумму всех элементарных частиц в нуклиде 40Ar.
Запишите число:
___________________________
Задание #9
Вопрос:
Массовая доля атомов водорода наибольшая в составе молекулы, формула которой:
Выберите один из 4 вариантов ответа:
1) T218O
2) D218O
3) 21H31H18O
4) 11H217O
Задание #10
Вопрос:
Заряд ядра определяется числом:
Выберите один из 4 вариантов ответа:
1) нейтронов
2) протонов и электронов
3) электронов
4) протонов
Химический элемент бром (Br) — характеристика, строение и свойства неметалла
Определение и физическая характеристика
Бром, обозначаемый символом Вг, является галогеном и входит в VII группу периодической таблицы химических элементов. Вещество имеет атомный номер 35, а его атомная масса составляет 79,904 дальтонов. Молярная масса составляет 79,904 г/моль. Относительная молекулярная масса молекулы равна 159,808, а её молярная масса — 160 г/моль. Бром, встречающийся в природе, состоит из двух нуклидов с массовыми числами 79 и 81.
Существует множество искусственных радиоактивных изотопов. Среди них самым интересным считается 80Вr, поскольку на его примере советский физик И. В. Курчатов открыл изомерию атомных ядер.

Бром плохо растворяется в воде. Так, если её температура не превышает 5,84 °С, то вещество образует тёмно-красные кристаллы. Лучше всего для его растворения подходят органические составы. Извлекать элемент из различных водных соединений позволяет именно это физическое свойство.
Бром в любом физическом виде состоит из двухатомных молекул. Распад на атомы становится хорошо заметен при температуре 800 °C. Но также его можно наблюдать при действии света.
Химическое строение и свойства
Внешние электроны атома имеют конфигурацию 4s24p5. Необходимо отметить, что такое химическое свойство брома, как степень окисления, разнится в зависимости от соединения, к примеру, у гипобромитов этот показатель равен +1, а у броматов он составляет +5.
В соединениях валентность брома переменна. Атом вещества имеет заряд только тогда, когда является ионом, заряд ядра атома составляет 35. Представить электронную формулу брома можно следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Структурная же формула имеет вид: Br-Br.

Неметалл является химически активным, а потому по способности к реакции располагается между хлором и йодом. Сильное разогревание, иногда сопровождающееся горением, возникает, когда вещество взаимодействует со следующими реагентами:
Так же протекает реакция вещества с некоторыми металлами, к примеру, калием и алюминием. Но большинство металлических элементов плохо реагирует с безводным бромом, потому что на их поверхности образуется защитная плёнка бромида, который не растворяется в этом реагенте.
Самыми устойчивыми к такой реакции, даже при высокой температуре и наличии воды, считаются следующие металлы:

У золота с бромом взаимодействие проходит довольно активно. Кислород, азот и углерод не создают с элементом прямых соединений даже при повышенной температуре. Чтобы эти вещества соединились, химики применяют различные косвенные методы. К примеру, очень непрочный оксид Вr3О8 получают посредством воздействия озона на бром при 80 °C. Реагировать непосредственно с элементом способны галогены, в результате их взаимодействия образуются BrF3, BrCl и другие соединения.
Бром относится к сильным окислителям. Элемент способен вытеснить из химических соединений йод. Само же вещество подвергается вытеснению хлором и фтором.
Выделить чистый неметалл из бромидов на основе воды можно посредством использования сильных окислителей, поместив все реагенты в кислую среду. Растворяясь в воде, вещество вступает с нею в слабую реакцию, результатом которой становится образование бромистоводородной и бромноватистой кислот. Водный раствор элемента называется бромной водой.
Неметалл растворяется в щелочах:
Взаимодействие брома и органических соединений чаще всего проходит с характерным присоединением углерода по двойной связи и замещением водорода. Обычно это происходит при воздействии различных катализаторов или света. Ещё одной распространённой химической реакций является бромирование, суть которого заключается во введении атома реагента в соединение посредством химической реакции вещества с ненасыщенной молекулой или замещения водорода.
Нахождение в природе

Основная часть природного брома рассеяна в земной коре. Больше всего вещества содержится в породах, сформированных магмой. Этот элемент можно обнаружить рядом с хлором. Так, соли элемента встречаются в солевых хлорных отложениях, в морской воде, насыщенном растворе соляных озёр и рассолах, находящихся под землёй, которые зачастую связаны с месторождениями соли и нефти. Так как вещество хорошо растворяется в воде, его соли скапливаются в рассолах, оставшихся на месте озёр и заливов.
Неметалл перемещается в форме хорошо растворимых соединений, а потому его довольно сложно встретить в твёрдой минеральной форме. Минералами становятся бромирит AgBr, эмболит Ag (Cl, Вг) и йодэмболит Ag (Cl, Вr, I), которые образуются в зонах окисления сульфидных месторождений серебра, сформировавшихся в областях пустынь и полупустынь.
Промышленное получение
В промышленности для получения брома используют морскую воду, озёрные и подземные рассолы, а также калийные щёлоки. Для выделения вещества применяют хлор. Процедура состоит из следующих этапов:

Метод с применением воздуха позволяет получать бром из рассолов даже с небольшим количеством вещества. Применять к таким смесям паровой способ экономически невыгодно, поскольку на выделение малого количества реагента тратится значительное количество пара.
Применение вещества
Прежде всего, вещество является основой для создания бромистых солей и различных производных на основе органики. Но и сам реактив, и его соединения довольно широко используются во многих областях жизнедеятельности человека:

Бром в организме
Вещество содержится в тканях всех животных и растений. Его обнаружили практически во всех жидкостях тела. Если человек здоров, то в его организме уровень брома составляет от 0,11 до 2,00 мг/%. Для поддержания этого показателя в сутки необходимо получать не больше 0,8−1 г реактива.
Радиоактивный бром позволил выявить, что вещество поглощается щитовидной железой, почками и мозгом. Бромиды, которые были введены в животные организмы, увеличили концентрацию процессов торможения, проходящих в головном мозге. Они способствовали приведению в норму нервной системы, которая пострадала от чрезмерного напряжения, возникшего в результате подобного процесса.

Но следует учитывать, что химический элемент задерживается в щитовидной железе, вступая в конкуренцию с йодом. Это влияет на работу органа, что отражается на обмене веществ.
Бром плохо усваивается, если в реакции будут участвовать хлор, алюминий, йод и фтор. Чтобы избежать такой ситуации, перед началом лечения препаратами, содержащими бромные соли, необходимо проконсультироваться с врачом.
Опасность и вред
Очень опасны пары вещества:
Во избежание отравления все работы с реагентом необходимо осуществлять в специальных шкафах, оборудованных хорошей вытяжной системой. Если же защититься от паров не удалось, то следует подышать сильно разбавленным водным раствором аммиака, возможно применение раствора на этиловом спирте. Для устранения боли в горле, возникшей из-за воздействия отравляющего газа, нужно выпить хорошо нагретое молоко.

В жидком виде попавшее на кожу вещество вызывает ожоги, которые плохо заживают. В случае поражения кожи реагент необходимо тщательно смыть большим количеством воды или сдуть мощной воздушной струёй. Место ожога следует смазать ланолином.
Представителям профессий, требующих постоянной концентрации внимания, к примеру, водителям и альпинистам, применять лекарства на основе брома не рекомендуется. Это обусловлено свойством вещества снимать возбуждённое состояние нервной системы, расслаблять её.
Признаки избытка и нехватки
Чаще всего переизбыток вещества в организме возникает при неправильном употреблении бромосодержащих препаратов. Это состояние может привести к серьёзным проблемам со здоровьем. Признаки избытка микроэлемента:

Нехватка брома не менее серьёзная проблема. Из-за отсутствия в организме необходимого количества вещества у беременных женщин повышается вероятность выкидыша на разных сроках.
Проявляться недостаток микроэлемента может в виде таких симптомов:
Эти проблемы редко ассоциируются именно с нехваткой брома, но всё же лучше обратиться к врачу и сдать необходимые анализы. Такая мера позволит установить причину недомогания и исключить возможность развития более серьёзных заболеваний.
Бром является важным химическим элементом. Он необходим для нормальной жизнедеятельности растений и животных. Недостаток этого неметалла, как и его избыток, может привести к развитию заболеваний. Кроме того, вещество активно применяется в различных сферах деятельности человека. На его основе создаются лекарственные препараты, химические реагенты и инсектициды.
Таблица нуклидов
| 145 Gd | Нестабильный (менее суток) |
| 146 Gd | 1—10 дней |
| 149 Gd | 10—100 дней |
| 153 Gd | 100 дней — 10 лет |
| 148 Gd | 10—10 000 лет |
| 150 Gd | 10 тыс.—700 млн лет |
| 158 Gd | Стабильный |
Эта таблица нуклидов содержит все известные науке нуклиды. Количество протонов (атомный номер) увеличивается слева направо, а нейтронов — сверху вниз, то есть вертикальные столбцы включают все изотопы химического элемента, а горизонтальные строки — изотоны.
Период полураспада нуклида показан цветом его ячейки (смотрите расшифровку цветов справа на примере гадолиния). Цветные рамки показывают время жизни наиболее стабильных ядерных изомеров.
Интересный факт: не существует стабильных или хотя бы долгоживущих нуклидов с массовыми числами 5 и 8.