чем разбавить серную кислоту
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Большая Энциклопедия Нефти и Газа
Разбавление концентрированной серной кислоты следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться. [1]
Разбавление концентрированной серной кислоты и растворение едких щелочей проводят в фарфоровой посуде ( стаканах, чашках), так как эти процессы сопровождаются выделением большого количества тепла. При разбавлении серной кислоты ее следует медленно приливать в воду, все время перемешивая. Приливание воды в кислоту категорически запрещается, что обусловлено бурным вскипанием и разбрызгиванием горячей кислоты, которая может вызвать тяжелые ожоги. [2]
Для разбавления концентрированной серной кислоты удобно пользоваться правилом креста. [3]
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет разбрызгивание кислоты. [4]
SOt-Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты. [5]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании. [8]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту к воде, но не наоборот. Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты. [9]
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла. Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана. [10]
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая. [11]
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании. [12]
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты. [13]
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание. [14]
Разбавление и смешивание серной кислоты
В заводских условиях нередко бывает необходимо разбавить концентрированную серную кислоту водой или повысить концентрацию разбавленной кислоты, добавляя к ней концентрированную. Для этого предварительно надо установить или проверить концентрацию ИСХОДНЫХ КИСЛОТ, определив в НИХ содержание H2SO4.
При добавлении воды к концентрированной кислоте (олеуму или моногидрату) можно получить кислоту любой концентрации, однако при смешивании концентрированной. серной кислоты с водой выделяется большое количество тепла. Кислота может нагреться до кипения, произойдет бурное выделение паров и возможен выброс раствора из сосуда. Поэтому кислоты смешивают в специальных аппаратах — смесителях, соблюдая соответствующие меры предосторожности.
Смесители для приготовления кислоты низкой концентрации делают из кислотостойкого материала, для приготовления концентрированной кислоты — из чугуна. В производстве серной кислоты используют смесители разнообразного устройства. В некоторых случаях смеситель представляет собой чугунный эмалированный изнутри котел, помещенный в стальной кожух и закрытый крышкой. Смешиваемые кислоты поступают в чугунный эмалированный с обеих сторон конус, в котором они перемешиваются, после чего вытекают в котел. Для отвода тепла, выделяющегося при смешивании кислот, в пространство между котлом и кожухом непрерывно подается струя воды, омывающая стенки аппарата.
В некоторых случаях кислота после смешивания в небольшом резервуаре поступает в трубы, орошаемые снаружи водой, где одновременно охлаждается и дополнительно перемешивается.
При смешивании концентрированной серной кислоты с водой или с более разбавленной серной кислотой необходимо рассчитывать количество смешиваемых кислот. Расчеты проводят по так называемому правилу креста. Ниже приводится несколько примеров такого расчета.
1. Определить количество 100%-ной серной кислоты и воды, которые необходимо смешать для получения 45%-ной II2SO|.
Слева указывают концентрацию более концентрированной кислоты (в данном случае 100%), а справа — более разбавленной (п данном случае 0%—вода). Ннже, между ними, указывают заданную концентрацию (45%). Через цифру, обозначающую эту концентрацию, проводят дне перекрещивающиеся линии, а на их концах указывают соответствующую разность чисел:
Полученные под кислотами исходных концентраций цифры показывают, сколько массовых частей кислоты каждой из указанных концентраций необходимо смешать для получения кислоты заданной концентрации. В нашем примере для приготовления 45%-ной кислоты следует смешать 45 масс. ч. 100%-ной кислоты н 55 масс. ч. воды.
Эту же задачу можно решить исходя из общего баланса II2SO4 (или S03) в серной кислоте:
Числитель левой части уравнения соответствует содержанию H2S04 (в кг) в I кг 100%-ной серной кислоты, знаменатель — общему количеству заданного раствора (в кг). Правая часть уравнения соответствует концентрации серной кислоты в долях единицы. Решая уравнение, получаем х—1,221 кг. Это значит, что к 1 кг 100%- ной серной кислоты надо добавить 1,221 кг воды, при этом получится 45%-ная кислота.
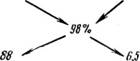
2. Определить количество 20%-ного олеума, которое следует смешать с 10%-нон серной кислотой для получения 98%-ной кислоты.
Задача решается также по правилу креста, однако концентрацию олеума в этом примере нужно выразить в % H2SO4, используя уравнения (9) н (8):
Следовательно, для получения 98%-ной серной кислоты требуется смешать 88 масс. ч. 20%-ного олеума и 6,5 масс. ч. 10%-иой серной кислоты.
Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3): Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
Химические свойства
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
4. Т акже серная кислота вступает в обменные реакции с солями.
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде
, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор H2SO4. Это значит, что в I л раствора должно содержаться:
Кислота с плотностью 1,84 г\смг содержит 95,6% H2SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):
Соответствующий объем кислоты составит:
Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора H2SO4 содержит не 0,0049 г H2SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.