чем растворить оксид титана
Способ растворения диоксида титана
РЕСПУБЛИК (s<>s С 22 В 34/12
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ОПИСАНИЕ ИЗОБРЕТЕНИЯ 0
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4775254/02 (22) 27.11.89 (46) 23.12.91.Бюл. М 47 (72) А.Ю. Савочкин, В.А. Корнюхин и А.И. Кислов (53) 669.295.3 (088.8) (56) Большаков К.А, Химия редких и рассеянных элементов, Ч. 1. — М.: Высшая школа, 1965, с. 34. (54) СПОСОБ РАСТВОРЕНИЯ ДИОКСИДА
Изобретение относится к области переработки материалов, содержащих диоксид титана.
Целью изобретения является повышение скорости процесса.
Пример 1. Порошок диоксида титана с размером частиц менее 0,1 мм обрабатывают азотной кислотой с содержанием
780 г/л НАВОЗ при соотношении фаз Т:Ж =
= 1:10 и температуре 60 С. За время контакта, равное 20ч, изменения первоначального веса диоксида титана не наблюдается, Пример 2. Порошок диоксида титана с размером частиц менее 0,1 мм обрабаты,,вают фтористоводородной кислотой с содержанием 500 г/л HF при соотношении фаз Т:Ж= 1:10 и температуре 60 С. За время контакта, равное 15 ч, происходит полное растворение диоксида титана.
Пример 3. Порошок диоксида титана с размером частиц менее 0,1 мм обрабаты- вают смесью концентрированных азотной и фтористоводородной кислот при соотношении фаз Т:Ж = 1:10 и температуре 60 С.. Ж, 1700077 А1 (57) Изобретение касается переработки материалов, содержащих диоксид титана, например, растворением в концентрированном оастворе фтористоводородной (HF) кислоты. Цель — повышение скорости процесса. Растворение ведут смесью концентрированных растворов азотной (НАВОЗ) и фтористоводородной кислот, взятых при соотношении 0,05 — 0,2 r-экв НЙОЗ на 1 г-экв
HF. Скорость растворения повышается в
Соотношение азотной и фтористоводородной кислот составляет 0,12 г-экв НГчОз на
1 г-экв HF. Полное растворение диоксида титана происходит за 8 ч. Результаты с различными значениями соотношений НАВОЗ к
HF приведены в таблице.
Использование предлагаемого способа растворения диоксида титана позволит интенсифицировать процесс за счет увеличения его скорости и одновременно заменить часть дорогостоящей фтористоводородной кислоты на более дешевую азотную кислоту, Фо р мул а,и зоб рете н ия
Способ растворения диоксида титана, включающий обработку порошка диоксида титана раствором концентрированной фтористоводородной кислоты при нагревании, отличающийся тем, что, с целью увеличения скорости процесса, растворение ведут смесью растворов концентрированных азотной и фтористоводородной кислот, взятых в соотношении 0,05 — 0,2 r-экв азотной кислоты на 1 r-экв фтористоводородной кислоты.
Средняя скорость растворения к моменту Изобретение относится к способам получения тетрахлорида титана и позволяет повысить выход титана, а также снизить температуру и упростить процесс
Форум химиков
Растворитель для диоксида титана
Растворитель для диоксида титана
Сообщение orient » Пн ноя 21, 2011 2:22 pm
Re: Диоксид титана
Сообщение chimist » Пн ноя 21, 2011 7:52 pm
Re: Диоксид титана
Сообщение stallker » Пн ноя 21, 2011 9:18 pm
Re: Диоксид титана
Сообщение orient » Пн ноя 21, 2011 9:42 pm
Re: Диоксид титана
Сообщение antabu » Вт ноя 22, 2011 6:55 am
Re: Диоксид титана
Сообщение Агдамыч » Вт ноя 22, 2011 2:53 pm
Re: Диоксид титана
Сообщение amik » Вт ноя 22, 2011 2:59 pm
Re: Диоксид титана
Сообщение Агдамыч » Вт ноя 22, 2011 4:10 pm
Re: Диоксид титана
Сообщение amik » Вт ноя 22, 2011 5:48 pm
Re: Растворитель для диоксида титана
Сообщение orient » Вт ноя 22, 2011 7:04 pm
Re: Растворитель для диоксида титана
Сообщение stallker » Ср ноя 23, 2011 12:20 am
Оксид титана (двуокись титана)
Понятие и общие сведения
Титан является металлом четвертой группы, который при соединении с кислородом может образовывать до 15 различных оксидов. Однако, наиболее характерен для него диоксид или оксид титана (IV), или двуокись титана.
В зависимости от вида кристаллической решетки титановый диоксид образует следующие минералы:
— Рутил, обладающий тетрагональной кристаллической решеткой.
— Анатаз, имеющий тетрагональную решетку.
— Брукит, характеризующийся ромбической решеткой.
Кроме того, известны две другие модификации титаноксида высокого давления: ромбическая и гексагональная. В лаборатории под давлением 60 000 бар синтезировали еще одну модификацию двуокиси титана с наиболее высокой твердостью из известных.
Свойства
Оксиды титана различных степеней окисления сильно отличаются друг от друга по своим физико-химическим характеристикам. Рассмотрим свойства наиболее распространенных оксидов.
Монооксид (оксид титана II) формулой TiO представляет собой кристаллы, обладающие цветом в гамме от золотисто-желтого до коричнево-фиолетового цвета. Это вещество не растворимо в воде, но растворимо в разбавленных соляной и серной кислотах. В случае нагревания в воздушной среде монооксид окисляется до двуокиси титана TiO2. Это свойство используется в катализаторах, где находит применение окись титана (II).
Сесквиоксид (оксид титана III), химически описываемый как Ti2O3, выглядит как кристаллы темно-фиолетового или черного цвета. Не является устойчивым соединением, при сильном нагреве до испарения диссоциирует на два других оксида TiO и TiO2. В среде воздуха подвергается окислению лишь при очень высокой температуре. Не реагирует с водой и неорганическими кислотами. Растворяется при нагреве в концентрированной серной кислоте с выходом сульфата титана (III) фиолетового цвета.
Двуокись титана (оксид титана IV) формулой TiO2 – это, как ни странно, в кристаллической форме представляют собой неокрашенные кристаллы, желтеющие при нагревании, однако вновь теряющие цвет при последующем охлаждении. Диоксид титана не растворим в воде, набухает в неорганических кислотах и разбавленных растворах щелочей. С трудом растворим в концентрированных серной кислоте и щелочных растворах. При нагревании в азотной кислоте образуется карбид титана (III) TiN. Титаноксид (IV) восстанавливают до оксидов титана (III и II) нагревая первый в среде водорода, углерода, щелочных или щелочноземельных металлов – натрия, магния, кальция и т.д. При нагревании в среде газообразного хлора и восстановителей, например углерода получается хлорид титана (IV).
Получение
Титаноксид (IV) производят различными способами, например путем прокаливания кислородсодержащих солей и оснований, гидролизом или сжиганием титансодержащих соединений и другими способами.
Чаще всего двуокись титана получают прокаливанием гидроокиси, полученной после гидролиза сульфатных растворов или сжиганием хлорида титана (IV) при температурах от 1200 градусов С. Высокочистый диоксид титана получается при помощи гидролиза титанорганических веществ с последующим прокаливанием.
Из полученной таким образом двуокиси титана можно произвести оксиды с более низкими степенями окисления при помощи частичного восстановления водородом или элементарным титаном при температурах порядка 1500 градусов С по схеме:
Оксиды с большим количеством атомов титана и наличествующими связями типа Ti-Ti, например Ti6O, Ti3O, Ti2O образуются в ходе растворения кислорода в непосредственно в титане. В случае повышения температуры более 300 градусов С такие соединения окисляются далее вплоть до двуокиси титана.
Применение титаноксида
Титан образует множество оксидов, однако подавляющее большинство применений имеет только оксид титана (IV) или двуокись. Среди других подобных соединений она является важным керамическим материалом и важнейшим пигментом.
Рис.1. Гранулированный суперконцентрат пигмента TiO2.
Суть применения двуокиси титана в современной индустрии базируется на способности мелкодисперсного порошка оксида с размером частиц от 20 до 50 нанометров демонстрировать очень высокую отражательную способность. Это свойство позволяет применять диоксид титана в качестве белого пигмента при изготовлении красок, известных как «титановые белила». Кроме того, пигмент повсеместно применяется при производстве эмалей, окраске бумаги, пластмасс и эластомеров, синтетических волокон, керамической продукции, стекла и многого другого. Титановые краски имеют ряд преимуществ перед аналогами и прежде всего ранее широко применяющимися свинцовыми белилами:
— отсутствие токсичности (кроме порошкообразной формы – см. ниже),
— имеют более высокие эксплуатационные характеристики, надежность и долговечность.
В промышленности производства и переработки пластмасс и эластомеров диоксид титана является одним из самых важных пигментов. Он применяется в основном в двух формах:
Порошкообразной форме для приготовления смесей, применяемых при экструзии изделий из ПВХ (оконные и дверные профили, подоконники, водостоки, сайдинг, отделочные панели и т.д.). Также применяется для приготовления пластизолей и при других нераспространенных применениях.
В виде гранулированных суперконцентратов пигментов на основе различных полимеров, чаще всего полиэтилена, сэвилена, полипропилена, полистирола. Такая форма, с наполнением оксидом титана до 80% суперконцентрата, широко используется при литье под давлением, выдувном формовании, экструзии гранулированных пластмасс.
Также двуокись титана используется при приготовлении жидких красителей для пластмасс, опудривании гранул непосредственно пигментами и т.д.
Рис.2. Типичное изделие из ПВХ окрашенное в массе
Возможный вред здоровью
В действующих стандартах указано, что пыль диоксида титана обладает раздражающим действием. Она в определенных концентрациях может стать причиной бронхитов, пневмосклероза и прочих болезней легких человека. Предельно-допустимая концентрация титаноксида в воздухе рабочей зоны составляет 10 мг/куб.м, в атмосферном воздухе 0,5 мг/куб.м, в воде 0,1 мг/литр.
Вредность и теоретическая опасность диоксида титана привела к пристальному вниманию к этому соединению со стороны законодателей ряда стран, прежде всего государств Евросоюза. В 2019 году в новостных лентах стали появляться сообщения об ограничении использования титаноксида и его возможном запрете в будущем. В частности, Европейское Химическое Агентство в 2017 году подтвердило опасность порошкообразного титаноксида. В сентябре 2019 года эксперты Competent Authorities for REACH and CLP предложили Европейской Комиссии внести двуокись титана в перечень потенциально опасных веществ. Пока речь идет только о пигменте в порошкообразной форме, однако и это наносит большой ущерб полимерной отрасли, т.к. порошок TiO2 практически незаменим при экструзии в частности ПВХ-профилей.
Объявления о покупке и продаже оборудования можно посмотреть на
Обсудить достоинства марок полимеров и их свойства можно на
Зарегистрировать свою компанию в Каталоге предприятий
Оксид титана
Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды). [1]
Содержание
Строение
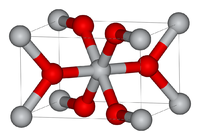
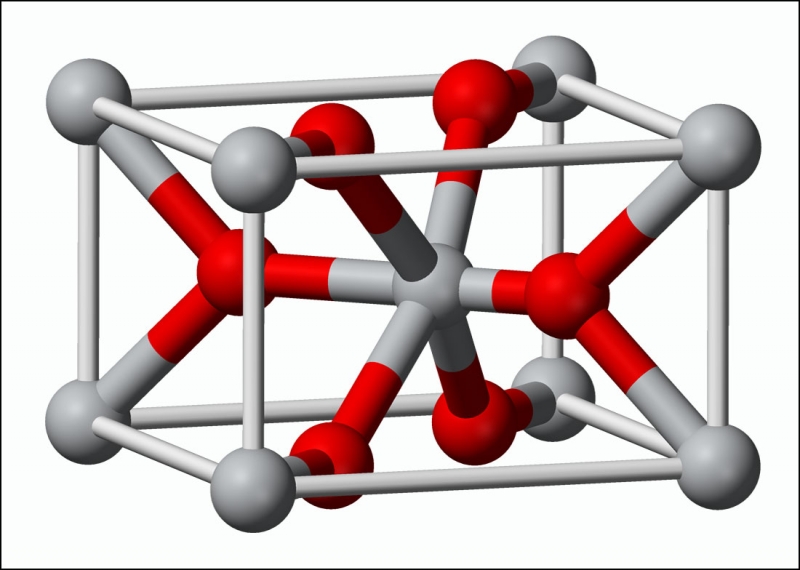
Оксид титана существует в виде нескольких модификаций. В природе встречаются кристаллы с тетрагональной сингонией (анатаз, рутил) и ромбической сингонией (брукит). Искусственно получены ещё две модификации высокого давления — ромбическая IV и гексагональная V.
| Модификация/Параметр | Рутил | Анатаз | Брукит | Ромбическая IV | Гексагональная V | |
|---|---|---|---|---|---|---|
| Параметры элементарной решётки, нм | a | 0,45929 | 0,3785 | 0,51447 | 0,4531 | 0,922 |
| b | — | — | 0,9184 | 0,5498 | — | |
| c | 0,29591 | 0,9486 | 0,5145 | 0,4900 | 0,5685 | |
| Число формульных единиц в ячейке | 2 | 4 | 8 | |||
| Пространственная группа | P4/mnm | I4/amd | Pbca | Pbcn | ||
Нахождение в природе
Третье в мире по запасам рутила месторождение находится в Рассказовском районе Тамбовской области. Крупные месторождения находятся также в Чили (Cerro Bianco), канадской провинции Квебек, Сьерра-Леоне.
Свойства
Физические, термодинамическе свойства
Чистый диоксид титана — бесцветные кристаллы (желтеет при нагревании). Для технических целей применяется в раздробленном состоянии, представляя собой белый порошок. Не растворяется в воде и разбавленных минеральных кислотах (за исключением плавиковой).
Температура плавления, кипения и разложения для других модификаций не указана, т.к. они переходят в рутильную форму при нагревании (см. выше).
| Модификация | Интервал температуры, K | |||||
|---|---|---|---|---|---|---|
| 298—500 | 298—600 | 298—700 | 298—800 | 298—900 | 298—1000 | |
| рутил | 60,71 | 62,39 | 63,76 | 64,92 | 65,95 | 66,89 |
| анатаз | 63,21 | 65,18 | 66,59 | 67,64 | 68,47 | 69,12 |
| Модификация | ΔH°f, 298, кДж/моль [6] | S°298, Дж/моль/K [7] | ΔG°f, 298, кДж/моль [8] | C°p, 298, Дж/моль/K [9] | ΔHпл., кДж/моль [10] |
|---|---|---|---|---|---|
| рутил | -944,75 (-943,9 [3] ) | 50,33 | -889,49 (-888,6 [3] ) | 55,04 (55,02 [3] ) | 67 |
| анатаз | -933,03 (938,6 [3] ) | 49,92 | -877,65 (-888,3 [3] ) | 55,21 (55,48 [3] ) | 58 |
Вследствие более плотной упаковки ионов в кристалле рутила увеличивается их взаимное притяжение, снижается фотохимическая активность, увеличиваются твёрдость (абразивность), показатель преломления (2,55 — у анатаза и 2,7 — у рутила), диэлектрическая постоянная.
Химические свойства
Диоксид титана амфотерен, то есть проявляет как осно́вные, так и кислотные свойства (хотя реагирует главным образом с концентрированными кислотами).
Медленно растворяется в концентированной серной кислоте, образуя соответствующие соли четырёхвалентного титана:
В концентрированных растворах щелочей или при сплавлении с ними образуются титанаты — соли титановой кислоты (амфотерного гидроксида титана TiO(OH)2)
То же происходит и в концентрированных растворах карбонатов или гидрокарбонатов:
C перекисью водорода даёт ортотитановую кислоту:
При нагревании с аммиаком даёт нитрид титана:
При сплавлении с оксидами, гидроксидами и карбонатами образуются титанаты и двойные оксиды:
При нагревании восстанавливается углеродом и активными металлами (Mg, Ca, Na) до низших оксидов.
При нагревании с хлором в присутствии восстановителей (углерода) образует тетрахлорид титана.
Нагревание до 2200 °C приводит сначала к отщеплению кислорода с образованием синего Ti3O5 (то есть TiO2·Ti2O3), а затем и тёмно-фиолетового Ti2O3.
Гидратированный диоксид TiO2·nH2O [гидроксид титана(IV), оксо-гидрат титана, оксогидроксид титана] в зависимости от условий получения может содержать переменные количества связанных с Ti групп ОН, структурную воду, кислотные остатки и адсорбированные катионы. Полученный на холоде свежеосажденный TiO2·nH2O хорошо растворяется в разбавленных минеральных и сильных органических кислотах, но почти не растворяется в растворах щелочей. Легко пептизируется с образованием устойчивых коллоидных растворов. При высушивании на воздухе образует объёмистый белый порошок плотностью 2,6 г/см³, приближающийся по составу к формуле TiO2·2H2O (ортотитановая кислота). При нагревании и длительной сушке в вакууме постепенно обезвоживается, приближаясь по составу к формуле TiO2·H2O (метатитановая кислота). Осадки такого состава получаются при осаждении из горячих растворов, при взаимодействии металлического титана с HNO3 и т. п. Их плотность
3,2 г/см³ и выше. Они практически не растворяются в разбавленных кислотах, не способны пептизироваться.
При старении осадки TiO2·nH2O постепенно превращается в безводный диоксид, удерживающий в связанном состоянии адсорбированные катионы и анионы. Старение ускоряется кипячением суспензии с водой. Структура образующегося при старении TiO2 определяется условиями осаждения. При осаждении аммиаком из солянокислых растворов при рН Токсические свойства, физиологическое действие, опасные свойства
TLV(предельная пороговая концентрация, США): как TWA (среднесменная концентрация, США) 10 мг/м³ A4 (ACGIH 2001).
Добыча и производство
Полная статья получение оксида титана(IV)
Мировое производство диоксида титана на конец 2004 года достигло приблизительно 5 миллионов тонн. [11]
Основными производители и экспортёры диоксида титана:
В последние годы чрезвычайно быстро растет производство диоксида титана в Китае.
В России пигментный диоксид титана не производят, но производят технические марки, используемые в металлургии. На территории СНГ диоксид титана производится на Украине предприятиями «Сумыхимпром», город Сумы, «Крымский титан», г. Армянск) и КП «Титано-магниевый комбинат» (г. Запорожье). Сумский государственный институт минеральных удобрений и пигментов (МИНДИП) в своих научно-исследовательских работах особое место уделяет технология получения оксида титана (IV) сульфатным способом: исследование, разработка новых марок, модернизация технологии и аппаратурного оформления процесса.
Как указано выше, диоксид титана встречается в виде минералов, однако этого источника недостаточно, поэтому значительная его часть производится. Существуют два основных промышленных метода получения TiO2: из ильменитового (FeTiO3) концентрата и из тетрахлорида титана.
Производство диоксида титана из ильменитового концентрата
Технология производства состоит из трёх этапов:
Производство диоксида титана из тетрахлорида титана
Существуют три основных метода получения диоксида титана из его тетрахлорида:
Применение
Основные применения диоксида титана:
Другие применения — в производстве резиновых изделий, стекольном производстве (термостойкое и оптическое стекло), как огнеупор (обмазка сварочных электродов и покрытий литейных форм), в косметических средствах (мыло и т.д.), в пищевой промышленности (пищевая добавка E171).
Цены и рынок
Нормативы
В настоящее время диоксид титана по ГОСТ 9808-84 не выпускается.
По данным техническим условиям работает ГАК «Титан» (г. Армянск).
По данным техническим условиям работает ОАО «Сумыхимпром» (г. Сумы).
Использованная литература
Ссылки
Разное: Воск (E900-909) • Глазурь (E910-919) • Восстановитель (E920-929) • Газ для упаковки (E930-949) • Заменители сахара (E950-969) • Вспениватель (E990-999)
Примечания
Полезное
Смотреть что такое «Оксид титана» в других словарях:
Оксид титана(IV) — Общ … Википедия
Оксид титана(II) — Общие Систематическое наименование Оксид титана(II) Традиционные названия Окись титана Химическая формула TiO Физические свойства Состояние ( … Википедия
оксид титана — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN titanium oxide … Справочник технического переводчика
Оксид титана (IV) — Порошок оксида титана Оксид титана(IV) (диоксид титана, двуокись титана, титановые белила, пищевой краситель E171) TiO2 амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана… … Википедия
Оксид титана(III) — Общие Систематическое наименование Оксид титана(III) Традиционные названия трёхокись титане Химическая формула Ti2O3 Физические свойства … Википедия
Дигидроксид-оксид титана — Общие Систематическое наименование Дигидроксид оксид титана Традиционные названия Метатитановая кислота, β титановая кислота Химическая формула TiO(OH)2 Физические свойст … Википедия
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
ТИТАНА СЕМЕЙСТВО — ПОДГРУППА IVB. СЕМЕЙСТВО ТИТАНА ТИТАН, ЦИРКОНИЙ, ГАФНИЙ К переходным металлам относятся также элементы семейства титана Ti, Zr и Hf, отличающиеся удивительным сходством свойств. Последние два элемента (Zr и Hf) особенно близки по свойствам.… … Энциклопедия Кольера
Оксид цинка — Оксид цинка … Википедия
Оксид цинка(II) — Оксид цинка Общие Систематическое наименование Цинка оксид Химическая формула ZnO Отн. молек. масса N а. е. м. Молярная масса … Википедия
Диоксид титана
В современно мире титановая индустрия развивается стремительно. Она является источником появления большого количества веществ, которые используются в разных сферах промышленности.
Характеристики диоксид титана
Диоксид титана обладает большим количеством названий. Он является амфотерным оксидом четырехвалентного титана. Он играет важную роль в развитии титановой индустрии. Только пять процентов титановой руды идет на производство оксида титана.
Есть большое количество модификаций диоксида титана. В природе встречаются кристаллы титана, которые обладают формой ромба или четырехугольника.
Формула диоксид титана
Диоксид титана формула представлена следующим образом: TiO2.
Диоксид титана нашел широкое распространение в различных отраслях промышленности. Он известен во всем мире в качестве такой пищевой добавки, как Е-171. Однако у данного компонента есть ряд негативных действий, что может свидетельствовать о том, что диоксид титана вред несет для организма человека. Известно, что этот компонент обладает отбеливающими качествами. Это может быть хорошо при производстве синтетических моющих средств. Вред для организма человека этой пищевой добавки представляет собой угрозу печени и почкам.
Вред от диоксид титана
В пищевой промышленности есть вероятность появления вреда от диоксида титана. При избыточном его использовании продукция может приобрести нежелательный оттенок, что только оттолкнет потребителей.
Диоксид титана обладает достаточно низким уровнем токсичности.
Он может стать токсичным при взаимодействии с другими компонентами какой – либо продукции. Использование продукции с высоким содержанием токсинов может привести к отравлениям или даже к смертельному исходу. Поэтому очень важно знать, с какими элементами не стоит использовать оксид титана.
Свойства диоксида титана
У диоксида титана имеется большое количество характерных для него свойств. Они определяют возможность его использования в разных отраслях промышленности. Диоксид титана свойства имеет следующие:
Получение диоксид титана
Ежегодно в мире производится более пяти миллионов тонн диоксида титана. За последнее время его производство очень сильно увеличил Китай. Мировыми лидерами по получению этого вещества являются США, Финляндия, Германия. Именно эти государства имеют большие возможности для получения этого компонента. Они экспортируют его в разные страны мира.
Диоксид титана получение возможно двумя основными методами:
1. Изготовление диоксида титана из ильменитового концентрата.
На производственных предприятиях процесс получения оксида титана таким образом делится на три этапа. На первом из них осуществляется обработка ильменитовых концентратов при помощи серной кислоты. В итоге образуются два компонента сульфат железа и сульфат титана. Затем осуществляет повышения уровня окисления железа. В специальных фильтрах происходит разделение сульфатов и шламов. На втором этапе производится гидролиз сульфатный солей титана. Гидролиз осуществляется путем использования зародышей из растворов сульфатов. В результате образуются гидраты оксида титана. На третьем этапе производится их нагревание до определенной температуры.
2. Изготовление диоксида титана из тетрахлорида титана.
В данном виде получения вещества существует три метода, которые представлены:
Таблица. Производители диоксид титана.
| Предприятие | Объемы производства, тыс. тонн |
|---|---|
| DuPont Titanium Technologies | 1150 |
| National Titanium Dioxide Co | н/д |
| Ltd. (Cristal) | 705 |
| Huntsman Pigments | 659 |
| Tronox, Inc. | 642 |
| Kronos Worldwide, Inc. | 532 |
| Sachtleben Chemie GmbH | 240 |
| Ishihara Sangyo Kaisha, Ltd | 230 |
Применение диоксид титана
В современном мире оксид титана активно применяется в различных отраслях промышленности.
Диоксид титана применение имеет следующее:
Оксид титана также нашел широкое применение в пищевой промышленности. Производители добавляют его в свои изделия в качестве одного из компонентов красителей пищевого типа. В продуктах питания он практически не ощущается. Производители добавляют его в минимальных количествах для того, чтобы их продукция лучше хранилась и имела привлекательный внешний вид.
Статьи по теме
Свойства фенола
Фенолы и их производные содержатся в древесине, торфе, буром и кам. углях, нефтяных остатках. В живой природе фенолы, гл. обр. в виде производных, присутствуют в клетках растений.