чем отличаются аллотропные модификации углерода
Аллотропия углерода
Аллотропия углерода.
Аллотропия углерода:
Аллотропия – это явление существования двух и более простых веществ одного и того же химического элемента, но различных по своему строению и соответственно свойствам. Все формы и модификации таких веществ называют аллотропными.
Аллотропные модификации углерода наиболее распространенные среди других химических элементов и по своим свойствам наиболее радикально отличаются друг от друга: от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому.
| Химическая связь | C-C | C=C | C ≡C |
| Энергия связи, кДж/моль | 348 | 612 | 838 |
| Гибридное состояние атома углерода | sp 3 | sp 2 | sp |
В итоге углерод образовывает самой большое количество аллотропических модификаций линейного или циклического строения.
Классификация аллотропных форм углерода:
По характеру связей между атомами аллотропические модификации углерода можно разделить:
– sp 3 формы – алмаз (кубический), лонсдейлит (гексагональный алмаз),
– sp формы – карбин (a-карбин и b-карбин),
– смешанные sp 2 /sp формы: графин (graphyne),
– другие формы: С1, С2 (диуглерод), С3, С8, М-углерод.
Аллотропные модификации углерода: названия, физические свойства, характеристики
Известно ли вам, что один и тот же химический элемент может образовать несколько веществ? Причем свойства этих веществ будут абсолютно разными. Из нашей статьи вы узнаете, сколько аллотропных модификаций имеет углерод, в чем их отличие и какова область применения.
Понятие аллотропии
Начнем с определения понятия. В переводе с греческого языка «аллотропия» означает «другое свойство». Суть этого явления заключается в том, что один элемент образует несколько простых веществ. Их называют аллотропными формами или модификациями.
Сколько аллотропных модификаций имеет углерод
Наиболее многочисленными являются тригональные формы. В этом случае углерод образует шестиугольники, слои которых связаны между собой. Примерами таких модификаций являются графит, фуллерены, нанотрубки, стеклоуглерод, графены и другие вещества. В случае образования цепочек углерода формируется линейная аллотропная форма. Ее примером является карбин.
Алмаз
Кроме твердости, к характеристикам алмаза можно отнести самые высокие показатели теплопроводности, износостойкости на стирание и модуля упругости. Такие уникальные свойства объясняются особой структурой кристаллической решетки. Каждый атом углерода в ней связан с четырьмя другими при помощи ковалентных связей. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Если алмаз без доступа воздуха нагреть до 1000 градусов, то он постепенно превратится в графит. Существует и обратный процесс. Из графита можно получить искусственные алмазы, если разогреть его до температуры свыше 1200 градусов под высоким давлением в присутствии катализатора.
Еще одним уникальным свойством алмазов является их способность к люминесценции. При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. Причем необработанный алмаз не обладает такими качествами. Способность к многократному отражению ему придает огранка, после которой алмаз называют бриллиантом.
Лонсдейлит
Согласитесь, из всех названий аллотропных модификаций углерода это является самым причудливым. Лонсдейлит получил название в честь британского кристаллографа Кэтлин Лонсдей. Его еще называют гексагональным алмазом. Первый удачный синтез данной модификации из графита был произведен еще в 1966 году. В то же время лонсдейлит обнаружили в кратерах метеоритов. Позже ученые сумели получить это вещество из традиционного кубического алмаза.
Графит
Как из одного вещества возможно образование настолько разных веществ? Дело в том, что в графите атомы углерода располагаются слоями. Связи в них очень прочные. А вот расстояние между слоями гораздо больше. Соответственно, и связи между ними слабые. Каждый раз проводя грифелем простого карандаша по бумаг, мы оставляет на ней графитовый слой. А вот разрушить такой стержень вдоль оси будет очень сложно.
Графены
В более крупных масштабах графен получают при нагревании кремниевых пластин. Их верхний слой состоит из карбида кремния. При действии высоких температур атомы углерода отщепляются и остаются на пластинке в виде графена. А кремний испаряется. Впервые это вещество было получено в 2004 году. Физик Константин Новоселов со своим учеником Андреем Геймом были удостоены за это открытие Нобелевской премии.
Нановолокна
Такая структура и состав обеспечивает нановолокнам исключительные свойства при низкой цене. Это высокие тепло- и электропроводность, механическая прочность, устойчивость к деформации. Нановолокна служат армирующими элементами в композитных материалах и наполнителями резин.
Стеклоуглерод
Карбин
Данная модификация является примером линейной формы аллотропии. Карбин состоит из углеродных цепочек с одинарными, двойными или тройными связями между атомами. Такие линейные структуры могут превращаться в циклические.
Аллотропия углерода
Углерод — вещество с самым [источник не указан 804 дня] большим числом аллотропических модификаций (более 8 уже обнаружены).
Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому. Эти аллотропы включают аморфные аллотропы углерода (уголь, сажа), нанопена, кристаллические аллотропы — нанотрубка, алмаз, фуллерены, графит, лонсдейлит и церафит.
Содержание
Классификация
Классификация аллотропов углерода по характеру химической связи между атомами:
Алмаз
Алмаз является одним из наиболее известных аллотропов углерода, чья твёрдость и высокая степень рассеивания света делает его полезным в промышленном применении и в ювелирных изделиях. Алмаз — самый твёрдый известный природный минерал, что делает его отличным абразивом и позволяет использовать для шлифовки и полировки. В природной среде нет ни одного известного вещества, способного поцарапать даже мельчайший фрагмент алмаза.
Рынок алмазов промышленного класса несколько отличен от рынков других драгоценных камней. Используемые в промышленности алмазы ценятся главным образом за их твёрдость и теплопроводность, из-за чего другие геммологические характеристики алмазов, в том числе чистота и цвет, по большей части излишни. Это помогает объяснить, почему 80 % добываемых алмазов (что эквивалентно примерно 100 млн. каратам или 20000 кг в год), непригодно для использования в качестве драгоценных камней и известны как борт, предназначенные для промышленного использования. В дополнение к добываемым алмазам, находят промышленное применение и искусственные синтетические алмазы, используемые практически сразу же после их изобретения в 1950 г., а ещё 400 миллионов каратов (80000 кг) синтетических алмазов выпускаются ежегодно для промышленного использования — почти в четыре раза больше массы природных алмазов, добытых за тот же период.
Основным промышленным применением алмазов является резка, сверление (в наконечниках свёрл и буров), шлифовка (резка алмазными гранями) и полировка. Большинство используемых в этих технологиях алмазов не требует крупных образцов; фактически, большинство алмазов качества драгоценных камней, могут использоваться в промышленности. Алмазы вставляются в наконечники буров или режущие кромки пилы или измельчаются в порошок для использования процессах шлифования и полирования. Специализированное применение включает в себя использование в лабораториях в качестве сдерживающих веществ при экспериментах с высоким давлением, в высокопроизводительных подшипниках и ограниченное применение в специализированных окнах.
С продолжающимся увеличением в производстве синтетических алмазов, их будущее применение становится более осуществимым. Накопление большого запаса — это возможность использовать алмазы в качестве полупроводников при изготовлении микрочипов или использовать для поглощения тепла в электронике. Значительные достижения в исследованиях в Японии, Европе и Соединённых Штатах позволяют использовать возможности, предоставляемые уникальными свойствами алмазного вещества, в сочетании с повышением качества и количества, обеспечиваемыми производителями синтетических алмазов.
Каждый атом углерода в алмазе ковалентен с четырьмя другими атомами углерода в тетраэдре. Эти тетраэдры вместе образуют трёхмерную сеть из слоёв шестичленных колец атомов. Эта устойчивая сеть ковалентных связей и трёхмерное распределение связей является причиной такой твёрдости алмазов.
Графит
Графит (назван Абрахамом Готтлобом Вернером в 1789 г, (с греческого графен — «тянуть/писать», использовался в карандашах) — один из самых обычных аллотропов углерода. Характеризуется гексагональной слоистой структурой. Встречается в природе. Твердость по шкале Мооса 1. Его плотность — 2.3, она меньше чем у алмаза. Приблизительно при 700 °C горит в кислороде, образовывая углекислый газ. По химической активности более реакционен чем алмаз. Это связано с проникновением реагентов между гексагональными слоями атомов углерода в графите. Не взаимодействует с обычными растворителями, кислотами или расплавленными щелочами. Однако, хромовая кислота окисляет его до углекислого газа. Получают нагреванием смеси пека и кокса при 2800 °C; из газообразных углеводородов при 1400—1500 °C при пониженных давлениях с последующим нагреванием образовавшегося пироуглерода при 2500−3000 °C и давлении около 50 МПа с образованием пирографита. В отличие от алмаза, графит обладает электропроводностью и широко применяется в электротехнике. Графит является самой устойчивой формой углерода при стандартных условиях. Поэтому в термохимии он принят за стандартное состояние углерода. Применяется для изготовления плавильных тиглей, футеровочных плит, электродов, нагревательных элементов, твердых смазочных материалов, наполнителя пластмасс, замедлителя нейтронов в ядерных реакторах, стержней карандашей, при высоких температурах и давлениях (более 2000 °C и 5 ГПа) для получения синтетического алмаза.
Порошок графита используется как сухая смазка. Однако в вакууме он заметно теряет смазочные свойства, это связано с тем, что смазочные свойства графита связаны с адсорбрцией воздуха и воды между слоями в графите, в отличие от других слоистых сухих смазок, типа дисульфида молибдена. При большом количестве кристаллографических дефектов, которые связывают слои в структуре, графита, он также теряет смазывающие свойства и становится подобным пиролитическому графиту.
Природные и кристаллические графиты редко используются в чистой форме из-за их скалываемости, хрупкости и противоречивых механических свойств.
Его чистые структурно изотропные синтетические формы, как например пиролитический графит и углеродистые графитовые волокна, представляют чрезвычайно прочный, огнеупорный (до 3000 °C) материал, используемый для защиты носовых конусов ракет, в конструкциях сопел твердотопливных двигателей ракеты, высокотемпературных реакторов, тормозных колодок и электрических моторных щеток.
Вспучивающиеся или растяжимые графиты используются в печах нагрева для герметизации ее элементов. В процессе нагрева графит вспучивается (расширяется и обжигается) и герметизирует области контакта. Типичная температура начала расширения (область температур) — между 150 и 300 °C. Электропроводность графита связана с делокализацией электронов пи — связей выше и ниже плоскостей расположения атомов углерода. В отличие от алмаза, в котором все четыре внешних электрона каждого атома углерода ‘локализованы’ между атомами в ковалентной связи, в графите, каждый атом связан ковалентной связью только с 3 из его 4 внешних электронов. Поэтому каждый атом углерода вносит один электрон в делокализованную систему электронов. Эти электроны находятся в зоне проводимости. Однако электропроводность графита ориентирована по поверхности слоев. Поэтому графит проводит электричество по плоскости слоя атомов углерода, но не проводит в направлении под прямым углом к плоскости.
Химия соединений: свойства аллотропных модификаций углерода
Аллотропия — это возможность существования вещества в виде нескольких модификаций, отличающихся друг от друга физически и химически. Аллотропия возможна для элементов, характеризующихся способностью атомов к образованию гомогенных цепей. Наибольший интерес для современной химии представляют свойства аллотропных модификаций углерода, в основном из-за перспектив получения большего количества видоизменённых форм с полезными свойствами.
Аллотропные преобразования и переходы
Наиболее характерны аллотропные преобразования для неметаллических веществ (кроме галогенов (хлор, бром, йод) и инертных газов (аргон, ксенон и неон)), полуметаллов и, реже всего, для металлов. Переходы элемента в иную форму, отличающуюся от его стандартной модификации, происходят при изменении условий окружающей среды. Основными факторами, влияющими на аллотропные преобразования, являются изменения давления и температуры, которые могут воздействовать на элементы как поодиночке, так и комплексно. Примерами элементов, обладающих аллотропией, и их модификациями являются:
Любое изменение может быть обратимым (т. е. при возвращении к нормальным условиям вещество переходит в свою стандартную форму), энантиотропным, или же необратимым, монотропным. К энантиотропным переходам относятся превращения серы из ромбической в моноклинную или же переход белого пластичного олова (бета-олова) в белое хрупкое (гамма-олово). Монотропное видоизменение происходит, например, при модификации белого фосфора в чёрный.
Аллотропия углерода
Углерод, как активный элемент с четырьмя свободными связями, способен образовывать два основных типа соединений: кристаллические — твёрдые и аморфные — мягкие или пластичные вещества. Высокое содержание аморфного углерода наблюдается в таких веществах, как различные виды угля (антрацит, ископаемый, древесный и активированный), техуглероде, саже, коксе и углеродной нанопене. Кристаллические формы углерода, в свою очередь, подразделяются по особенностям пространственного строения кристаллической решётки:
Все аллотропные модификации углерода имеют существенные различия между собой начиная от способа их получения (например, естественный и искусственный), условий их формирования (температурные параметры и показатели давления) и заканчивая их применением.
Видоизмененные формы углерода
Основные критерии, указывающиеся в сводных таблицах примеров аллотропных модификаций, — это строение решётки, основные свойства (или так называемые полезные свойства, характеризующие ценность модификации для промышленности или науки) и отрасли применения материала.
| Название модификации | Строение решётки | Характеристика | Применение |
| Алмаз | Тетраэдрическая | Самое твёрдое вещество по шкале Мооса (10 баллов). Обладает высокой теплопроводностью, износостойкостью и модулем упругости. Способен к люминесценции | В качестве абразива, сдерживающего вещества в экспериментах с высоким давлением и в ювелирной промышленности |
| Лонсдейлит | Тетраэдрическая | 8 баллов по шкале Мооса. Прозрачен, индекс преломления составляет от 2,40 до 2,41 | В связи с чрезвычайной трудоёмкостью получения не имеет практического применения |
| Графит | Тригональная | Мягкий минерал, проводящий электричество. Не плавится, обладает химической активностью (реагирует с металлами, солями и кислородом) | Наиболее известен как материал для карандашного стержня, однако, также используется для изготовления электродов, плавильных тиглей, наполнителя для пластмасс и много другого |
| Графен | Тригональная | Двухмерная модификация углерода, представленная гексагональной кристаллической решёткой толщиной в 1 атом | Используется при создании транзисторов |
| Фуллерены | Тригональная | Состоят из молекул углерода в форме выпуклых многогранников | Применяются в лазерных технологиях, при получении искусственных алмазов и создании лекарств нового поколения |
| Наноалмазы | Тетраэдрическая | Наноструктуры с кристаллической решёткой по типу алмаза | В космической и медицинской отраслях промышленности |
| Карбин | Линейная | Мелкокристаллический порошок чёрного цвета со свойствами полупроводника. Кристаллическая решётка карбина состоит из множества линейных цепочек углерода, расположенных параллельно друг другу | Используется в фотоэлементах и в медицине для создания искусственных вен и артерий |
| Стеклоуглерод | Имеет аморфное строение | За счёт сложного, смешанного состава, характеризуется электропроводностью графита и твёрдостью, схожей с твёрдостью стекла. Устойчив к коррозии в агрессивных средах | Как материал для электродов и тиглей |
Исследование модификаций углерода позволяет не только получать конструкционные материалы с заданными свойствами, но и предсказывать возможность существования новых форм с уникальными характеристиками.
Так, например, одной из самых последних гипотез, стало предположение о получении Т-углерода, гораздо более легкого чем алмаз и обладающего 65% его твердости, что позволит использовать минерал в аэрокосмической отрасли.
Таким образом, в ближайшем будущем ожидается появление новых видоизмененных форм одного из самых распространенных элементов на земле. Однако уже известные его аллотропные модификациии, всё ещё будут использоваться в промышленности и науке за счёт особенностей своего строения, химических и физических свойств.
Углерод
Углерод (C, лат. carboneum ) — химический элемент, символизируемый буквой C и имеющий атомный номер 6. Элемент является четырехвалентным неметаллом, т. е. имеет четыре свободных электрона для формирования ковалентных химических связей. Он располагается в 14-й (по устаревшей классификации — в 4-й) группе периодической системы. Три изотопа данного элемента встречаются в окружающем нас мире. Изотопы 12 C и 13 C являются стабильными, в то время как 14 C- радиоактивный (период полураспада данного изотопа составляет 5,730 лет). Углерод был известен ещё в античном мире.
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, называемых органическими, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия.
Содержание
История
Углерод в виде древесного угля применялся в древности для выплавки металлов. Издавна известны аллотропные модификации углерода — алмаз и графит.
На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Поздние флогистики, Реомюр, Бергман и другие, уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 год германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 г. Потт обнаружил отсутствие в графите какой-либо примеси свинца. Шееле исследовал графит (1779) и, будучи флогистиком, счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Происхождение названия
В XVII—XIX веках в русской химической и специализированной литературе иногда применялся термин «углетвор» (Шлаттер, 1763; Шерер, 1807; Севергин, 1815); с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карбо(н) — от лат. carbō (род. п. carbōnis) «уголь».
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Изотопы углерода
На образовании и распаде 14 C основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
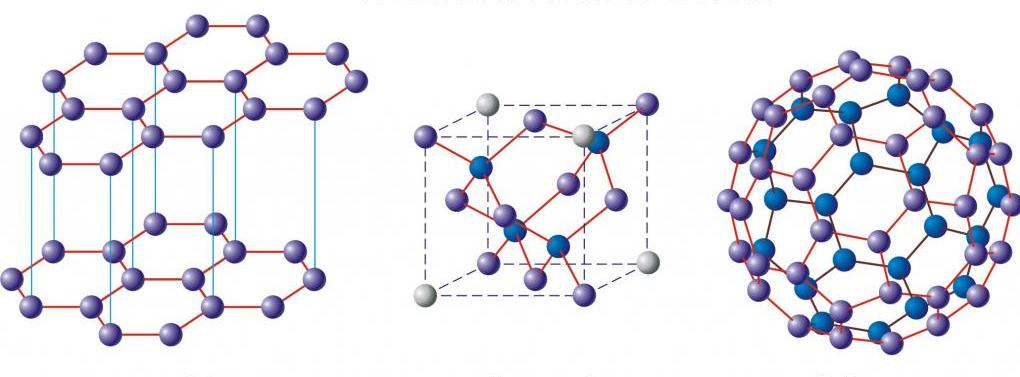
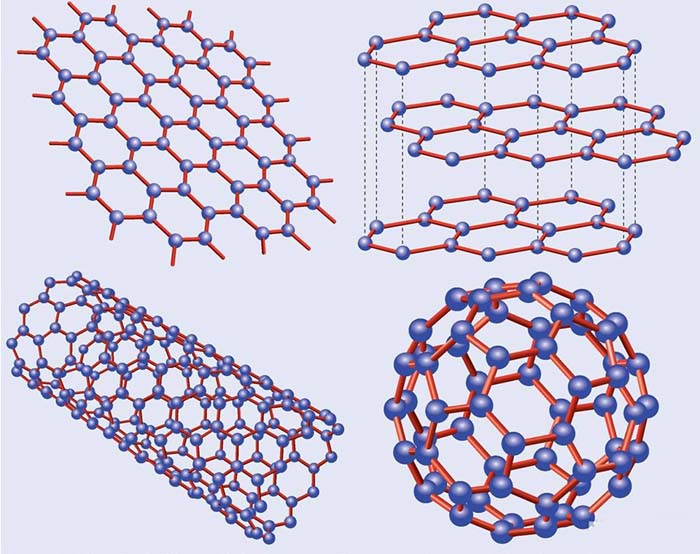
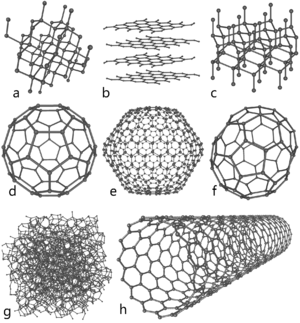
Аллотропные модификации углерода
Кристаллический углерод
Аморфный углерод
На практике, как правило, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода.
Кластерные формы
Структура
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода:
Графит и алмаз
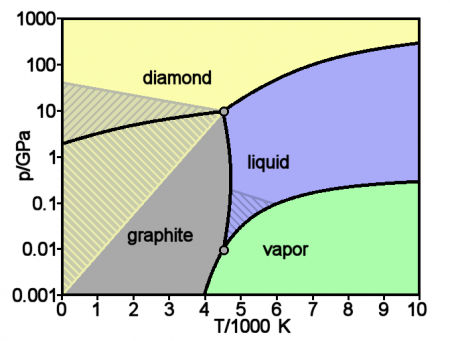
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. Термодинамический расчёт линии равновесия графит — алмаз на фазовой р, Т-диаграмме был выполнен в 1939 году О. И. Лейпунским. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается взрывообразно. ΔН0 перехода — 1,898 кДж/моль. Прямой переход графита в алмаз происходит при 3000 K и давлении 11—12 ГПа. При нормальном давлении углерод сублимируется при 3780 K.
Жидкий углерод
Жидкий углерод существует только при определённом внешнем давлении. Тройные точки: графит — жидкость — пар Т = 4130 K, р = 10,7 МПа и графит — алмаз — жидкость Т ≈ 4000 K, р ≈ 11 ГПа. Линия равновесия графит — жидкость на фазовой р, Т-диаграмме обладает положительным наклоном, переходящим по мере приближения к тройной точке графит — алмаз — жидкость в отрицательный, что связано с уникальными свойствами атомов углерода создавать углеродные молекулы, состоящие из различного количества атомов (от двух до семи). Наклон линии равновесия алмаз — жидкость, в отсутствие прямых экспериментов в области очень высоких температур (> 4000—5000 K) и давлений (> 10—20 ГПа), долгие годы считался отрицательным. Проведённые японскими исследователями прямые эксперименты и обработка полученных экспериментальных данных с учётом аномальности высокотемпературной теплоёмкости алмаза показали, что наклон линии равновесия алмаз — жидкость положителен, т. е. алмаз тяжелее своей жидкости (в расплаве он будет тонуть, а не всплывать как лёд в воде).
В мае 2019 года в журнале Physical Review Letters опубликована работа российских учёных из Объединенного института высоких температур РАН А. М. Кондратьева и А. Д. Рахеля, в которой физики первыми, впервые в мире детально изучили и измерили свойства жидкой формы углерода. Результаты физического эксперимента позволили получить новые данные, которые были недоступны исследователям в условиях компьютерного моделирования. Тонкая пластина высокоориентированного пиролитического графита с гексагональной осью, перпендикулярной его поверхности, была зажата между двумя пластинами особого материала и нагрета при давлении от 0,3 до 2,0 ГигаПаскалей. Оказалось, что температура плавления графита при этих условиях составляет 6300–6700 Кельвинов, что более чем на 1000° выше значений, предсказанных теоретически и на математических моделях. Исследователи впервые в мире точно измерили физические показатели процесса плавления углерода и свойства его жидкой фазы (удельное сопротивление, энтальпию плавления, изохорную теплоёмкость и многие другие показатели этого загадочного вещества. Они также обнаружили, что скорость звука в жидком углероде возрастает при уменьшении плотности.
Углерод III
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решёткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р63/mmc), плотность 3,51 г/см³, то есть такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
В 1980-е годы в СССР было обнаружено, что в условиях динамической нагрузки углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). В настоящее время всё чаще применяется термин «наноалмазы». Размер частиц в таких материалах составляет единицы нанометров. Условия образования УДА могут быть реализованы при детонации взрывчатых веществ со значительным отрицательным кислородным балансом, например, смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.). Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (−C≡C−), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9—2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно или тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 1960-х годов в Институте элементоорганических соединений Академии наук СССР. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц C60, C70, C80, C90, C100 и подобных (фуллерены), а также графенов, нанотрубок и сложных структур — астраленов.
Аморфный углерод (строение)
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь.
Графен
Графен — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp² связей в гексагональную двумерную кристаллическую решётку.
Углеродное кольцо
В 2019 г. впервые синтезирован один экземпляр молекулы, представляющей собой кольцо из 18 атомов углерода. В нем чередуются одинарные и тройные химические связи.
Нахождение в природе
Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода CO2, в воздухе 0,046 % CO2 по массе, в водах рек, морей и океанов в
60 раз больше. Углерод входит в состав растений и животных (
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Кругооборот углерода в природе включает биологический цикл, выделение CO2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоёв океанических вод, а также при дыхании, брожении, гниении. Биологический цикл состоит в том, что углерод в виде CO2 поглощается из тропосферы растениями в процессе фотосинтеза. Затем из биосферы он вновь возвращается в геосферу, частично через организмы животных и человека, и в виде CO2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
В природе встречается минерал шунгит, в котором содержится как твёрдый углерод (≈25 %), так и значительные количества оксида кремния (≈35 %).
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степень окисления бывает от −4 до +4. Сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С 0 к С 4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует с неметаллами при нагревании
| Реагент | Уравнение | Описание |
|---|---|---|
| O2 | 2C + O2 → to 2CO↑ 2CO + O2 → to 2CO2↑ | Продуктами горения углерода являются CO и CO2(монооксид углерода и диоксид углерода соответственно). Известен также неустойчивый недооксид углерода C3O2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты. На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит). |
| S Se | C + S → to CS2 C + Se → to CSe2 | При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. Получен селенид углерода CSe2. Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C. |
| Si | C + Si → to SiC | При сплавлении получается карбид кремния. |
| N2 | 2C + N2 → to (CN)2 | При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан. При высоких температурах взаимодействием углерода со смесью H2 и N2 получают синильную кислоту: Также такой же реакцией получают циан 2NH3 + 2CH4 → Pt (CN)2 + 7H2↑ |
| P | Не реагирует |
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения.
| Уравнение | Описание |
|---|---|
| C + H2O →to CO↑ + H2↑ | Важна в промышленности реакция углерода с водяным паром для получения синтез газа |
| 3C + S + 2KNO3 →to K2S + 3CO2↑ + N2↑ | Горение чёрного пороха. |
| 5C + 4KNO3 → 2K2CO3 + 3CO2↑ + 2N2↑ C + 2KNO3 → 2KNO2 + CO2↑ | С калиевой селитрой углерод проявляет восстановительные свойства. |
| 3C + BaSO4 → BaS + 2CO↑ + CO2↑ | Восстанавливает сульфат бария |
| C + MxOy → to M + CO↑ C + CaO → 2500oC CaC2 + CO↑ | При сплавлении углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности. |
С большинством металлов углерод образует карбиды, например:
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры, углеводы и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Применение
Графит используют в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Алмаз благодаря исключительной твердости — незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бурмашин. Кроме этого, ограненные алмазы — бриллианты — используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая себестоимость добычи алмазов ($97,47 за один карат) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности, углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является CO2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Токсическое действие
Углерод поступает в окружающую среду в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5 — 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)⋅10 9 Бк/сут 14 CO2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14 C, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами ( 14 C (β) → 14 N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14 С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0⋅10 4 Бк/л, предельно допустимое поступление через органы дыхания 3,2⋅10 8 Бк/год.