чем отличается коллаген 1 2 и 3 типов
Откройте для своей кожи 8 пищевых продуктов, богатых коллагеном
Влияние коллагена, что важно?
Коллаген является основным компонентом, который составляет основу соединительной ткани организма: мышц, сухожилий, связок, кожи, хрящей, суставов и т.д. Это один из главных компонентов, отвечающий за ь прочность и эластичности всей соединительной ткани, в том числе и стенок кровеносных сосудов и сердца.
С возрастом выработка коллагена постепенно снижается. Примерно после 35-40 лет выработка коллагена в организме сокращается, что может вызывать проблемы (дряблость и провисание кожи, появление морщин). Кроме того, снижение выработки коллагена может привести к таким заболеваниям как: остеоартрит, боли в суставах и мышцах.
Преимущества коллагена для кожи
К основным преимуществам коллагена для кожи относятся:
Продукты, которые улучшают выработку коллагена в коже
Не секрет, что для того, чтобы организм получал все необходимые витамины и питательные вещества, питание должно быть разнообразным и сбалансированным. Употребление достаточного количества жидкости также влияет на выработку коллагена и гидратации кожи. Это самый простой и доступный способ поддерживать выработку коллагена.
Не существует никаких чудодейственных препаратов и средств для кожи, но есть те, которые способствуют повышению упругости кожи и позволяют ей выглядеть здоровой.
Мы составили список продуктов, которые способствуют выработке коллагена:
1. Животный белок: мясо и рыба
В белке животного происхождения (мясо, субпродукты, желатин животного происхождения) содержится большое количество коллагена.
Важно избегать полуфабрикатов.
Эксперты рекомендуют употреблять мясо красного цвета умеренно (не более одного раза в неделю).
Рыба, особенно лосось, тунец или форель с высоким содержанием омега-3 жирных кислот естественно повышает концентрацию коллагена (также являясь полезными для костей и суставов).
2. Фрукты и овощи
А фрукты богатые витамином С необходимы для производства коллагена: апельсин, киви, грейпфрут, манго, ананас и некоторых других. Например, лимон не стимулирует производство коллагена, но и действует, как антиоксидант.
3. Яйца
Яйца являются лучшей пищей для нашей кожи, ведь в них большая концентрация ценных белков и витаминов группы В, Е, аминокислот и серы).
4. Сухофрукты и орехи
Арахис, грецкие орехи, фисташки, миндаль также стимулирует выработку коллагена.
5. Молочные продукты
Молочные продукты (молоко, сыр, йогурт и т.д.) благотворно влияют на производство коллагена благодаря высокому содержанию белка.
6. Серные продукты
Нужно употреблять в пищу продукты, которые содержат серу в своём составе (чеснок, лук, сельдерей, огурцы, оливки, виноград) они тоже обеспечивают хороший уровень коллагена в организме.
7. Чай
Чай (зеленый, белый, черный или красный) является натуральным антиоксидантом, который предотвращает снижение коллагена в нашем организме.
8. Желе
Желатин в организме превращается в коллаген и это тоже ценный источник животного белка.
Масло Bio-Oil способствует улучшению эластичности вашей кожи
Употребляйте в пищу полезные продукты и не забывайте про ритуал красоты с использованием масла Bio-Oil утром и вечером для сохранения красоты и молодости вашей кожи.
Научная электронная библиотека
1.2. Коллаген
Коллагены составляют основу структуры кожи, костей, хрящей, сухожилий, кровеносных сосудов и играют важную роль в сохранении нормальной структуры и функции соединительной ткани всех животных (Слуцкий, 1969, 1985; Риггз, Мелтон, 2000; Руденская, 2003).
Коллаген (К) – нерастворимый фибриллярный белок, первичная структура которого складывается из повторяющихся последовательностей триплетов аминокислот глицин-X-Y, где X и Y позиции чаще заняты, соответственно, пролином и гидроксипролином. Эти повторяющиеся последовательности позволяют трем коллагеновым полипептидам (называемым α-цепями) формировать полужесткие, очень стабильные трехспиральные молекулы (рис. 3). Они могут быть гомополимерными (три идентичные α-цепи) и гетерополимерными (две или три разные α-цепи). Под влиянием регулярно располагающихся остатков пролина и оксипролина цепь принимает форму ломаной спирали; это обусловливается жесткостью боковых групп пролина, а также тем обстоятельством, что пептидные связи, в образовании которых участвуют пролин и оксипролин, не могут образовать водородных связей. Остатки глицина образуют межцепочечные водородные связи, способствующие сохранению прочности структуры коллагена.


Рис. 3. Структура коллагена: а – электронная микрофотография коллагена соединительной ткани. Расстояние между повторяющимися структурными единицами равно 700 Å; б – конформация полипептидных цепей в трёхцепочечной молекуле тропоколлагена; в – ступенчатое расположение молекул тропоколлагена обусловливает появление в гидратированных волокнах коллагена повторяющихся структурных единиц, расстояние между которыми равно 700 Å (по Мусил и др., 1984)
Аминокислотные цепи коллагена обернуты друг вокруг друга и образуют «трехволоконный канат», где отдельные волокна связаны между собой водородными связями. Такая пространственная структура возможна, только если аминокислотная последовательность строго соблюдается.
В результате образуется трехволоконная фибриллярная молекула – тропоколлаген, обладающая большой прочностью на растяжение. Это название происходит от слова тропос – обращенный внутрь – из-за того, что коллагеновые волокна всех соединительных тканей, выстланы тропоколлагеновыми молекулами, соединенными «конец в конец» и «бок о бок» – в шахматном порядке. Гидроксильные группы некоторых остатков лизина и оксилизина участвуют в образовании связи между соседними молекулами тропоколлагена. Таким образом, формируется жесткое нерастяжимое волокно. Фибробласты синтезируют молекулы тропоколлагена и выбрасывают их в матрикс, и только здесь происходит сборка коллагеновых волокон (рис. 4).
Коллагены кожи содержат в больших концентрациях пролин и оксипролин (около 20 % от всех остальных аминокислот), глицин и аланин (свыше 50 % от содержания других аминокислотных остатков), ароматические и серосодержащие аминокислоты практически отсутствуют или содержатся в весьма малых количествах. Кроме того, коллаген является одним из немногих белков, содержащих оксипролин и оксилизин. Оксипролин и оксилизин образуются в молекуле проколлагена не в результате биосинтеза, а при гидроксилировании пролина и лизина, которое начинается в период трансляции коллагеновой мРНК на рибосомах (Неклюдов, 2003).
Рис. 4. Строение фибробласта и основные этапы синтеза коллагена. Г – аппарат Гольджи; Я – ядро; ШЭР – шероховатый эндоплазматический ретикулум; СП –секреторный пузырек; ТК – тропоколлаген; КВ – коллагеновое волокно
В настоящее время идентифицировано более 25 различных α-цепей, из которых формируется до 14 разных типов коллагеновых молекул, некоторые из них являются тканеспецифичными (Ленинджер, 1974; Риггз, Мелтон, 2000).
Таким образом, коллагены – это белки, которые:
б) могут состоять из трех цепей с повторяющимися последовательностями, обладающими способностью к сворачиванию в характерную тройную спираль. По меньшей мере, 19 белков определены в настоящее время как принадлежащие к коллагенам. 10 родственных им белков содержат коллагеноподобные домены.
Коллагеновые белки составляют около половины массы сухого вещества суставного хряща; вблизи суставной поверхности их концентрация приближается к 90 %. В других видах хрящевой ткани коллагены количественно преобладают над другими белками, обеспечивая прочность на растяжение и разрыв. (Слуцкий, 1985). Количественно преобладающим белком протеогликанового комплекса хрящевой ткани является коллаген второго типа (КII). Он в незначительных количествах обнаружен в других специализированных тканях, например, в стекловидном теле глаз некоторых видов животных. Хрящевой ткани присущ необычный полиморфизм коллагеновых компонентов, проявляющийся присутствием большого числа минорных коллагенов. Молекулярная формула КII хрящевой ткани имеет следующий вид: [α1(ΙΙ)]3, что означает наличие трех идентичных α1(II)-цепей, которые отличаются от α1(I)-цепей более высоким содержанием оксилизина. Столь высокая концентрация оксилизина способствует увеличению количества связанных с ним углеводов. По-видимому, такая структура обеспечивает большую сольватную оболочку коллагена типа II по сравнению с типами I или III. В процессе биосинтеза коллагена С-пропептиды соединяются между собой бисульфидными мостиками и после отщепления от молекулы образуют белок, который называется хондрокальцин, с м.м. около 100 000 Да (Слуцкий, 1985).
Коллаген одиннадцатого типа (КXI) составляет приблизительно 3 % хрящевого коллагена и образован двумя разными типами цепей (формула молекулы α1(XI)2 α2(XI)). Со старением организма его количество в хряще уменьшается в пользу коллагена пятого типа (КV) (Канунго, 1982; Риггз и Мелтон, 2000).
Для хрящевой ткани характерно наличие наибольшего количества минорных коллагеновых компонентов. Такой полиморфизм коллагенов позволяет считать минорные компоненты регуляторами адаптационной пластичности хряща, метаболизма хондроцитов и морфогенетических процессов (Слуцкий, 1985).
Содержание коллагена в различных тканях и органах сельскохозяйственных животных (КРС, свиньи) характеризуют следующие данные (% от массы сухого вещества): дерма – 80–90; ахиллово сухожилие – 86; костная ткань – 17,5–25; хрящи – 46–67; роговица и склера глаз – 70; мышцы – 10. При этом коллаген составляет от 25 до 33 % от общего количества белка (Титов, Апраксина, 1995). У костистых рыб коллагеновые белки преобладают в коже, сухожилиях, плавательном пузыре; у кольчатых червей и иглокожих в кожно-мускульном мешке; у моллюсков в кожных покровах и опорных хрящевых элементах.
Наиболее изучены свойства коллагенов в коже и мышечной ткани рыб. Коллаген кожи костистых рыб характеризуется частой встречаемостью молекул, состоящих из трех генетически различающихся α-цепочек, гетеротримера α1 α2 α3; среди изученных позвоночных животных цепочка α3 отмечена лишь у костистых рыб. В целом коллагены мышечной ткани костистых рыб, полученные методом электрофореза, идентичны соответствующим коллагенам типа I из кожи и имеют сходный аминокислотный состав. Однако коллагены мышечной ткани рыб более устойчивы к тепловой денатурации (более 100 °С), чем коллагены кожи, что объясняется более высокой степенью гидроксилирования пролина в мышечном коллагене. Термальная устойчивость мышечного коллагена определяется видом рыбы и по мере ее возрастания рыб можно расположить в следующем порядке: карп, угорь, скумбрия, сайра, кета.
В табл. 1 приведены данные о содержании коллагена и гексозаминов в соединительных тканях различных видов животных.
Составы субъячеек коллагена I типа из мышечной ткани и кожи являются идентичными у угря, скумбрии, сайры и карпа и отличаются у кеты. У последней коллаген кожи состоит из α1 α2 α3 гетеротримеров, а основная часть мышечного коллагена – из (α1)2α2 гетеротримеров (Богданов, Сафронова, 1993).
Содержание гексозаминов и коллагена в соединительной ткани животных
Чем отличается коллаген 1 2 и 3 типов
С.И. Суркичин (1), Е.А. Коган (2), Л.С. Холупова (1)
1) Центральная государственная медицинская академия УДП РФ, Москва, Россия; 2) Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва, Россия
Введение
Кожа – это уникальный орган человеческого организма. Она является защитным барьером и первой встречает агрессивное воздействие окружающей среды, поэтому первые признаки старения отмечаются на наименее закрытых участках – лице и руках. Внешний вид кожи влияет на психоэмоциональное состояние и качество жизни человека.
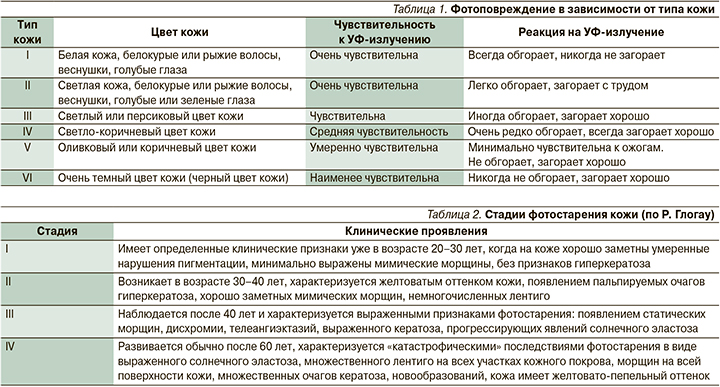
Факторы внешней среды могут по-разному сказываться на состоянии здоровья кожи как органа и на ее внешнем виде. Основным повреждающим внешним фактором в настоящее время считается ультрафиолетовое (УФ) излучение, которое приводит к раннему появлению возрастных изменений (не связанных с внутренним процессом старения). Фотоповреждение – это сложный биологический процесс. Его степень зависит от индивидуальных особенностей, в т.ч. от типа кожи (типы кожи по Фицпатрику, табл. 1).
Фотостарение – симптомокомплекс, включающий ряд признаков, характеризующих изменения эпидермиса, дермы и сосудов, возникающие вследствие длительного УФ-излучения. Процесс фотостарения характеризуется клиническими, гистологическими и биохимическими признаками, имеющими отличия от хронологического старения областей кожного покрова, закрытых от воздействия ультрафиолетовых лучей [1].
Клинически выделяют IV стадии фотостарения кожи (по Р. Глогау, табл. 2).
Старение кожи происходит в соответствии с общими закономерностями возрастной инволюции (биологическое или хронологическое старение), а также под действием факторов внешней среды, наибольшее значение из которых имеет УФ-излучение (фотоповреждение и фотостарение кожи). Процессы старения напрямую отражаются на состоянии коллагенового каркаса дермы. H.S. Talwar, C.E. Griffiths, G.J. Fisher, T.A. Hamilton, J.J. Voorhees в своем исследовании количественно оценили связь между уровнями проколлагена типа 1 и типа 3 и степенью фотоповреждения кожи человека. Поскольку проколлагены 1-го и 3-го типов являются молекулами – предшественницами зрелого коллагена, их уровни обычно отражают таковой биосинтеза коллагена. Сравнивали их количество на открытых участках кожи (предплечье) и закрытых (подмышечная или ягодичная области). В группе с незначительным фотоповреждением уровень проколлагена 3-го типа не отличался, а проколлагена 1-го типа был меньше на 16% на фотоповрежденном участке. В группе с сильным фотоповреждением уровни проколлагена типов 1 и 3 были значительно снижены (приблизительно на 40%) [2].
Коллаген – основной структурный белок межклеточного матрикса. Он составляет 25–33% от общего количества белка в организме, т.е.
6% массы тела. У человека 50% всего коллагена содержится в костях, где он составляет 90% органического матрикса. Вторая половина сосредоточена в коже, соединительной ткани, хрящах, стенках сосудов, базальных мембранах и т.д. В разных тканях преобладают разные типы коллагена, а это в свою очередь определяется той ролью, которую коллаген играет в конкретном органе или ткани.
В коже (дерме) коллагеновые волокна организованы в трехмерную сеть фибрилл, особенно хорошо развитую в участках кожи, которые испытывают сильное давление (кожа подошв, локтей, ладоней). Коллагеновые волокна малорастяжимы, однако благодаря определенному образу переплетения позволяют коже значительно растягиваться без повреждения [3].
Общее содержание коллагена уменьшается с увеличением возраста. Сразу после рождения в нормальной коже человека деградация коллагена 3-го типа превышает его образование. Синтез коллагена 1-го типа в нормальной коже человека доминирует до 8 лет, а затем имеет противоположную тенденцию [4].
С возрастом коллагеновые волокна не утолщаются, однако их количество увеличивается, причем отмечается увеличение соотношения коллагена типов 3/1 в сторону коллагена 3-го типа [5].
На протяжении всей жизни человека содержание коллагена уменьшается примерно на 1% в год, причем соотношение типов коллагена меняется в сторону увеличения содержания коллагена типа 3 – прежде всего за счет уменьшения содержания коллагена типа 1. Иммуногистохимические исследования дермы после инсоляции показывают снижение коллагенов 1-го и 3-го типов на 20–30%, что может быть следствием, с одной стороны, усиленного распада, с другой – уменьшения его синтеза фибробластами [6].
Одним из актуальных способов воздействия при фотоповреждении кожи является фотодинамическая терапия (ФДТ). Она представляет собой метод воздействия, основанный на системном или местном применении фотосенсибилизаторов в комплексе со световым или лазерным излучением различной длины волны, базирующийся на достижениях квантовой физики, фотохимии и фотобиологии, включающий 3 компонента: фотосенсибилизатор и квант света (экзогенные факторы), и генерируемые в результате их взаимодействия через каскад биохимических реакций активные формы кислорода, главным образом синглетный (экзогенный фактор).
Известно более 1000 соединений, способных выступать в качестве фотосенсибилизаторов. К трем основным группам относятся хлорины, порфирины и фталоцианины [7].
В настоящее время ведется поиск новых, более эффективных фотосенсибилизаторов в различных классах органических красителей, прежде всего среди порфиринов и их синтетических аналогов. Хлорины (дигидропорфирины) характеризуются сильным возрастанием интенсивности длинноволновой полосы и ее смещением в красную область по сравнению с порфиринами [8].
Хлорин Е6 (трисмеглуминовая соль) является мощным фотосенсибилизатором с полосой поглощения в красной области спектра с длиной волны 660±2 и 405±2 нм (генерируемой аппаратом на сверхъярких светодиодах – LED, либо соответствующим полупроводниковым лазером). После нанесения препарата на кожу происходит накопление на мембранах клеточных структур пораженной ткани производных хлорина Е6. Воздействие на эти клетки светом в интервале длин волн (660±2 нм), совпадающих со спектром поглощения производных хлорина Е6, приводит к активации клеточных и гуморальных факторов иммунной системы человека.
Спектр поглощения хлорина E6 в видимой области спектра характеризуется наличием высокоинтенсивной полосы Cope (Soret) c =403 нм, характерной для всех порфиринов, наличием плато в интервале длин волн =450–615 нм с небольшими пиками в области 504 нм, 533 и 599 нм, а также явно выраженным пиком с=653 нм [12].
Фотодинамическая терапия широко применяется в лечении фотоповреждений кожи и связанных с этим заболеваний. В ряде исследований показано, что после фотодинамического воздействия с использованием 5-аминолевулиновой кислоты (АЛА ФДТ) происходит увеличение количества коллагена 1-го типа за счет активации фибробластов [9].
При исследовании результатов ФДТ in vitro отмечены увеличение синтеза коллагена, уменьшение синтеза эластина, индуцирование активации внеклеточных сигнал-регулирующих киназ, что приводит к увеличению количества коллагена 1-го типа, а также к активации матриксных металлопротеиназ 3-го типа – ММП-3 [10].
Предполагается, что увеличение ММП-3 способствует деградации и удалению поврежденного коллагена, в то время как фибробласты активируются для синтеза нового. Важную роль играют эпителиально-мезенхимальные взаимоотношения со стимуляцией кератиноцит-индуцированного синтеза цитокинов в фибробластах [11].
Цель исследования
В своем эксперименте мы оценили количество коллагена 1-го и 3-го типов до и после курса сеансов ФДТ с использованием фотосенсибилизатора на основе хлорина Е6.
Методы
Исследовались панч-биоптаты околоушной области 3 женщин 38–45 лет с признаками фотостарения кожи II–III стадий (до и после проведения курса процедур ФДТ с использованием хлорина Е6 1 раз в 7 дней, № 5).
Биоптаты фиксировались в 10%-ном нейтральном формалине, заливались в парафин по общепринятой методике. Серийные парафиновые срезы окрашивались по Ван-Гизону. Определялись иммуногистохимические показатели: коллаген 1-го и 3-го типов.
Процедуры проводились 1 раз в 7 дней 5 раз. Фотосенсибилизатор – топическое средство на основе фотосенсибилизирующего комплекса последнего поколения сферометаллохлорина (производное хлорина Е6). Источник света – LED-лампа с возможностью генерировать излучение 410 нм, 580 и 630 нм.
Перед процедурой использовались средства с эксфолиативным и очищающим действиями (очищающий гель с папаином) для лучшего проникновения фотосенсибилизатора в кожу. После 30-минутной экспозиции топического средства с хлорином Е6 проводилось световое воздействие с использованием длин волн 410 нм 15 минут+630 нм 15 минут 2 пациентками (общее время – 30 минут) или 410 нм 15 минут+630 нм 15 минут 1 пациенткой (общее время – 30 минут).
Панч-биопсия в заушной области проводилась до начала курса процедур и сразу после последнего сеанса.
Результаты
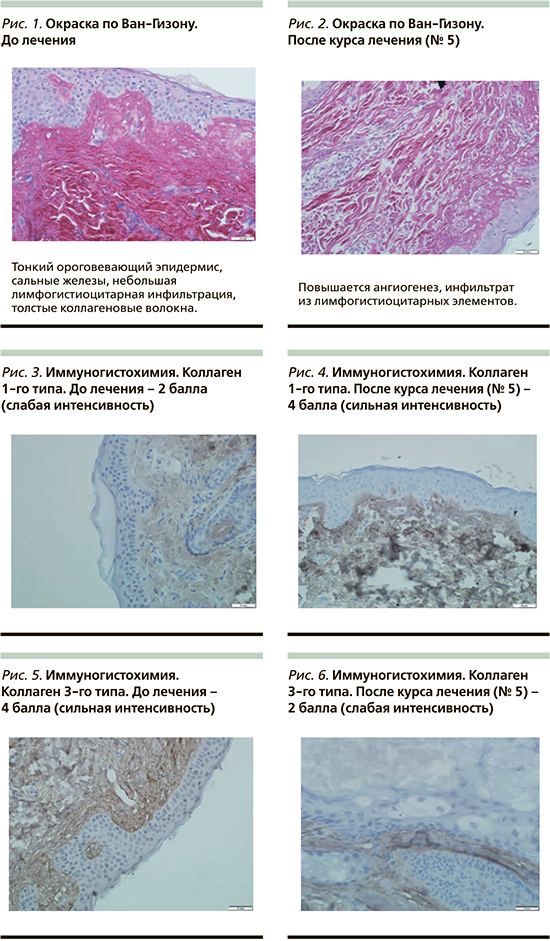
Результаты исследования представлены на рис. 1–6.
Полученные данные при проведении процедур с параметрами воздействия 410+630 нм 2 пациенткам и 410+630 нм 1 пациентке сопоставимы. В гистологических образцах, взятых до воздействия, наблюдается тонкий ороговевающий эпидермис, присутствуют сальные железы, небольшая лимфогистиоцитарная инфильтрация, толстые коллагеновые волокна. При иммуногистохимическом исследовании экспрессия коллагена 1-го типа имеет слабую интенсивность (2 балла), экспрессия коллагена 3-го типа – сильную интенсивность (4 балла). В гистологических образцах, взятых после воздействия, наблюдается тонкий ороговевающий эпидермис, по сравнению с образцом «до» повышается ангиогенез, имеется инфильтрат из лимфогистиоцитарных элементов. При иммуногистохимическом исследовании экспрессия коллагена 1-го типа имеет сильную интенсивность (4 балла), экспрессия коллагена 3-го типа – слабую интенсивность (2 балла).
Обсуждение
В результате проведения курса процедур 1 раз в 7 дней, № 5, наблюдается повышение количества коллагена 1-го типа и уменьшение количества коллагена 3-го типа. Это происходит за счет активации макрофагов, которые выделяют ММП, расщепляющие избирательно коллаген 3-го типа. Полученные нами результаты совпадают с исследованиями, проведенными с использованием АЛА ФДТ, в которых зарегистрировано усиление синтеза коллагена 1-го типа за счет активации фибробластов [9]; с исследованием действия АЛА ФДТ in vitro, где отмечено увеличение синтеза коллагена, уменьшение синтеза эластина, индуцирование активации внеклеточных сигнал-регулирующих киназ, что приводит к активации ММП-3 [10].
В своем исследовании мы использовали производные хлорина Е6 для фотосенсибилизации и получили аналогичные результаты. Это может свидетельствовать о том, что для восстановления соотношения коллагенов 1-го и 3-го типов при коррекции возрастных изменений вследствие фотостарения ключевым фактором является образование активных форм кислорода, которое происходит при ФДТ и служит сутью данного воздействия.
Заключение
Таким образом, можно заключить, что воздействие ФДТ при фотостарении приводит к нормализации соотношения коллагена 1-го и 3-го типов. Использование производных хлорина Е6 в качестве фотосенсибилизатора приводит к изменениям, аналогичным использованию 5-аминолевулиновой кислоты в отношении коллагена 1-го и 3-го типов и может быть рекомендовано для клинического применения.
Литература
1. Кубанов А.А., Жилова М.Б., Кубанова А.А. Фотостарение кожи: механизмы развития, особенности клинических проявлений. Вестник дерматологии и венерологии. 2014;5:53–9.
2. Talwar H.S., Griffiths C.E., Fisher G.J., et al. Reduced type I and type III procollagens in photodamaged adult human skin. J Invest Dermatol. 1995;105(2):285–90. Doi: 10.1111/1523-1747.ep12318471.
3. Потехина Ю.П. Структура и функции коллагена. Российский остеопатический журнал. 2016;1–2(32–33):87–99.
4. Rong Y.H., Zhang G.A., Wang C., Ning F.G. Zhonghua Shao Shang Za Zhi. 2008;24(1):51–3.
5. Целуйко С.С., Малюк Е.А., Красавина Л.С., Корнеева Н.П. Морфофункциональная характеристика дермы кожи и еe изменения при старении. Бюллетень физиологии и патологии дыхания. 2016;60:111–66.
6. Fisher G.J., Datta S.С., Таlwar H.S., et al. Molecular basis of sun-induced premature skin ageing and retinoid antagonism. Nature. 1996;379:335–39. Doi: 10.1038/379335a0.
7. Баткаев Э.А., Кузьмин С.Г., Димитриади О.В., Бакурова В.А., Набатникова Н.Е. Опыт применения фотодинамической терапии с препаратом фотосенс в дерматологии. РМЖ. 2013;8:406.
8. Лукьянец Е.А. Поиск новых фотосенсибилизаторов для фотодинамической терапии. Фотодинамическая терапия и фотодиагностика. 2013;2(3):3–16.
9. Marmur E.S., Phelps R., Goldberg D.J. Ultrastructural changes seen after ALA-IPL photorejuvenation: a pilot study. J Cosmet Laser Ther. 2005;7:21–4. Doi: 10.1080/147641700510037725.
10. Jang Y.H., Koo G.B., Kim J.Y., et al. Prolonged activation of ERK contributes to the photorejuvenation effect in photodynamic therapy in human dermal fibroblasts. J Invest Dermatol. 2013;133:2265–75. Doi: 10.1038/jid.2013.25.
11. Kim S.K., Koo G.B., Kim Y.S., Kim Y.C. Epithelial-mesenchymal interaction during photodynamic therapy- induced photorejuvenation. Arch Dermatol Res. 2016;308:493–501. Doi: 10.1007/s00403-016-1666-3.
12. Клименко И.В., Лобанов А.В. Спектрально-флуоресцентные свойства хлорина е6 в различных супрамолекулярных системах. Актуальные вопросы биологической физики и химии. 2016;2:71–4.