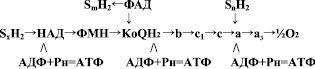чем обусловлено движение протонов по цепи ферментов тканевого дыхания
Обмен веществ и энергии
Процесс распада сложных веществ на более простые называется катаболизмом. Так, поступающие в пищей белки, жиры, углеводы под действием ферментов пищеварительного тракта распадаются на более простые составные части (аминокислоты, жирные кислоты и моносахариды). При этом высвобождается энергия. Обратный процесс, т. е. синтез сложных соединений из более простых называется анаболизмом. Он идет с затратой энергии. Из образовавшихся в результате пищеварения аминокислот, жирных кислот и моносахаридов в клетках синтезируются новые клеточные белки, фосфолипиды мембран и полисахариды.
Существует понятие амфиболизм, когда одно соединение разрушается, но при этом синтезируется другое.
Интенсивность метаболизма определяется потребностью клетки в тех или иных веществах или энергии, регуляция осуществляется четырьмя путями:
1) Суммарная скорость реакций определенного метаболического пути определяется концентрацией каждого из ферментов этого пути, значением рН среды, внутриклеточной концентрацией каждого из промежуточных продуктов, концентрацией кофакторов и коферментов.
2) Активностью регуляторных (аллостерических) ферментов, которые обычно катализируют начальные этапы метаболических путей. Большинство из них ингибируется конечным продуктом данного пути и этот вид ингибирования называется «по принципу обратной связи».
4) Гормональная регуляция. Ряд гормонов способны активировать или ингибировать многие ферменты метаболических путей.
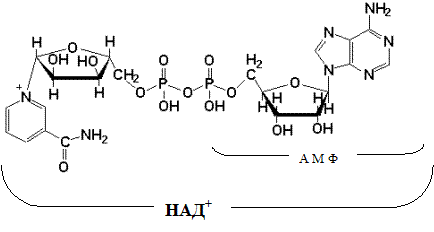
Живые организмы представляют собой термодинамически неустойчивые системы. Для их формирования и функционирования необходимо непрерывное поступление энергии в форме, пригодной для многопланового использования. Для получения энергии практически все живые существа на планете приспособились подвергать гидролизу одну из пирофосфатных связей АТФ. В связи с этим одна из главных задач биоэнергетики живых организмов это восполнение использованных АТФ из АДФ и АМФ.
Это процесс потребление клетками тканей организма кислорода, который участвует в биологическом окислении. Такой вид окисления называют аэробным окислением. Если конечным акцептором в цепи переноса водорода выступает не кислород, а другие вещества (например пировиноградная кислота), то такой тип окисления называют анаэробным.
Т. о. любое соединение может отдавать электроны только соединению с более высоким окислительно-восстановительным потенциалом. В дыхательной цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее.
Дыхательная цепь состоит из:
2. ФАД- зависимой дегидрогеназы;
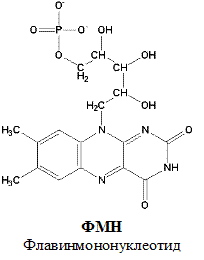
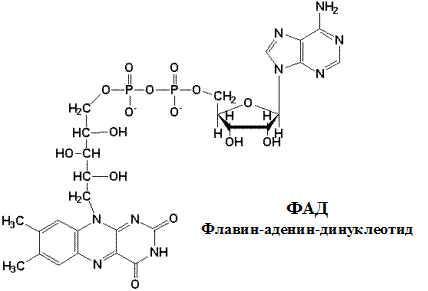
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 ( ФАД ).
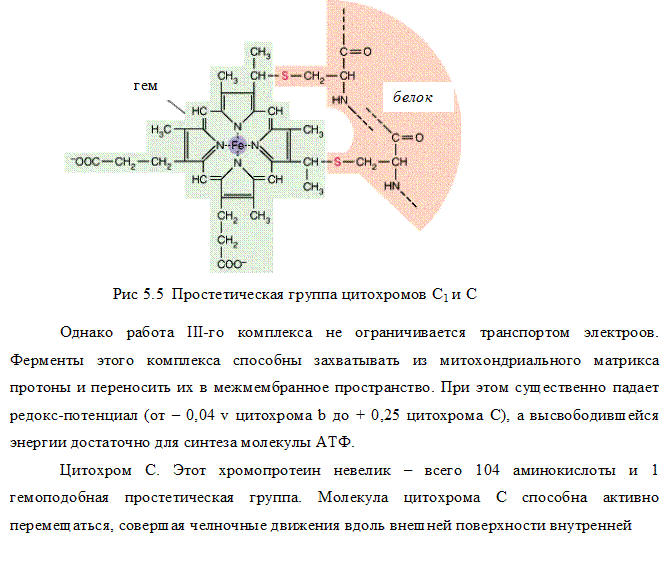
В цитохроме с порфириновая плоскость ковалентно связана с белком через два остатка цистеина, а в цитохромах b и а , она ковалентно не связано с белком.
В цитохроме а+ а3 (цитохромоксидазе) вместо протопорфирина содержатся порфирин А, который отличатся рядом структурных особенностей. Пятое координационное положение железа занято аминогруппой, принадлежащей остатку аминосахара, входящего в состав самого белка.
В отличии от гема гемолгобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов (См. подробнее приложение 1 «Атомная и электронная структура гемопротеинов «).
Механизм работы электронтранспортной цепи
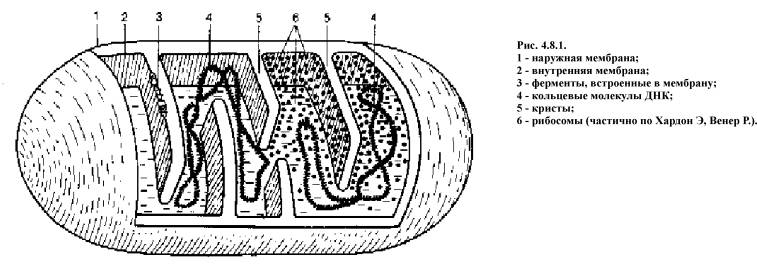
Наружная мембрана митохондрии (рис. 4.8.1) проницаема для большинства мелких молекул и ионов, внутренняя почти для всех ионов (кроме протонов Н) и для большинства незаряженных молекул.
Такая молекула содержит в себе три макроэргических связи. Макроэргической или богатой энергией называют химическую связь, при разрыве которой высвобождается более 4 ккал/моль. При гидролитическом расщеплении АТФ до АДФ и фосфорной кислоты высвобождается 7,3 ккал/моль. Ровно столько же тратится для образования АТФ из АДФ и остатка фосфорной кислоты и это один из основных путей запасания энергии в организме.
В процессе транспорта электронов по дыхательной цепи высвобождается энергия, которая тратится на присоединение остатка фосфорной кислоты к АДФ с образованием одной молекулы АТФ и одной молекулы воды. В процессе переноса одной пары электронов по дыхательной цепи высвобождается и запасается в виде трех молекул АТФ 21,3 ккал/моль. Это составляет около 40 % высвободившейся при электронном транспорте энергии.
Такой способ запасания энергии в клетке называется окислительным фосфорилированием или сопряженным фосфорилированием.
Молекулярные механизмы этого процесса наиболее полно объясняет хемоосмотическая теория Митчелла, выдвинутая в 1961 году.
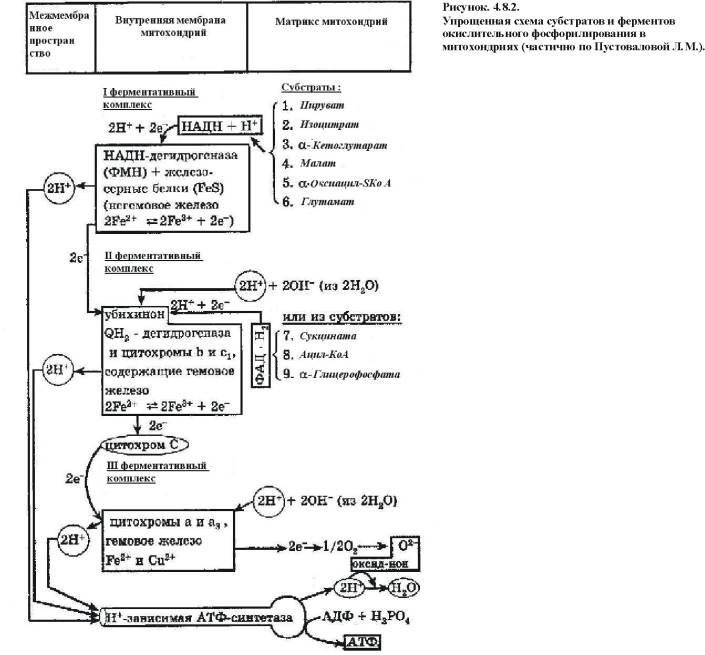
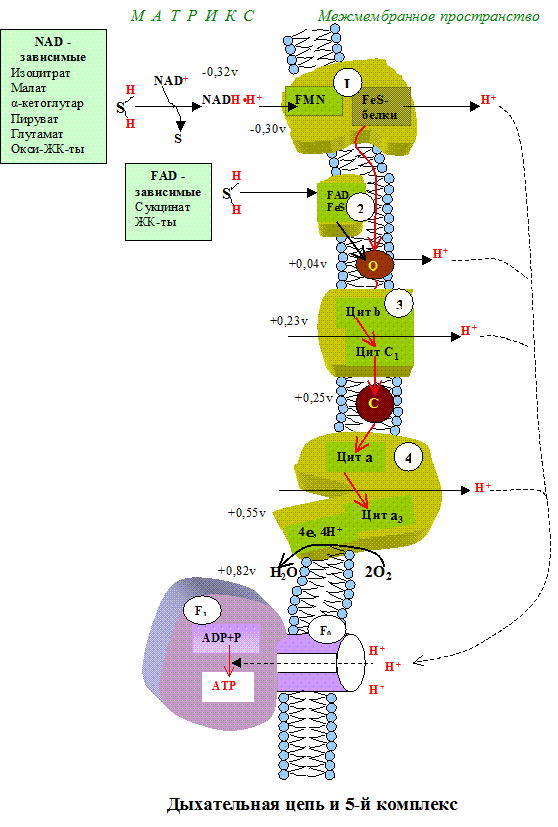
Механизм окислительного фосфорилирования (рис.4.8.2.):
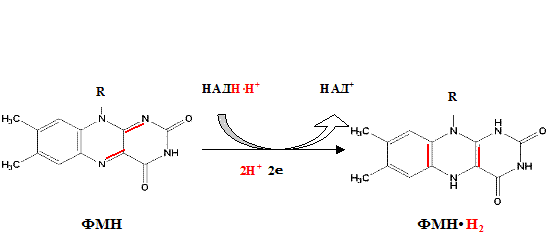
1) НАД-зависимая дегидрогеназа расположена на матриксной поверхности внутренней мембраны митохондрий отдает пару электронов водорода на ФМН-зависимую дегидрогеназу. При этом из матрикса пара протонов переходит также на ФМН и в результате образуется ФМН Н2. В это время пара протонов, принадлежащих НАД выталкивается в межмембранное пространство.
2) ФАД-зависимая дегидрогеназа отдает пару электронов на Ко Q а пару протонов выталкивает в межмембранное пространство. Получив электроны Ко Q принимает из матрикса пару протонов и превращается в Ко Q Н2.
3) Ко Q Н2 выталкивает пару протонов в межмембранное пространство, а пара электронов передается на цитохромы и далее на кислород с образованием молекулы воды.
В итоге при переносе пары электронов по цепи из матрикса в межмембранное пространство перекачивается 6 протонов (3 пары), что ведет к созданию разницы потенциалов и разницы рН между поверхностями внутренней мембраны.
4) Разница потенциалов и разница рН обеспечивают движение протонов через протонный канал обратно в матрикс.
5) Такое обратное движение протонов ведет к активации АТФ-синтазы и синтезу АТФ из АДФ и фосфорной кислоты. При переносе одной пары электронов (т.е. трех пар протонов) синтезируется 3 молекулы АТФ (рис. 4.7.3.).
Образовавшаяся АТФ из матрикса в цитоплазму переносится ферментами транслоказами, при этом в обратном направлении в матрикс переносится одна молекула АДФ и одна молекула фосфорной кислоты. Понятно, что нарушение транспорта АДФ и фосфата тормозит синтез АТФ.
Скорость окислительного фосфорилирования зависит в первую очередь от содержания АТФ, чем быстрее она расходуется, тем больше накапливается АДФ, тем больше потребность в энергии и следовательно активнее идет процесс окислительного фосфорилирования. Регуляцию скорости окислительного фосфорилирования концентрацией в клетке АДФ называют дыхательным контролем.
1. Бышевский А. Ш., Терсенов О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С. Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Ленинджер А. Биохимия. Молекулярные основы структуры и функций клетки // М.: Мир, 1974, 956 с.;
4. Пустовалова Л.М. Практикум по биохимии // Ростов-на Дону: Феникс, 1999, 540 с.;
5. Степанов В. М. Молекулярная биология. Структура и функции белков // М.: Высшая школа, 1996, 335 с.;
6. Скулачев В. П. Энергетика биологических мембран // М.: Наука, 1989, 565 с.;
7. Карякин А. В., Арчаков А. И. Межмембранный перенос электронов // Успехи современной биологии, 1981, Т. 91, вып. 1, с. 74-89;
© И н с т и т у т Ф и з и к и
им. Л.В.Киренского 1998-2007
[an error occurred while processing this directive]
Чем обусловлено движение протонов по цепи ферментов тканевого дыхания
А. Компоненты дыхательной цепи
Б. Организация дыхательной цепи
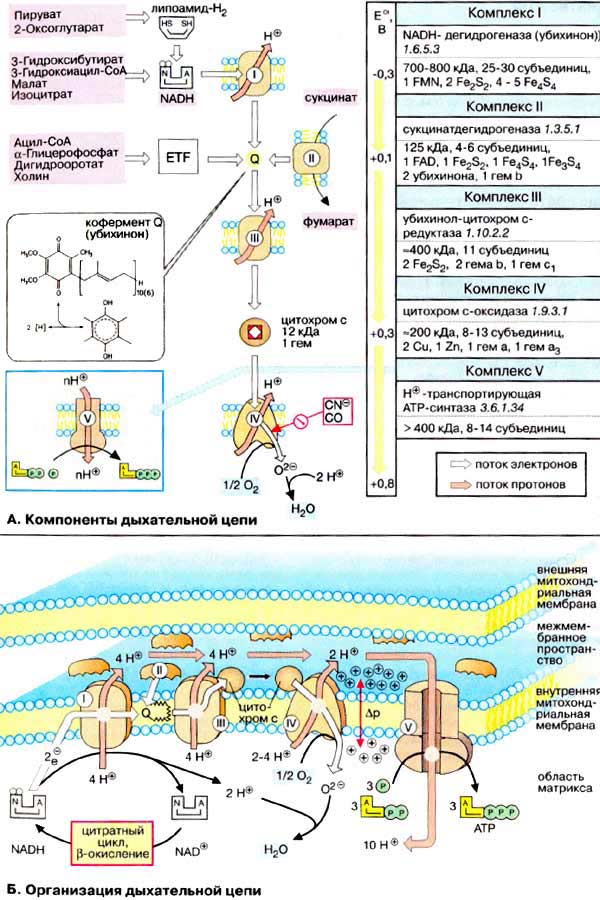
Как уже упоминалось, все комплексы с I по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они не контактируют друг с другом, так как электроны переносятся убихиноном и цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O 2 и образование АТФ (ATP). Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство (см. с. 214), откуда через порины проникает в цитоплазму.
Научная электронная библиотека
Тапбергенов С. О., Тапбергенов Т. С., Советов Б. С.,
4. Стресс и биоэнергетические процессы
Гибкость стрессорных реакций зависит от функциональной взаимосвязи различных звеньев нейроэндокринных регуляторных механизмов и биоэнергетических процессов. Энергия, превращение энергии в организме, относится к числу тех явлений, с которыми все живые системы и различные биологические процессы, в том числе и процессы успешной адапатации, неразрывно и постоянно связаны и зависимы.
Жизнь может существовать и развиваться только за счет поступления свободной энергии. Этот приток энергии обеспечивается непрерывным обменом веществ между организмом и окружающей средой. Все что мы видим, слышим и чувствуем, есть проявление какой-либо формы энергии, которая трансформируется в организме человека и других живых системах из поступающих извне разнообразных питательных веществ, энергия в которых представлена в форме химических связей между атомами органических молекул.
Трансформированная из химической формы, энергия метаболизирующихся органических соединений используется для осуществления всех функций клеток и органов, для обеспечения всех физиологических процессов организма, для обеспечения механизмов адаптации к стрессу.
Процессы, трансформирующие энергию в клетке, главным образом, сосредоточены в митохондриях. В митохондрииях быстро и очень экономно осуществляется процесс окисления различных субстратов путем отщепления атома водорода (протон и электрон). Тем самым обеспечивается трансформация химической энергии окисляемых субстратов вначале в разность редокс-потенциалов и электрохимический мембранный потенциал, возникающий за счет градиента концентрации протонов на мембране, затем на процесс окислительного фосфорилирования, завершающийся синтезом АТФ (P. Mitchel, 1961, 1967, 1974).
Способность митохондрий в процессе окисления субстратов составлять градиент концентрации протонов на внутренней мембране, как унифицированной форме трансформации энергии химической связи в энергию электрохимического мембранного потенциала (Mitchell P., 1961, В.П. Скулачев, 1972), приводит к изменению рН внутренней срезы, что открывает возможность для некоторых ферментов включаться в регуляцию энергетического обмена. Одним из таких ферментов является Н+-АТФ-аза.
В этом процессе также участвуют ферменты, осуществляющие дегидрогеназную реакцию и перенос протонов и электронов на конечный акцептор – кислород. Все эти ферменты структурно организованы в дыхательную митохондриальную цепь:
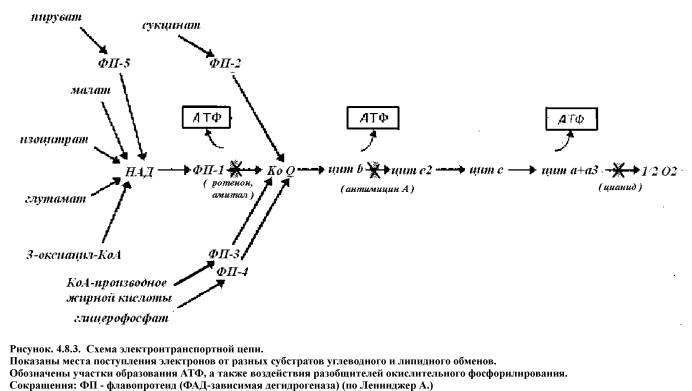
В начале дыхательной цепи митохондрий находятся анаэробные дегидрогеназы, коферментом которых является НАД или НАДФ. К этой группе относятся дегидрогеназы окисляющие пируват, изоцитрат, альфа-кетоглутарат, малат, глутамат, b-гидроксиацил-КоА и некоторые другие субстраты (SхH2). Далее располагаются НАДН-дегидрогеназа, относящаяся к флавиновым аэробным дегидрогеназам, кофермент которых ФМН. Здесь же к дыхательной цепи примыкают другие флавиновые дегидрогеназы с коферментом ФАД (сукцинатдегидрогеназа, глицерофосфатдегидрогеназа, ацил-КоА-дегидрогеназа), окисляющие соответствующие субстраты (SmH2).
Всеобщим коллектором атомов водорода в дыхательной цепи является убихинон (КоQ). Далее дыхательная цепь представлена ферментами цитохромной системы: цитохром b, c1, c, a, a3. На уровне цитохрома С также возможно окисление субстратов (SnH2), например адреналин и аскорбат.
Перемещение электронов и протонов происходит по градиенту окислительно-восстановительного (редокс) потенциала, который отражает величину свободной энергии окисления в соответствующей редокс-системе. Величина редокс-потенциала компонентов дыхательной цепи возрастает от НАД (–0,32 в) до кислорода (+0,82 в). Общая разность редокс-потенциалов в дыхательной цепи составляет 1,14 в. Такое количество свободной энергии, высвобождающейся при переносе двух электронов от НАД Н2 на кислород достаточно для синтеза трех молекул АТФ.
Синтез АТФ осуществляется на уровне трех участков дыхательной цепи митохондрий, где имеется достаточной величины разность редокс-потенциалов. Первый участок находится между НАД и ФМН, где разность редокс-потенциалов равна 0,21 в, второй – между цитохромом b и с, разность 0,22 в и третий между цитохромоксидазой (а + а3) и кислородом, разность редокс-потенциалов равна 0,29 в.
При окислении одной молекулы субстрата на один атом поглощенного митохондриями кислорода может использоваться от одного до трех молекул фосфорной кислоты и синтезироваться при этом 1, 2 или 3 молекулы АТФ.
Зависимость скорости дыхания от фосфорилирования может быть нарушена различными физическими и химическими агентами. При этом транспорт электронов и поглощение кислорода митохондриями протекает независимо от фосфорилирования. Это явление получило название разобщения окислительного фосфорилирования.
Разобщение окислительного фосфорилирования имеет место и при некоторых постстрессорных функциональных состояниях оргнизма: при охлаждении голодании при переутомлении при травматическом шоке, инфаркте миокарда при тиреотоксикозе, опухолях, при рентгеновском облучении и радиационном поражении (К.П. Хансон, 1965, В.С. Петров и др., 1966).
Особое место в дыхательной цепи занимает сукцинатдегидрогеназа (СДГ), субстрат которой, янтарная кислота, способен «монополизировать» дыхательную цепь, обращать движение электронов на первом участке сопряжения дыхания и фосфорилирования.
На внутренней мембране митохондрий имеется фермент моноаминоксидаза (МАО), дезаминирующий биогенные амины с образованием аммонийного иона, который согласно многочисленным исследованиям способен, изменняя рН, включаться в регуляцию окислительного фосфорилирования, вызывая разобщение, блокировать цикл трикарбоновых кислот на уровне окисления альфа-кетоглутарата. Аммонийный ион снижает активность цитохромоксидазы, окисление сукцината, пирувата, лактата и АТФ-азы.
Источником аммиака в тканях момогут быть аденин, аденозин, АМФ, АДФ, НАД, а также амидные группы белков (Г.Х. Бунатян и др., 1967). Особое место в превращении адениловых нуклеотидов и аденозина занимают дезаминазы, которые способны не только приводить к образованию аммиака, но и выключать АМФ, АДФ и даже АТФ из системы регуляции дыхания и фосфорилирования.
Таким образом, энергетический обмен представляет собой сложный механизм катаболитических процессов, локализованных главным образом в митохондриях всех клеток, работающих как термодинамическая машина, извлекающая свободную энергию химически связей в процессе окисления субстратов и трансформирующих ее в электрохимический мембранный потенциал и затем в энергию химических связей макроэргических соединений.
В тоже время конкретное участие вышеперечисленных систем, характер их взаимоотношений в процессе формирования эмоционально-стрессорного состояния, прогностическое значение отдельных показателей и их комплексов остаются недостаточно изученными. В этом отношении недостаточно изучены нарушения биоэнергетических процессов при стрессе, обеспечивающих все уровни адаптационных механизмов.
Предположительно, что при действии на организм чрезвычайных раздражителей естественным образом происходит перестройка биоэнергетики клетки. В связи с высокой дифференцировкой клеток различных тканей и органов, отношение последних к энергетическим трансформациям неодинаково. Но вместе с тем, при стрессовых состояниях имеет место одинаковая направленность изменений энергетического обмена. Например, при травматическом шоке, при гипотермии, радиации, имеет место изменение функций митохондрий, разобщение окислительного фосфорилирования. Установлено, что неспецифические стрессовые нагрузки выводят энергетический обмен на границу физиологического уровня, переводя его в низкоэнергезированное состояние.
Показано, что одной из наиболее стойкой к повреждению является система окисления янтарной кислоты (сукцинатдгидрогеназа), которая, например, при инфаркте миокарда повреждается в меньшей степени и восстанавливается более полно, чем система НАД-зависимых дегидрогеназ (Т.В. Фетисова, Р.А. Фролькис., 1976). Авторы считают, что окисление янтарной кислоты становится основным энергодающим процессом, восполняющим ущерб запасов макроэргов при стрессорных поражениях миокарда.
Как было показано нашими исследованиями (С.О. Тапбергенов, 1987), при нейрогенном стрессе, вызванным трехчасовой электростимуляцией дуги аорты в митохондриях сердца почти вдвое возрастает активность сукцинатдегидрогеназы, фермента монополизирующего дыхательную цепь (табл. 7). При нейрогенном стрессе активируется терминальный фермент дыхательной цепи цитохром-с-оксидаза и фермент, ответственный за синтез и распад АТФ – Mg-активируемая АТФ-аза. Возростает активность АМФ-дезаминазы, контролирующий уровень АМФ и аденозина, увеличивается активность моноаминоксидазы А и В-типа (табл. 7).
Активность ферментов митохондрий сердца при нейрогенном стрессе, вызванным электростимуляцией дуги аорты
Дыхательная цепь



Строение дыхательной цепи (ДЦ), комплексы, ингибиторы. Механизм работы. Пункты сопряжения, величина ОВП компонентов ДЦ. Коэффициент Р/О, его значение.
Поэтапное «контролируемое сгорание» достигается путём промежуточного включения дыхательных ферментов, обладающих различным редокс-потенциалом. Редокс-потенциал (окислительно-восстановительный потенциал) определяет направление переноса протонов и электронов ферментами дыхательной цепи (рис.1).
Редокс-потенциал выражается значением электродвижущей силы (в вольтах), которая возникает в растворе между окислителем и восстановителем, присутствующих в концентрации 1,0 моль/л при 25? С (при рН=7,0 оба находятся в равновесии с электродом, который может обратимо принимать электроны от восстановителя). При рН=7,0 редокс-потенциал системы Н2 /2Н + +2? равен – 0,42 v. Знак – означает, что данная редокс-пара легко отдаёт электроны, т.е. играет роль восстановителя, знак + указывает на способность редокс-пары принимать электроны, т.е. играть роль окислителя. Например, редокс-потенциал пары НАДН?Н + / НАД + равен – 0,32 v, что говорит о высокой её способности отдавать электроны, а окислительно-восстановительная пара ½О2 /Н2О имеет наибольшую положительную величину +0,81 v, т.е. кислород обладает наивысшей способностью принимать электроны.
В процессе окисления АцКоА в ЦТК, восстановленные формы НАДН2 и ФАДН2 поступают в ДЦ, где энергия электронов и протонов трансформируется в энергию макроэргических связей АТФ.
Принципы функционирования ДЦ основаны на 1-ом и 2-ом законах термодинамики.
1. Пара НАД-Н имеет ОВП = 0,32 В.
ДЦ локализуется во внутренней мембране митохондрий и имеет 2 пути введения электронов и протонов или 2 входа; ДЦ образует 4 комплекса.
1 вход: НАД-зависимый (поступают электроны и протоны со всех НАД-зависимых реакций).
2 вход: ФАД-зависимый
Дыхательная цепь – форма реализации биологического окисления.
Тканевое дыхание – это последовательность окислительно-восстанови-тельных реакций, протекающих во внутренней митохондриальной мембране с участием ферментов дыхательной цепи. Дыхательная цепь имеет чёткую структурную организацию, её компоненты формируют дыхательные комплексы, порядок расположения которых зависит от величины их редокс-потенциала (рис.5.1). Количество дыхательных цепей в отдельно взятой митохондрии из клеток разных тканей неодинаково: в печени – 5000, в сердце – около 20 000, следовательно, миокардиоциты отличаются более интенсивным дыханием, чем гепатоциты.
|
Прежде чем остановиться на характеристике каждого из компонентов дыхательной цепи, познакомимся с субстратами тканевого дыхания.
Субстраты тканевого дыхания подразделяются на 2 группы:
1. НАД-зависимые – субстраты цикла Кребса изоцитрат, α-кетоглутарат и малат. Это также пируват, гидроксибутират и β–гидрокси-ацил
КоА, глутамат и некоторые другие аминокислоты. Водород от НАД-зависимых субстратов c помощью НАД-зависимых дегидрогеназ передаётся на I-й комплекс дыхательной цепи.
2. ФАД-зависимые – сукцинат, глицерол-3-фосфат, ацил
КоА и некоторые другие. Водород от ФАД-зависимых субстратов передаётся на II-й комплекс дыхательной цепи.
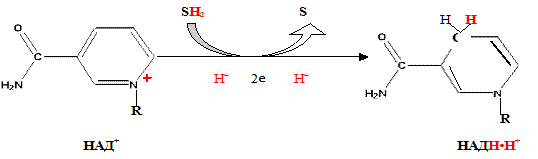
При дегидрировании субстратов НАД-зависимыми дегидрогеназами образуется восстановленная форма НАД (НАДH?H + ).
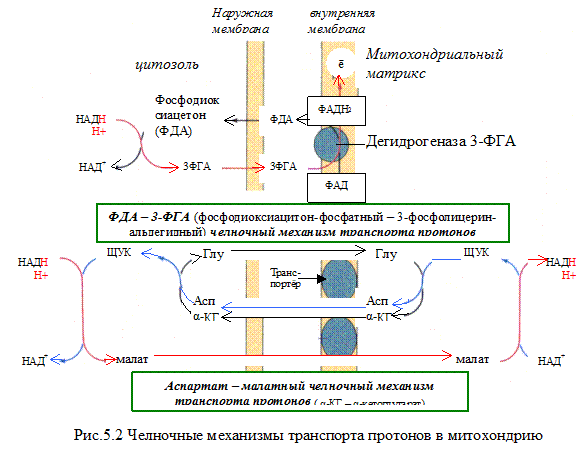
НАДH?H + может образовываться не только в митохондриях, но и в цитозоле клетки при протекании определённых процессов метаболизма. Однако цитоплазматический кофермент не может проникать в митохондрии. Водород восстановленного кофермента должен быть сначала перенесен на субстраты, которые могут проникать в митохондрии. Такими «Н2-переносящими субстратами» являются:
Дигидроксиацетон фосфат → глицерол-3-фосфат
НАДH?H + затем окисляется 1-м комплексом дыхательной цепи. Рассмотрим работу этого комплекса.
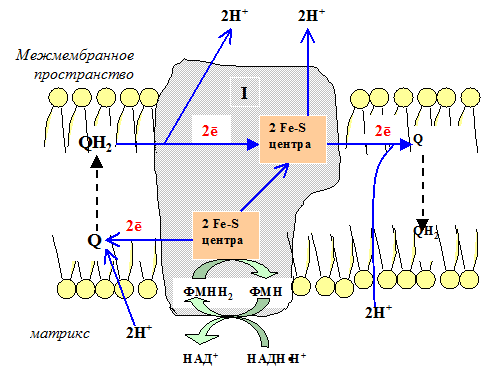
Первый комплекс является самым большим в дыхательной цепи (представлен 23-30 субъединицами). Он катализирует перенос водорода от НАДH?H + на убихинон (рис. 5.1 и рис. 5.3). В его состав входят кофермент ФМН (флавинмононуклеотид) и железосерные белки, содержащие негеминовое железо. Функция этих белков заключается в разделении потока протонов и электронов: электроны переносятся от ФМН?Н2 к внутренней поверхности внутренней мембраны митохндрий (обращенной к матриксу), а протоны – к внешней поверхности внутренней мембраны и затем высвобождаются в митохондриальный метрикс.
При транспорте протонов и электронов редокс-потенциал первого комплекса снижается на 0,38 v, что вполне достаточно для синтеза АТФ. Однако в самом комплексе АТФ не образуется, а высвобождающаяся в результате работы комплекса энергия аккумулируется (см. ниже образование электро-химического потенциала) и частично рассеивается в виде тепла.
По своему строению ФМН – мононуклеотид, в котором азотистое основание представлено изоаллоксазиновым ядром рибофлавина, а пентозой является рибитол (иными словами, ФМН – это фосфорилированная форма витамина В2).
Функция ФМН заключается в акцепции 2 атомов водорода от НАДH?H + и передачи их железосерным белкам. Водород (2 электрона и 2 протона) присоединяется к атомам азота изоаллоксазинового кольца, при этом происходит внутримолекулярная перегруппировка двойных связей с образованием промежуточного семихинона – соединения свободнорадикальной природы (на схеме представлено суммарное уравнение реакции, где R – остальная часть молекулы)
II комплекс цепи тканевого дыхания –сукцинат-убихинон-оксидоредуктаза.
Этот комплекс имеет меньшую молекулярную массу и также содержит железосерные белки. Сукцинат-убихинон-оксидоредуктаза катализирует перенос водорода от сукцината на убихинон. В состав комплекса входит кофермент ФАД (флавин-аденин-динуклеотид) и фермент сукцинатдегидрогеназа, который является одновременно ферментом цикла Кребса. Ацил
SКоА, 3-фосфо-глицерат и диоксиацетон фосфат также являются ФАД-зависимыми субстратами тканевого дыхания и с помощью этого кофермента контактируют со вторым комплексом.
Рис. 5.3 Первый комплекс дыхательной цепи
Энергия включения водорода субстратов во II комплекс цепи тканевого дыхания рассеивается в основном в виде тепла, так как на этом участке цепи редокс-потенциал снижается незначительно и этой энергии для синтеза АТФ мало.
Процесс восстановления ФАД протекает аналогично таковому ФМН.
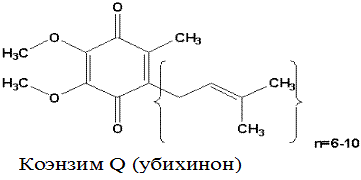
Убихинон (коэнзим Q). Убихинон – небольшая липофильная молекула, по химическому строению представляющая собой бензохинон с длинной боковой цепью (число изопреноидных единиц колеблется от 6 у бактерий до 10 у млекопитающих).
Восстановленная форма убихинона – убихинол – передаёт протоны и электроны на III комплекс дыхательной цепи.
 |
Цитохромоксидаза имеет высокую степень сродства к кислороду и может работать при его низких концентрациях.
Между НАД и ФП, b-c, a-a3 имеет место max перепад ОВП. Эти пункты являются местом синтеза АТФ (местом фосфорилирования АДФ).
III комплекс цепи тканевого дыхания –убихинол-цитохром С-оксидоредуктаза. В состав III комплекса входят цитохромы b и с1, относящиеся к группе сложных белков хромопротеинов. Простетическая группа этих белков окрашена (chroma – краска) и близка по химическому строению к гему гемоглобина. Однако в противоположность гемоглобину и оксигемоглобину, в которых железо должно быть только в 2-х валентной форме, железо в цитохромах при работе дыхательной цепи переходит от двух- к трёхвалентному состоянию (и обратно).
Как видно из названия, III комплекс переносит электроны от убихинола на цитохром С. Вначале электроны поступают на окисленную форму цитохрома b (Fe 3+ ), который при этом восстанавливается (Fe 2+ ), затем восстановленный цитохром b передаёт электроны окисленной форме цитохрома с, который также восстанавливается и, в свою очередь, передаёт электроны цитохрому С.
|
IV комплекс дыхательной цепи – цитохром С-оксидаза. Комплекс назван оксидазой из-за способности непосредственно взаимодействовать с кислородом. У млекопитающих этот крупный (
200 kD) трансмембранный белок состоит из 6-13 субъединиц, из которых некоторые кодируются митохондриальной ДНК. В состав IV комплекса входят 2 хромопротена – цитохром а и цитохром а3. В отличие от других цитохромов, цитохромы а и а3каждый содержат не только атом железа, но и атом меди. Медь в составе этих цитохромов при транспорте электронов также попеременно переходит в окисленное (Cu 2+ ) и восстановленное (Cu + ) состояние.
Цитохром с-оксидаза катализирует одноэлектронное окисление 4-х восстановленных молекул цитохрома си при этом одновременно осуществляет полное (4-х электронное) восстановление молекулы кислорода:
Протоны для образования молекул воды поступают из матрикса. Следует заметить, что эта реакция весьма сложна и протекает через промежуточные стадии образования свободных радикалов кислорода.
Окислительно-восстановительный потенциал IV комплекса является самым большим (+0,57 v), его энергии вполне достаточно для синтеза 3-х молекул АТФ, однако большая часть этой энергии используется на «перекачивание» протонов из матрикса митохондрий в межмембранное пространство. В связи с активным транспортом протонов цитохром с-оксидаза получила название «протонного насоса».
Таким образом, тканевое дыхание представляет собой процесс транспорта электронов и протонов от НАД- или ФАД-зависимых субстратов на кислород, а также протонов, поставляемых матриксом митохондрий. При транспорте падает редокс-потенциал, что сопровождается высвобождением заключённой в субстратах тканевого дыхания энергии. Полное восстановление молекулярного кислорода воздуха в дыхательной цепи сопровождается образованием воды.