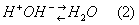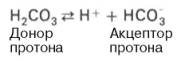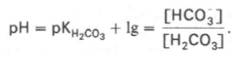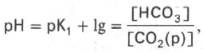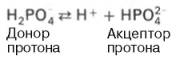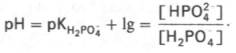чем образованы буферные системы
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Быстрая компенсация сдвигов рН
Буферные системы
Существует три буферные системы жидкостей организма – бикарбонатная, фосфатная, белковая (включая гемоглобиновую).Они вступают в действие моментально и через несколько минут их эффект достигает максимума возможного.
Фосфатная буферная система
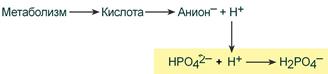
Фосфатная буферная система составляет около 2% от всей буферной емкости крови и до 50% буферной емкости мочи. Она образована гидрофосфатом (HPO4 2– ) и дигидрофосфатом (H2PO4 – ). Дигидрофосфат слабо диссоциирует и ведет себя как слабая кислота, гидрофосфат обладает щелочными свойствами. В норме отношение HРO4 2– к H2РO4 – равно 4 : 1.
При взаимодействии кислот (ионов Н + ) с двузамещенным фосфатом (HPO4 2‑ ) образуется дигидрофосфат (H2PO4 – ):
Удаление ионов H + фосфатным буфером
В результате концентрация ионов Н + понижается.
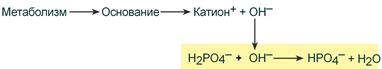
При поступлении в кровь оснований (избыток ОН – ‑групп) они нейтрализуются поступающими в плазму от H2PO4 – ионами Н + :
Удаление щелочных эквивалентов фосфатным буфером
Роль фосфатного буфера особенно высока во внутриклеточном пространстве и в просвете почечных канальцев. Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата (H 2 PO 4 – ), т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Бикарбонатная буферная система
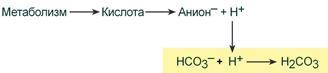
Эта система самая мощная, на ее долю приходится 65% всей буферной мощности крови. Она состоит из бикарбонат-иона (НСО3 – ) и угольной кислоты (Н2СО3). В норме отношение HCO3 – к H2CO3 равно 20 : 1.
При поступлении в кровь ионов H + (т.е. кислоты) ионы бикарбоната натрия взаимодействуют с ней и образуется угольная кислота:
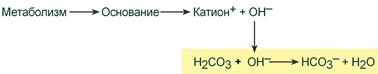
Если в кровь поступают вещества с щелочными свойствами, то они реагируют с угольной кислотой и образуют ионы бикарбоната:
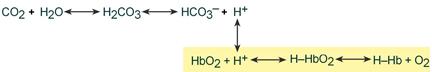
Работа бикарбонатного буфера неразрывно связана с дыхательной системой (с вентиляцией легких). В легочных артериолах при снижении плазменной концентрации СО2 и благодаря присутствию в эритроцитах фермента карбоангидразы угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Белковая буферная система
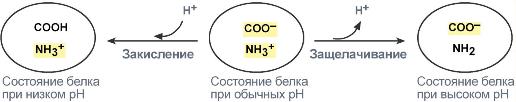
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. Их вклад в буферизацию плазмы крови около 5%.
В щелочной среде усиливается диссоциация COOH‑групп, поступающие в плазму ионы Н + связывают избыток ОН – ‑ионов и pH сохраняется. Белки в данном случае выступают как кислоты и заряжаются отрицательно.
Изменение заряда буферных групп белка при различных рН
Гемоглобиновая буферная система
Изменение кислотности гемоглобина происходит в тканях и в легких, и вызывается связыванием соответственно H + или О2. Непосредственный механизм действия буфера заключается в присоединении или отдаче иона H + остатком гистидина в глобиновой части молекулы (эффект Бора).
В тканях более кислый pH в норме является результатом накопления минеральных (угольной, серной, соляной) и органических кислот (молочной). При компенсации pH данным буфером ионы H + присоединяются к пришедшему оксигемоглобину (HbО2) и превращают его в H‑HbО2. Это моментально вызывает отдачу оксигемоглобином кислорода (эффект Бора) и он превращается в восстановленный H‑Hb.
В результате снижается количество кислот, в первую очередь Н2СО3, продуцируются ионы НСО3 ‑ и тканевое пространство подщелачивается.
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту более сильную, чем угольная. Она отдает свои ионы Н + в среду, предотвращая повышение рН:
Работу гемоглобинового буфера рассматривают неотрывно от бикарбонатного буфера:
Эффективность гемоглобинового буфера напрямую зависит от активности дыхательной системы (Газообмен в легких и тканях).
Введение в метрологию. Единство измерений. Контроль качества измерений. Аналитические технологии.в КЛД
Растворы
1. Концентрации раствора
Концентрацию растворов можно выражать следующими способами:
1. Процентная концентрация по массе (ω, %) — число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра.
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Молярность(См) — число моль (n) растворенного вещества, содержащихся в 1 л раствора:
С м = n/V.
3. Молярная концентрация эквивалента (нормальность)(СН):— число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
4. Моляльность(Сm) — число молей растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
5. Мольная доля(Ni) — отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
m растворенного компонента
Для еще более разбавленных растворов или более низких содержаний компонента результаты чаще представляют числом частей на мллиард:
m растворенного компонента
При еще меньших содержаниях компонента, оперируют триллионными долями:
Буферные системы
Полезное
Смотреть что такое «Буферные системы» в других словарях:
Буферные системы крови — (от англ. buffer, buff смягчать удар) физиологические системы и механизмы, обеспечивающие кислотно основное равновесие в крови[1]. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых… … Википедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Буферные растворы — см. Буферные системы … Большая советская энциклопедия
Буферный раствор — Буферные растворы (англ. buffer, от buff смягчать удар) растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и… … Википедия
Кислотно-щелочное равновесие — I Кислотно щелочное равновесие (синоним: кислотно основное равновесие, кислотно щелочной баланс, равновесие кислот и оснований) относительное постоянство концентрации водородных ионов во внутренних средах организма, обеспечивающее полноценность… … Медицинская энциклопедия
Кровь — I (sanguis) жидкая ткань, осуществляющая в организме транспорт химических веществ (в т.ч. кислорода), благодаря которому происходит интеграция биохимических процессов, протекающих в различных клетках и межклеточных пространствах, в единую систему … Медицинская энциклопедия
Гомеостаз — (др. греч. ὁμοιοστάσις от ὁμοιος одинаковый, подобный и στάσις стояние, неподвижность) саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций,… … Википедия
Электрофорез белков в полиакриламидном геле — Фотография полиакриламидного геля, иллюстрирующая разделение белков по молекулярной массе. Маркеры на левой дорожке У этого термина существуют и другие значения, см. Электрофорез в полиакриламидном геле. Электрофорез белков в полиакриламидном… … Википедия
Бу́ферные раство́ры — (синоним: буферные смеси, буферные системы, буферы) растворы с определенной концентрацией водородных ионов, содержащие сопряженную кислотно основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительных… … Медицинская энциклопедия
Буферные системы крови
Истинная концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного углекислого газа (СО2 + Н2О Н2СО3). Поэтому удобнее пользоваться тем вариантом уравнения, в котором рКH2СО3 заменена «кажущейся» константой диссоциации Н2СО3, учитывающей общую концентрацию растворенного СО2 в крови:
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4 – (донор протонов) и иона НРО4 2– (акцептор протонов):
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных. Для фосфатной буферной системы справедливо следующее уравнение:
Во внеклеточной жидкости, в том числе в крови, соотношение [НРО4 2– ]: [Н2РО4 – ] составляет 4:1. Величина рКН2РО4– равна 6,86.
Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО4 2– с образованием Н2РО4 – (Н + + + НРО4 2– —> Н2РО4 – ), а также ионов ОН – с ионами Н2РО4 – (ОН – + + Н2 Р О4 – —> HPO4 2– + H2O). Буферная пара (Н2РО4 – –НРО4 2– ) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9–7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2. Фосфатный буфер в крови находится в тесном взаимодействии с бикарбонатной буферной системой. Органические фосфаты также обладают буферными свойствами, но мощность их слабее, чем неорганического фосфатного буфера.
Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы.
Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н + (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.