чем обеспечивается высокое артериальное давление в капиллярах клубочков почки
Чем обеспечивается высокое артериальное давление в капиллярах клубочков почки
а) Увеличение коэффициента фильтрации в клубочках приводит к возрастанию СКФ. Кф — величина, учитывающая проницаемость и площадь фильтрационной поверхности капилляров клубочка. Напрямую его измерить невозможно, но из косвенных экспериментальных данных его рассчитывают как отношение скорости клубочковой фильтрации к результирующему фильтрационному давлению:
Кф = СКФ/Результирующее фильтрационное давление.
Поскольку СКФ для обеих почек — около 125 мл/мин, а результирующее фильтрационное давление составляет 10 мм рт. ст., нормальная величина Кф, рассчитанная по формуле, равна 12,5 мл/мин/мм рт. ст. Когда Кф рассчитывают на 100 г массы почки, он составляет около 4,2 мл/мин/мм рт. ст., что выше подобных коэффициентов для других капилляров почти в 400 раз. В среднем Кф во многих других тканях организма составляет лишь 0,01 мл/мин/мм рт. ст. на 100 г ткани. Такое высокое значение Кф в почке определяется очень большой скоростью фильтрации жидкости.
Несмотря на то, что высокий Кф способствует возрастанию СКФ, а низкий — снижению, изменение Кф, по всей видимости, не является основным определяющим моментом в повседневной регуляции СКФ. Однако при некоторых заболеваниях наблюдается снижение Кф либо за счет уменьшения числа функционирующих капилляров в клубочках (таким образом снижается площадь фильтрационной поверхности), либо в результате утолщения стенок капилляров и снижения проницаемости. Например, тяжелая артериальная гипертония и сахарный диабет сопровождаются постепенным снижением Кф вследствие утолщения базальных мембран капилляров клубочков, что в результате приводит к полной потере функций пораженных капилляров.
б) Возрастание гидростатического давления в капсуле Боумена снижает СКФ. Прямое измерение давления в капсуле Боумена и различных частях проксимального извитого канальца микропипеткой предполагает, что примерное значение давления в капсуле Боумена у человека в норме составляет 18 мм рт. ст. Увеличение давления в капсуле Боумена приведет к снижению СКФ, тогда как его уменьшение увеличивает СКФ. В норме изменения давления в капсуле Боумена не являются самостоятельным механизмом регуляции СКФ.
При некоторых патологических состояниях, сопровождаемых непроходимостью мочевых путей, давление в капсуле Боумена может значительно возрастать, приводя к значительному снижению СКФ. Например, осаждение солей кальция или мочевой кислоты может приводить к образованию мочевых камней, закупоривающих мочевые пути, чаще — в области мочеточников, что ведет к увеличению давления в капсуле Боумена. Это снижает СКФ и в итоге, если не восстановить проходимость мочевых путей, даже приводит к разрушению почки.
в) Возрастание онкотического давления в капиллярах клубочков снижает СКФ. Поскольку кровь из приносящей артериолы проходит через капилляры клубочка, направляясь к выносящему сосуду, концентрация белка возрастает примерно на 20%. Причиной роста онкотического давления является поступление примерно 1/5 объема жидкости из капилляров в капсулу Боумена, при этом белки в просвете капилляров клубочков концентрируются, поскольку не попадают в первичную мочу. Предположим, что онкотическое давление в плазме на входе в клубочек в норме составляет 28 мм рт. ст., достигая на выходе величины 36 мм рт. ст. Следовательно, онкотическое давление в капиллярах клубочка составит в среднем около 32 мм рт. ст.
Итак, на онкотическое давление влияют два фактора: (1) онкотическое давление белков плазмы крови; (2) объем плазмы, которая подвергается фильтрации в капиллярах клубочков (фракция фильтрации). Увеличение онкотического давления в артериальной крови увеличивает онкотическое давление в клубочках, что, в свою очередь, снижает СКФ.
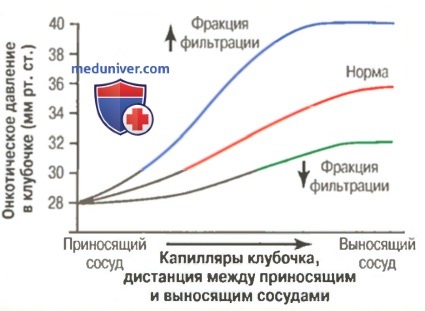
Увеличение фракции фильтрации также ведет к концентрированию белков и увеличивает онкотическое давление в клубочке (просим обратить внимание на рисунок выше). Поскольку фракция фильтрации определяется отношением СКФ к объему почечного плазмотока, она может быть увеличена за счет либо возрастания СКФ, либо снижения плазмотока. Например, снижение почечного плазмотока без первичных изменений СКФ будет способствовать увеличению фракции фильтрации, возрастанию онкотического давления и падению СКФ. По этой причине изменения почечного кровотока независимо от колебаний гидростатического давления в клубочках способны оказывать влияние на СКФ.
При возрастании почечного кровотока в клубочках вначале фильтруется небольшое количество плазмы, приводя к медленному возрастанию онкотического давления в капиллярах клубочков и слабому снижению СКФ. Таким образом, даже при постоянном уровне гидростатического давления в клубочках увеличение снабжения клубочков кровью ведет к возрастанию СКФ; уменьшение кровотока в почках приводит к уменьшению СКФ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Чем обеспечивается высокое артериальное давление в капиллярах клубочков почки
Одна из главных функций почек заключается в поддержании постоянства внутренней среды. У взрослых почки поддерживают точное соответствие между потреблением и выделением воды и растворенных веществ. Однако ребенку для развития необходим положительный баланс многих таких веществ, и баланс этот в разные возрастные периоды различен. Это предъявляет особенно высокие требования к функции почек у ребенка.
В то же время, хотя к 34-й неделе беременности число нефронов в почке плода становится таким же, как у взрослого, функциональное развитие почек даже к моменту рождения еще далеко от завершения. Постнатальные изменения функции почек касаются и почечного кровотока, и клубочковой фильтрации, и канальцевого транспорта.
У взрослых почечный кровоток составляет около 20% от сердечного выброса, а у плода во вторую половину беременности вплоть до рождения только 2%. Даже при перерасчете на площадь поверхности тела почечный кровоток у новорожденных составляет 15—20% от почечного кровотока у взрослых. Увеличение почечного кровотока в процессе роста частично обусловлено повышением сердечного выброса, но главная причина — снижение почечного сосудистого сопротивления в результате изменений почечных сосудов.
Реакции этих сосудов на сосудосуживающие и сосудорасширяющие вещества по мере развития также изменяются, но вклад этих изменений в снижение почечного сосудистого сопротивления невелик.
Почечный кровоток зависит от почечного сосудистого сопротивления и почечного перфузионного давления. У детей, как и у взрослых, почечный кровоток сохраняется постоянным в широком диапазоне колебаний АД. Эта так называемая ауторегуляция почечного кровотока обусловлена изменениями просвета почечных сосудов: так, при снижении АД уменьшается и почечное сосудистое сопротивление.
Благодаря этому свойству обеспечивается сохранность функции почек при артериальной гипотонии. Поскольку у детей АД ниже, чем у взрослых, у них меньше и диапазон колебаний АД, в котором действуют механизмы ауторегуляции; с возрастом этот диапазон увеличивается. У взрослых существует также эффективная ауторегуляция СКФ, тогда как у новорожденных при артериальной гипотонии СКФ значительно снижается.
Считается, что ауторегуляция СКФ обеспечивается ангиотензином II: при артериальной гипотонии он вызывает спазм эфферентных артериол, и благодаря этому СКФ поддерживается на прежнем уровне. Секреция ангиотензина II и его действие на эфферентные артериолы у новорожденных снижены, что и объясняет различия в эффективности ауторегуляции СКФ.
Клубочковая фильтрация начинается на стадии окончательной почки примерно на 9—12-й неделе беременности. СКФ у новорожденных ниже, чем у взрослых, даже при пересчете на площадь поверхности тела. У недоношенных в возрасте от зачатия (сумма срока беременности и постнатального возраста) 28—34 нед СКФ (по клиренсу креатинина) составляет всего 0,5 мл/мин; к 37-й неделе она повышается до 1 мл/мин, а у доношенных новорожденных составляет 2 мл/мин.
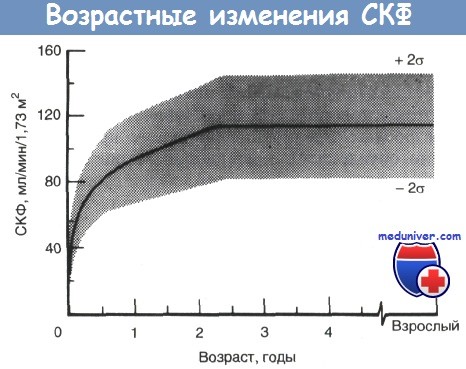
При пересчете на среднюю величину площади поверхности тела взрослого (1,73 м2) это составляет всего 30 мл/мин/1,73 м2. В первые месяцы жизни СКФ значительно увеличивается и к 1—2 годам достигает значений, сравнимых с таковыми у взрослых, — 100—120 мл/мин/1,73 м2. Для того чтобы понять причины этого возрастного увеличения СКФ, рассмотрим факторы, от которых зависит клубочковая фильтрация.
Клубочковая фильтрация обеспечивается разностью между градиентами гидростатического и онкотического давления по обе стороны капилляра клубочка. Эта разность, или фильтрационное давление, по ходу капилляра меняется. В проксимальном конце капилляра градиент гидростатического давления (разница между гидростатическим давлением в капилляре и в полости капсулы клубочка), способствующий фильтрации, существенно выше, чем градиент онкотического давления (разница между онкотическим давлением в капилляре и в полости капсулы клубочка), препятствующий фильтрации. В результате фильтрационное давление положительно (около 15 мм рт. ст.) и происходит фильтрация.
По мере прохождения крови по капилляру онкотическое давление в капилляре повышается (так как из-за образования безбелкового фильтрата увеличивается концентрация белка в крови), а гидростатическое давление снижается; в некоторой точке градиенты гидростатического и онкотического давления выравниваются и фильтрация прекращается. СКФ равна произведению фильтрационного давления на коэффициент фильтрации Kf. Последний, в свою очередь, равен произведению площади поверхности капилляра клубочка и его проницаемости для воды.
К механизмам, поддерживающим постоянство СКФ, относятся миогенная регуляция сопротивления приносящих артериол (спазм этих артериол при повышении АД и расширение при снижении АД) и канальцево-клубочковая обратная связь. Последняя обеспечивается деятельностью плотного пятна (macula densa) — группы клеток, расположенной в области толстого сегмента восходящей части петли Генле и примыкающей к приносящим и выносящим артериолам и клубочку того же нефрона. Увеличение или снижение СКФ сопровождаются параллельными изменениями доставки Na+ в клетки плотного пятна. Это активирует регуляторные механизмы, вызывающие обратные сдвиги СКФ, тем самым по механизму отрицательной обратной связи поддерживая ее постоянство. Важную роль в этих механизмах играет ангиотензин II.
Рост СКФ в постнатальном периоде частично обусловлен повышением фильтрационного давления и почечного кровотока. Однако основной вклад в этот рост вносит изменение коэффициента фильтрации. Хотя водная проницаемость (пористость) капилляров клубочков после рождения существенно не меняется, площадь поверхности этих капилляров значительно увеличивается, что и служит основной причиной возрастного увеличения СКФ.
Поскольку креатинин проходит через плаценту, сразу после рождения сывороточная концентрация этого вещества у ребенка такая же, как у матери. Следовательно, этот показатель не отражает функцию почек ребенка. Однако уже примерно через 48—72 ч после рождения сывороточная концентрация креатинина зависит от СКФ новорожденного и его мышечной массы (так как креатинин образуется в мышцах). Поскольку мышечная масса новорожденного относительно невелика, сывороточная концентрация креатинина снижается до 0,3— 0,5 мг%.
Скорость этого снижения определяется СКФ, которая, в свою очередь, зависит от гестационного возраста новорожденного. Точная оценка функции почек у новорожденных сложна. Диурез у новорожденных обычно составляет 1 мл/кг/ч. Однако он зависит не только от СКФ, но и от других факторов, и снижение диуреза не обязательно коррелирует со снижением СКФ. Последовательные определения сывороточной концентрации креатинина часто бывают лучшим способом определения функции почек у новорожденных.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Чем обеспечивается высокое артериальное давление в капиллярах клубочков почки
а) Возрастание гидростатического давления в клубочках увеличивает СКФ. В норме гидростатическое давление в капиллярах клубочков равно приблизительно 60 мм рт. ст. Колебание давления в клубочках имеет первостепенное значение в регуляции СКФ. Возрастание давления увеличивает СКФ, а снижение — уменьшает.
Гидростатическое давление в капиллярах клубочка определяется тремя переменными, каждая из которых находится под физиологическим контролем: (1) артериальное давление; (2) сопротивление приносящей артериолы; (3) сопротивление выносящей артериолы.
Возрастание артериального давления способствует увеличению гидростатического давления в клубочках и, следовательно, увеличению СКФ. (Как обсуждалось ранее, данный эффект компенсируется с помощью механизма саморегуляции, деятельность которого направлена на поддержание давления в клубочке на относительно постоянном уровне, поскольку артериальное давление периодически изменяется.)
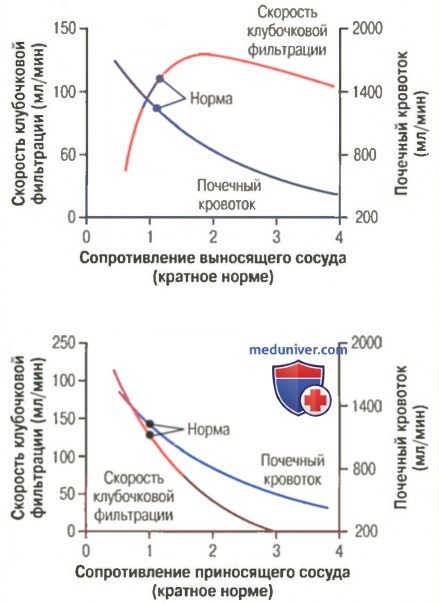
Увеличение сопротивления при сужении приносящих сосудов снижает гидростатическое давление в клубочках и уменьшает СКФ. Напротив, расширение приносящих сосудов приводит к увеличению обоих параметров: гидростатического давления и СКФ.
Сужение выносящих артериол увеличивает сопротивление на входе из клубочка, что приводит к возрастанию давления в клубочках, а поскольку увеличение сопротивления выносящего сосуда незначительно уменьшает кровоток в почке, СКФ увеличивается незначительно. Однако сужение выносящего сосуда также снижает почечный кровоток, и фракция фильтрации и онкотическое давление в клубочке возрастают. Следовательно, при сильном сужении выносящих артериол (сопротивление увеличивается более чем в 3 раза) эффект от повышения онкотического давления превышает увеличение гидростатического давления в клубочках. При этом результирующая сила, обеспечивающая фильтрацию, фактически снижается, приводя к уменьшению СКФ.
Следовательно, сужение приносящего сосуда оказывает на СКФ двоякий эффект. При умеренной вазоконстрикции наблюдается небольшое увеличение СКФ, однако при сильном спазме СКФ снижается. Первопричиной снижения СКФ служит следующий механизм: поскольку сужение приносящего сосуда становится все сильнее и содержание белка в капиллярах клубочка возрастает, возникает быстрое нелинейное увеличение онкотического давления, вызванное эффектом Доннана: чем выше концентрация белка, тем быстрее растет онкотическое давление, поскольку осмотическое действие белков усиливается в результате присоединения к белкам плазмы различных ионов.
В заключение определим, что сужение приносящей артериолы снижает СКФ, а эффект от сужения выносящей артериолы зависит от степени вазоконстрикции: при небольшом сужении СКФ увеличивается, однако сильный спазм (при увеличении сопротивления более чем в 3 раза) способствует уменьшению СКФ.
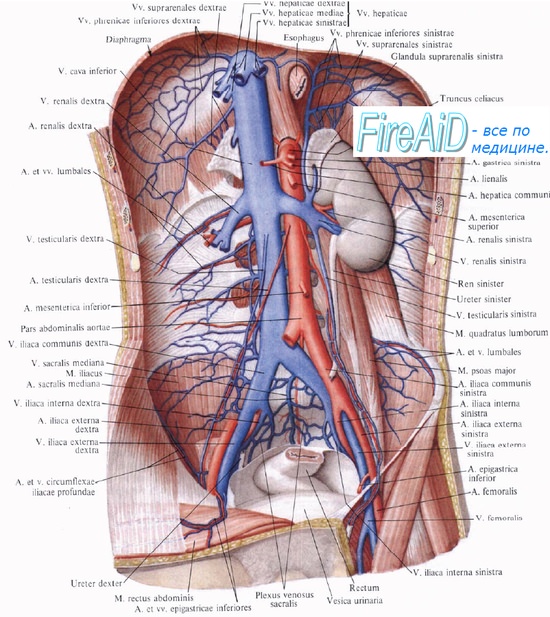
б) Кровоток в почке. У мужчины массой 70 кг кровоток через обе почки составляет в среднем около 1100 мл/мин, т.е. около 22% сердечного выброса. Принимая во внимание, что масса почек составляет примерно лишь 0,4% массы тела, очевидно, что по сравнению с другими органами кровоснабжение почек крайне высокое.
Как и в других тканях, кровь снабжает почки питательными веществами и удаляет продукты жизнедеятельности. Однако такой высокий уровень кровоснабжения намного превышает потребности. Целью такого чрезмерного кровотока является снабжение клубочка большим количеством плазмы, благодаря фильтрации которой обеспечивается тонкая регуляция объема жидких сред и концентрации растворенных в ней веществ. Как можно ожидать, механизмы регуляции почечного кровотока тесно связаны с регуляцией СКФ и выделительными функциями почек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Чем обеспечивается высокое артериальное давление в капиллярах клубочков почки
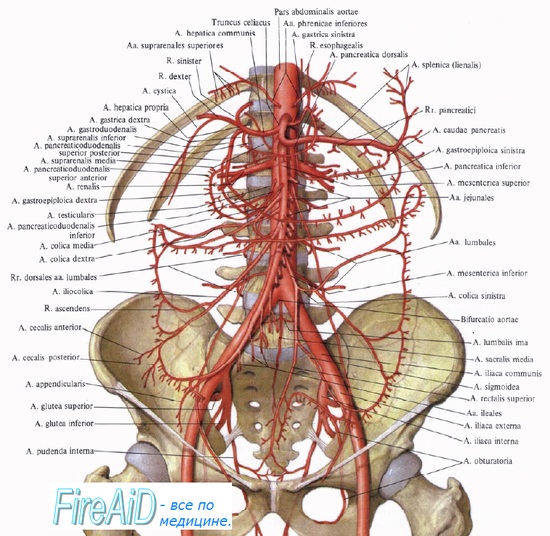
Почка является одним из наиболее снабжаемых кровью органов — 400 мл/ 100 г/мин, что составляет 20—25 % сердечного выброса. Удельное кровоснабжение коркового вещества значительно превышает кровоснабжение мозгового вещества почки. У человека через корковое вещество почки протекает 80—90 % общего почечного кровотока. Медуллярный кровоток мал только в сравнении с корковым, однако если сравнивать его с другими тканями, то он, например, в 15 раз выше, чем в покоящейся скелетной мышце.
Гидростатическое давление крови в капиллярах клубочков значительно выше, чем в соматических капиллярах и составляет 50—70 мм рт. ст. Это обусловлено близким расположением почек к аорте и различием диаметров афферентных и эфферентных сосудов корковых нефронов.
Метаболизм в почках протекает более интенсивно, чем в других органах, включая печень, головной мозг и миокард. Интенсивность его определяется величиной кровоснабжения почек. Эта особенность характерна именно для почек, поскольку в других органах (мозг, сердце, скелетные мышцы) наоборот — интенсивность метаболизма определяет величину кровотока.
Гуморальная регуляция. Ангиотензин II (АТII) является мощным констриктором для сосудов почек, он влияет на почечный кровоток также опосредованно, стимулируя выброс медиатора из симпатических нервных окончаний. АТИ стимулирует также выработку альдостерона и антидиуретического гормона, которые, в свою очередь, усиливают констрикторный эффект в сосудах почек.
Простагландины оказывают на сосуды почки выраженное дилататорное действие. В состоянии покоя простагландины практически не участвуют в регуляции почечного кровотока, однако их активность резко возрастает при любых вазоконстрикторных эффектах, что и обусловливает ауторегуляцию почечного кровотока.
Кинины являются местным гуморальным фактором регуляции коркового кровотока в почках. Действуя на кининовые рецепторы в сосудах, они вызывают вазодилатацию, увеличивая почечный кровоток и активируя натрийурез.
Катехоламины через а-адренорецепторы сосудов почек вызывают их констрикцию, преимущественно в корковом слое. Допамин в малых дозах, воздействуя на допаминовые рецепторы, вызывает в почках вазодилатацию. При больших концентрациях допамин, влияя на /?-адренорецепторы, вызывает вазоконстрикцию, наиболее выраженную в корковом слое почки.
Вазопрессин, наряду со специфическим влиянием на канальцы почек, вызывает констрикцию артериол, усиливает действие катехоламинов, перераспределяет кровоток в почке, повышая корковый и снижая мозговой кровоток. Вазопрессин подавляет секрецию ренина и стимулирует синтез простагландинов. Ацетилхолин, воздействуя на гладкие мышцы артериол и повышая активность внутрипочечных холинергических нервов, увеличивает почечный кровоток. Секретин также вызывает увеличение общего почечного кровотока. Накопление продуктов метаболизма (С02), состояние гипоксии ведет к снижению кортикального кровотока без изменения медуллярного кровотока. Аденозин вызывает вазоконстрикцию, уменьшая общий почечный кровоток, при этом происходит перераспределение кровотока в пользу мозгового вещества почки.
Нервная регуляция. По сравнению с гуморальными факторами нервная регуляция почечного кровотока выражена меньше. Постганглионарные симпатические нервные волокна локализованы в перивазальной ткани основной, междолевых, междольковых артерий и достигают артериол коркового слоя, реализуя констрикторные эффекты через а-адренорецепторы. Сосуды почки, особенно мозгового слоя, иннервируются симпатическими холинергическими нервными волокнами, которые оказывают вазодилататорный эффект.
Миогенная регуляция обеспечивает в основном ауторегуляцию кровоснабжения почек. Миогенными реакциями прегломерулярных сосудов обусловливается относительно постоянный уровень коркового кровотока в диапазоне колебаний системного артериального давления крови в пределах от 70 до 180 мм рт. ст.
Гломерулонефрит: причины, симптомы, диагностика, лечение
Гломерулонефрит занимает третье место среди заболеваний почек и чаще всего встречается у людей в возрасте 30-40 лет. Это иммуновоспалительное заболевание почечных клубочков протекает в острой, хронической или быстропрогрессирующей форме с поражением обеих почек.
Чаще всего причины гломерулонефрита и его патогенез неизвестны. Из-за поражения клубочков почки теряют способность фильтровать кровь, в организме задерживаются вода и токсины. На конечной стадии заболевания наступает почечная недостаточность, которая требует пожизненного диализа или пересадки почки, поэтому очень важно выявить гломерулонефрит на ранних стадиях.
Причины гломерулонефрита
Причины острого гломерунефрита
Причины хронического гломерунефрита
Симптомы гломерулонефрита
Диагностика гломерулонефрита
Клинические признаки гломерулонефрита в большинстве случаев не позволяют определить характер изменений в клубочках, а при латентной форме у пациента нет никаких жалоб, и заболевание выявляется случайно при обращении в клинику по другим причинам. Также учитываются ранее перенесенные и хронические инфекции и системные заболевания.
Для определения степени поражения почек и оценки течения гломерулонефрита используют лабораторные анализы и инструментальные исследования.
Общий анализ мочи при гломерулонефрите проводится для обнаружения крови (эритроцитов), белка, цилиндров, которые указывают на поражение почечных клубочков, а также учитывается снижение удельного веса мочи [3].
Проба Зимницкого используется для оценки суточного объема мочеиспускания и концентрации мочи. Этот метод помогает определить способность почек концентрировать и выделять мочу.
Общий анализ крови помогает выявить наличие воспалительного процесса в организме.
Биохимический анализ крови показывает повышенный уровень мочевины, креатинина, электролитов. Эти параметры характеризуют фильтрационную способность почек и степень их поражения [4].
Иммунологическое исследование крови на наличие антистрептококковых антител выявляет перенесенную стрептококковую инфекцию и, следовательно, риск развития постинфекционного гломерулонефрита.
Биопсия (микроскопическое исследование образца почечной ткани) проводится, когда диагностика и классификация гломерулонефрита затруднены.
Ультразвуковое исследование почек выявляет участки воспаления, расширение и сужение почечных клубочков и сосудов, изменения положения и размеров почек. Также проводится доплерографическое исследование сосудов почек для оценки кровотока в органе.
Рентгенограмма и КТ почек (получение изображения тонких срезов почек) используются для выявления участков воспаления и других изменений структуры почек.
Нефросцинтиграфия за счет накопления в тканях почек специального препарата, введенного внутривенно, позволяет оценить состояние тканей почек, локализацию и особенности патологических процессов.
Экскреторная урография выявляет патологии почек и мочевыводящих путей. На рентгеновских снимках можно выявить нарушения при выведении почками контрастного вещества.
Измерение артериального давления систематически в течения дня имеет значение при гипертензивной форме гломерулонефрита.
ЭКГ и ЭхоКГ позволяют оценить работу сердца.
УЗИ грудной клетки (легкие и плевральные полости) проводят при одышке.
Дифференциальная диагностика проводится для исключения нефротического синдрома, пиелонефрита, почечно- и мочекаменной болезней, поликистоза почек, артериальной гипертензии [3].
Гломерулонефрит у детей часто протекает вяло или атипично и требует наблюдения у нефролога.
Лечение и профилактика гломерулонефрита
Из-за тяжести заболевания лечение проводится в условиях стационара. Это особенно касается случаев выраженной симптоматики или почечной недостаточности.
Пациентам с гломерулонефритом противопоказаны физические нагрузки, в частности работа на открытом воздухе и в условиях низкой температуры или высокой влажности.
При почечной недостаточности назначают диализное лечение. С его помощью заменяют две основные функции почек: выведение избыточной воды из организма и удаление токсинов из крови. При тяжелом гломерулонефрите проводят пересадку почки.
Острая фаза гломерулонефрита купируется в течение 1-3 недель с возможными рецидивами. Показатели мочи нормализуются более года. Наблюдение пациентов, перенесших острый гломерулонефрит, ведется в течение 2 лет, а при хронической форме рекомендовано проходить регулярное обследование 2-3 раза в год.
Клинические рекомендации направлены на снижение риска гломерулонефрита, а также его рецидивов. Они включают обязательное полное излечение стрептококковых, бактериальных и других инфекций, избегание переохлаждения и высокой влажности, ограничение потребления соли, соблюдение здорового образа жизни, а также регулярное медицинское наблюдение у специалистов.