чем можно растворить цинк
Химичим с цинком и ржавчиной.
Результат применения этого дела на кузове ОКИ
Давно хотел попробовать гальванику. Электролизом осаждать цинк на черных металлах. В быту пригодится, да и изучить стойкость к коррозии. Есть наборы для оцинковки в продаже, но они дорогие, за таких мелких 2 пузырька и пары причендалов отдавать деньги. искать еще где продается. Пробуем составить это дело самим:
На авторынке купил электролит для аккумуляторов. Это серная кислота с дистиллированной водой. Концентрация довольно велика.
Далее взял кучку севших но не потекших солевых батареек. Это самые дешевые батарейки. Достал из них цинк, нарезал тонкими полосками и опустил в серную кислоту. Поставил в водяную баню. Пошла реакция (фото). Растворял пока пузырьки шли, потом кислота выработалась, по идее насытившись растворенным цинком.
Но, как оказалось полученный раствор сульфата цинка непроканал. Забиваем на это. Засыпаем содой и сливаем в банку с шлаком.
Покупаем в магазине радиодеталей паяльную кислоту, с содержанием цинка. Состав- хлорид цинка. Цинк растворенный уже в соляной кислоте. Там цинка завались. Стоит в местном магазине литр — 400 руб. Литра хватит на оч много.
Сразу, там же покупаю ортофосфорную кислоту. Тоже является паяльной кислотой. 50 мл. достаточно.
Делаем 2 электрода.
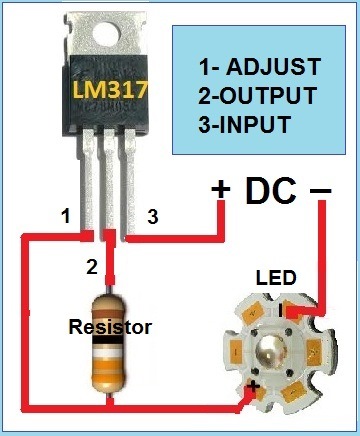
Нужен будет источник питания. Тут главное условие — возможность регулировки силы тока. У меня есть самопальный источник от 0 до 24 вольт и стабилизацией тока 0 до 10 ампер. Ниже приведу пару вариантов и схему простейшего регулятора тока, если источника под рукой нету.
Далее обильно протираем насухо. Обезжириваем ацетоном, пальцами не трогаем.
Берем электрод для цинкования. Подключаем его к тому же + источника. Пропитываем его хлоридом цинка. Ставим на БП отсечку тока 0.2-0.4А. Начинаем быстро не отрывая и не задерживая на месте водить по железяке. Как только появилась легкая, тонкая пленка цинка- ставим отсечку тока в 0.8-1 А и так же быстро водим, пока не получим желаемую толщину покрытия. Регулировка тока дает возможность управлять интенсивностью реакции осаждения цинка. Т.к. не ограничив ток, покрытие будет рыхлым, темным и непрочным. После оцинковки промываем деталь в воде, потом протираем тряпкой, смоченной в растворе пищевой соды. При реакции соды с остаточной кислотности от хлорида цинка, получается соль вроде. Потом еще раз под водой полоскаем. Сода как нейтрализатор.
Капал воду, вода так и осталась каплями. По голой стали она растекается, а тут как бы собирается, как будто жирная поверхность.
Вот еще пара примеров оцинкованных железяк.
Вот пример схемы стабилизатора тока. Тут cxem.net/calc/lm317_calc.php можно рассчитать сопротивление резистора. Для «зачистного» тока нам будет нужен резистор 0.8 Ом. Можно 1 Ом на мощность 2 ватта. А для наносимого покрытия уже резистор на 1.6 Ома тож 2 ватта. Будут греться, но выдержат. 317ю нужно прикрутить на радиатор.
Если совсем просто- можно взять лампу от поворотника или стопа и подключить электрод через лампу, а в кач-ве источника- аккумулятор от машины. Если взять несколько ламп — можно подбором кол-ва в параллель менять ток.
Комментарии 39
Пожалуйста, раз ты такой химк, помоги, я тут решил под капотом преобразователем ржавчины с цинком, убрать ражавчину, с болтов гаек, поехал на мойку смыть все это и произошла какая-то реакция, мыли химией, аксамд LF. Те места где я чистил и рядом все в белых точках, и ничем не берет ни содой ни ксилитом ни растворителями, что делать у меня паника, как можно убрать якобы какую-то накипь
Раствор соды в каких пропорциях готовится?
А если растворить предварительно цинк в ортофосфорной кислоте, а не соляной, будет тот же эффект?
подскажите?может ли паяльная кислота(с цинком которая) разъедать лак автомобиля?
Здравствуйте. Подскажите а как лампу от поворотника приколхозить, не могу сообразить к каким проводам подключать её. Ведь минусовая клема на корпусе остается? Спасибо
Лампочку в разрыв плюсового провода к которому подключен электрод. Т.е. последовательно.
Респект, за отчет, только вопрос не лучьше сначала малым током, а после повысить и поверхность будет матовая, и грунт ляжет на него.
В принципе идея кстати. Надо будет попробовать.
Да ты там осторожней с испарениями, используй вытяжку и противогаз, т.к. при реакции соляной кислоты ицинка образ сорнистый ангидрид пдк 0,5 надышишся и отеклегких заработать можно!) ну не дай божЕ.
откуда сернистый ангидрид в соединении соляной кислоты? вы б еще сказали чистый хлор выделяется.)) он же не сернистую кислоту использовал. и не фульфит, и даже не гидросульфит цинка, и не медь. сернистого газа и в реакции серной кислоты нет. валентность не та))) единственное чего стоит бояться это водород.
О, видимо вы в химии понимаете. Вот дело было. Лет 10 — 15 назад хотел сделать гравировку на блинах от винча (алюминий с зеркальным покрытием оксида железа, я честно сам не знаю что за покоытие точно, так пишут.)
Взял раствор поваренной соли и начал электродом травить надпись на этом диске. Резко завоняло хлоркой, аж в нос дало (как в школьном толчке, который был усыпан хлоркой, только в несколько раз сильней). Я резко выключил это дело и больше так не делал, боялся что траванусь. Вот интересно, неужели так интенсивно хлор выделяться начал или не только хлорка так воняет? Хлор он же ядовит. И что интересно, ни от чего больше такого запаха небыло, очень много металлов так гравировал. Интересно какие металлы с поваренной солью при электролизе дают образование хлора?
вот вам вводная лекция по травлению металлов))) надеюсь кому пригодится. главное будьте осторожны и смотрите не только с чем работаете, а что еще будет во время работы с реагентами))) а то так можно по незнанию и инвалидом остаться или того хуже…
Подскажите, паяльной кислотой на основе цинка, возможно защитить металл от коррозии?
вы хотите покрыть чистый металл? или ржавый?
Цинкование и пассивация в домашних условиях.
Все началось с ручек для ЗИЛ 4104. Об изготовлении ручек можно почитать в одном из предыдущих постов. Изначально я думал отдать их в оцинковку на производство, но покурив интернеты решил сделать самостоятельно.
Процесс нанесения цинкового покрытия своими руками в целом не сложен. Большинство информации в сети связано с нанесением цинка с корпуса батарейки на участок кузова автомобиля. Но мне это не подходит, так как надо оцинковывать разные небольшие детали целиком. И потом придавать им переливчатый золотисто-зеленый оттенок.
Будем рассматривать электро-химический метод. Он самый простой и доступный для каждого. В результате гальванического процесса в растворе электролита цинк тонким слоем осаждается на поверхности детали. Вот и все. Шучу, не все)
Для самого простого цинкования потребуется.
1. Электролит для АКБ из магазина. То есть раствор серной кислоты.
2. Сульфат цинка порошковый или
3. Паяльная кислота (продается в магазинах радиолюбителей).
4. Дистиллированная вода.
5. Цинковый анод (кусок чистого цинка).
6. Блок питания 12 вольт с возможностью ограничения тока (например зарядное устройство для АКБ.
Для качественной оцинковки необходима качественная очистка поверхности детали от любых загрязнений.
Лучше всего делать пескостуйную обработку. Можно чистить болгаркой. Или вытравливать сначала в щелочи, потом в кислоте. Можно применять гальваническое травление.
При гальваническом травлении не играет большой роли где будет анод а где катод. На аноде в результате реакции выделяется водород, на катоде кислород. Водорода выделяется в 2 раза больше, поэтому анод пузырится сильнее. Заводораживание металла увеличивает его хрупкость, поэтому данный метод очистки не рекомендуют для металлов с высоким классом прочности (пружины там всякие и болты повышенной прочности).
Вобщем суть в том чтоб в процессе очистки удалить с металла все загрязнения.
Спецы рекомендуют сначала травление в щелочи, потом гальваническое кислотное травление, потом активация поверхности в кислотном растворе. Все с проежуточными промывками в воде.
Я очищаю детали механически, потом травление в акумуляторном электролите, промывка в воде, потом снова мехобработка, активация в кислоте и собственно оцинковка.
Если для оцинковки используется сульфат цинка, то его надо растворить в дистиллированной воде в соотношении 200гр на литр воды. Размешать до полного растворения.
Если используется паяльная кислота то она просто наливается в емкость и все.
При оцинковке анодом (+) является кусок цинка, сопоставимый по площади с деталью. Катод (-) сама деталь.
Напряжение должно быть в районе 12 вольт постоянного тока. Сила тока устанавливается в диапазоне 0,5 — 5 ампер на 1 кв.дм площади. Фактически желательно держать ток поменьше. При большом токе качество осаждения цинка сильно ухудшается. Старайтесь не превышать ток 1 ампер на небольших деталях. Цинкование происходит при температуре 18-25 градусов.
По времени слой наносится за 2-10 минут в зависимости от размера детали и тока.
Этот метод подойдет для защитной оцинковки деталей. Если нужна эстетика то надо использовать специальную химию. Об этом дальше.
Для получения блестящего цинкового покрытия с последующей радужной пассивацией процесс выглядит так.
1. Очистка поверхности детали (механическая, травление в растворе серной кислоты с промежуточными промывками).
2. После очистки детали на несколько секунд погружаем деталь в раствор серной кислоты (электролит для АКБ из магазина), потом промываем водой. Работать в перчатках и чистой детали руками не касаться во избежание загрязнения поверхности и ожогов кожи кислотой! Желательно работать в респираторе чтоб не дышать продуктами реакций.
3. Для блестящего цинкования я использую щелочной электролит «экомет-ц31». Он дает отличное блестящее покрытие.
Вешаем деталь на катод (-) и погружаем полностью в электролит. На аноде (+) кусок цинка. По напряжению и току выше написано. Цинк ложится быстрее со стороны расположения анода, так что деталь надо периодически поворачивать разными сторонами к аноду. Нанесение по времени так же занимает 2-10 минут. Не спешите и не давайте большой ток!
4. После того как деталь оцинкуется ее необходимо промыть в воде. В итоге мы имеем хорошо выглядящую блестящую детать с устойчивым антикоррозийным покрытием.
Для увеличения устойчивости покрытия и придания ему эстетичного вида можно сделать пассивацию.
Пассивация это тоже что активация, только наоборот. Пассивация это процесс создания устойчивой оксидной пленки на поверхности детали.
Для этого я использую состав «экомет — пц12». Этот состав дает радужную пассивацию. Деталь приобретает золотисто зеленоватый оттенок с переливами.
Сразу после оцинковки и промывки детали она погружается в состав для пассивации. Я держу ее там 10-15 секунд, после чего снова промывка в воде и горячая сушка феном.
Сушку надо выполнять аккуратно, фен держать на расстоянии и понемногу прогревать детать, визуально контролируя проявление радужности. Если перегреть локально, пассивация будет отлетать с поверхности.
Паяльная кислота для цинкования
Комментарии 59
zahar44u-У меня повторно заржавело уже после процедуры описанной вами.
Опять ты нажрался и пужаешь…
Внимательно выслушал и продолжаю заряжать воду и цинковать батарейками…Вам, предводитель, пора лечиться электричеством(12 стульев).
В магазинах продается баллончик холодного цинкования. Стоит денег, но он того стоит. Higear делает, если не ошибаюсь
баллончик тот можете просто.выкинуть…как и его аналоги.типо цинконаполненные грунты в таких же баллончиках.это не цинкование…)
В нете все есть, ищи. Лучше ориентироваться на промышленное цинкование, то как умельцы ваткой цинкуют немного неправильно. У меня вот первый опыт www.drive2.ru/l/501262129496588712/.
Чтобы точно не было проблем купи цинк и хлорид цинка в магазине хим. Реактивов. И проблем точно не будет. До этого тоже растворял цинк в кислоте, батарейки ковырял…фигня всё это. Хотя в теории должно работать.
Мне до магазина добираться далековато.
У меня с батарейками и растворением цинка в кислоте не получилось цинкануть. Когда Купил цинк и хлорид в магазине покрытие получилось отличное. Пока полет недолгий-месяц, но и дожди были много раз и всё ок. И легло хорошо. Я бы заказал тогда доставку. И с батарейками не получилось, хотя делал так-же как и в этот раз. Мне кажется там везде сплавы какие-то. Всё говорят, что там чистый цинк, но никто толком это не проверял никогда.
Чтобы точно не было проблем купи цинк и хлорид цинка в магазине хим. Реактивов. И проблем точно не будет. До этого тоже растворял цинк в кислоте, батарейки ковырял…фигня всё это. Хотя в теории должно работать.
в чем растворять хлорид цинка?
знакомый в кислоту цинк добавлял, растворяется долго. Пробовал цинковать, вроде получается, но говорит что слой очень шершавый.
Там и там надо получить zncl2. Только через кислоту ты получаешь хлорид цинка и водород. А если просто купишь хлорид готовый, то просто растворить в воде. Лучше дистиллированной. Благо она копейки стоит. Растворяй как душе угодно. Можешь примерно как сахар в чашке чая по пропорции. Можешь пока не перестанет растворяться.это экспериментально подберёшь, да и не особо важно. Шершавый слой имхо от большого тока. Повесь лампочку в цепь, как все делают. Очень удобно с ней. Я вешал просто габарит. Питал от Аккума. Там токи маленькие для его емкости. Про то, что засадишь можно вообще не думать.
Там и там надо получить zncl2. Только через кислоту ты получаешь хлорид цинка и водород. А если просто купишь хлорид готовый, то просто растворить в воде. Лучше дистиллированной. Благо она копейки стоит. Растворяй как душе угодно. Можешь примерно как сахар в чашке чая по пропорции. Можешь пока не перестанет растворяться.это экспериментально подберёшь, да и не особо важно. Шершавый слой имхо от большого тока. Повесь лампочку в цепь, как все делают. Очень удобно с ней. Я вешал просто габарит. Питал от Аккума. Там токи маленькие для его емкости. Про то, что засадишь можно вообще не думать.
А в електролите для аккумуляторов тоже можно?
Нет. Никакого смысла вообще нет. То есть работать будет, наверное, но тут, в использовании хлорида чистого и плюс в том, что нет кислоты никогда, только соли. А вы опять в кислоту уходите. Вот такая шляпа получится: сульфат цинка (наверное тоже с него цинк осядет) но и соляная кислота. Нафига она вам? Имхо так тооочно делать не надо.
Способ растворения окиси цинка
В, А. Павленко и В. Н. Кокозей (72) Авторы изобретения. Ф
Киевский ордена Ленина государственный университет им. Т. Г. Шевченко (7I) Заявнтель (54) СПОСОБ РАСТВОРЕНИЯ ОКИСИ ЦИНКА!
Изобретение относится к аналитической химии, а именно к способам растворения окиси цинка, и может быть использовано в аналитической химии при разделении цинка и кадмия.
Известен способ растворения окиси цинка путем обработки его растворами солей аммония, например уксуснокислого или хлористого (1).
Однако данный способ не позволяет селектнвно растворять окись цинка в присутствии окислов других элементов, например цинка.
Наиболее близким по технической сущности и достигаемому результату к изобретению является способ растворения окиси цинка путем обработки его раствором ацетилацетона в среде диметилформамнда или пролилового спирта (2).
Однако известный способ также недоста.точно селективен по отношению к другимокислам, в частности к окиси кадмия.
Поставленная цель достигается тем, что согласно способу растворения оксида цинка путем обработки его ацетилацетоном в среде органического растворителя, в качестве растворителя используют ацетоннтрил.
Предлагаемый способ основан на различной способности окисей цинка и кадмия растворяться в ацетонитрильном растворе ацетилацетона.
Растворение по известному способу.!
Составитель Т. Жукова
Техред Ж. Кастелевич
Корректор H- Швыдкая
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж вЂ” 35, Раушская наб., д. 4/5
Филиал ППП «Патент», r. Ужгород, ул. Проектная, 4
Пример 1. Навеску окиси цинка 0,7 помешают в реактор и приливают 25 мл
10 o-ного раствора ацетилацетона в диметилформамиде. Смесь при постоянном перемещивании нагревают при 70 С в течение 1,5 ч. В растворе обнаружено 0,7 г окиси цинка, Пример 2. Яавеску 0,15 г окиси кадмия помешают в реактор и приливают 25 мл
l0 o-ного раствора ацетилацетона в диметилформамиде. Аналогично предыдущему примеру процесс ведут прп 70 С при постоянном перемешивании. В растворе обнаружено 0,15 г окиси кадмия.
Растворение по предлагаемому способу.
Пример 3. Навеску 0,7 г окиси цинка помещают в реактор и приливают 25 мл 10%ного раствора ацетилацетона в ацетонитриле.
Смесь нагревают при 70 С при постоянном перемешивании в течение 1,5 ч. В растворе оо наружено 0,7 г. окиси цинка.
Пример 4. Навеску 0,15 г окиси кадмия помещают в реактор и приливают 25 мл
10 o-ного раствора ацетилацетона в ацетонитриле. Смесь при постоянном перемеаивании на- гревают при 70 С в течение 1,5 ч. В растворе обнаружено 0,02 r окиси кадмия.
Пример, 5.. Смесь, состоящую из 0,7 r окиси цинка и 0,7 г окиси кадмия, помещают в реактор и приливают 25 мл 10%-ного раство37332 4 ра ацетилацетона в ацетонитриле. Смесь при постоянном перемешивании нагревают при
70 С в течение 1,5 ч и фильтруют в горячем состоянии. В фильтрате обнаружено 0,7 г окиси цинка. При этих условиях переходит в раствор только 0,02 г окиси кадмия. Коэффициент разделения по предлагаемому способу равен 35, в то время как по известному — 5.
Таким образом, предлагаемый способ поэвощ ляет повысить селективность растворения окиси цинка по отношению к окиси кадмия в семь раз.
Способ растворения окиси цинка путем обработки ее ацетилацетоном в среде органического растворителя, отличающийся тем, что, с целью повышения селективности растворения по отношению к окиси кадмия, в качестве растворителя используют ацетонитрил.
Источники информации, принятые во внимание при экспертизе
1. Авторское свидетельство СССР N 265546, кл, G 01 N 31/00, 1968.
Цинк. Химия цинка и его соединений
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
3s 

Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Нахождение в природе
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Химические свойства
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Химические свойства
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr