сульфат алюминия что это такое
Сульфат алюминия
| Сульфат алюминия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфат алюминия |
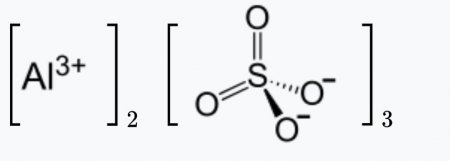
| Химическая формула | Al2(SO4)3 |
| Физические свойства | |
| Молярная масса | 342,15 г/моль |
| Плотность | 1,62—2,672 г/см³ |
| Термические свойства | |
| Температура плавления | 770 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| Регистрационный номер EC | 233-135-0 |
Содержание
Описание
Сульфат алюминия — это соль белого цвета с серым, голубым или розовым оттенком, при обычных условиях существует в виде кристаллогидрата Al2(SO4)3·18H2O — бесцветных кристаллов. При нагревании теряет воду не плавясь, при прокаливании распадается на Al2O3 и SO3. Хорошо растворяется в воде. Технический сульфат алюминия можно получить, обрабатывая серной кислотой боксит или глину, а чистый продукт, — растворяя Al(OH)3 в горячей концентрированной H2SO4.
Сульфат алюминия применяется для очистки воды хозяйственно-питьевого и промышленного назначения и для использования в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E-520. [1]
Химические свойства
Сульфат алюминия разлагается при температурах от 770 до 860 °C:
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают при соединении алюминия с серной кислотой:
Применение сернокислого алюминия.
Сернокислый алюминий — это сложное неорганическое вещество, соль белого цвета с серым или голубым оттенком. Вещество может иметь розовый оттенок.
Соль Al₂(SO₄)₃ очень гигроскопична. Отличается быстрой растворимостью в воде. Вещество плавится при температуре +700 °C, плотность его равняется 1,62–2,67 г/см³.
Сернокислый алюминий — это самый распространенный коагулянт, применяемый для очистки воды от коллоидных частиц (наиболее мелких размеров). Это свойство сульфата алюминия связано с легкостью его получения и невысокой стоимостью.
Способы получения сульфата алюминия.
Соль выпускают 3 сортов. Продукт высшего сорта востребован в пищевой и фармацевтической промышленности, а соль 1 и 2 сорта подходит для технических целей. Сернокислый алюминий получают несколькими способами:
металлическая мебель https://www.safe24.ru/
Получить соль алюминия в домашних условиях можно, используя серную кислоту и кусочек алюминиевой фольги. При проведении реакции следует быть очень осторожным и соблюдать правила безопасности по работе с кислотами. Проводить реакцию нужно в хорошо проветриваемом помещении. Серная кислота разной концентрации продается в хозяйственных магазинах.
Для получения кристаллов коагулянта ее нужно развести до 10% концентрации дистиллированной водой. Фольга растворяется в течение 7 дней. Полученный раствор фильтруют через бумажный фильтр. Остаток воды испаряется на открытом воздухе. Ускорить процесс можно выпариванием на электроплитке, перелив раствор в термостойкий стакан.
Очень важное замечание: при разведении серной кислоты и других кислот следует кислоту лить в воду, а не наоборот. Фольгу замачивают в растворе кислоты, накрывают салфеткой и оставляют для прохождения химической реакции.
Соль высшего качества имеет сыпучую консистенцию, производится в виде образований размером до 20 мм. Соль для технических целей выпускают крупными кристаллами-пластинами или большими кусками весом до 10 кг.
Попадание сернокислого алюминия в организм человека может нанести ему непоправимый ущерб. Вещество может привести к ожогу носоглотки. Попадание на кожу или в глаза вызывает покраснение, зуд, боль, ожог. Попадание в желудочно-кишечный тракт может вызывать болевые приступы в желудке, рвоту и диарею.
Первая помощь при отравлении химикатом:
Применение сульфата алюминия в очистке водопроводной воды.
Полученное из глиноземов или бокситов вещество применяют как сильный коагулянт для очистки воды от коллоидных частиц. Данные частицы обладают отрицательным электрическим зарядом. К коллоидным частицам присоединяются ионы из окружающего их раствора с положительным зарядом. Это создает на их поверхности двойной электрический слой. В результате коллоидные частицы начинают отталкиваться друг от друга. У них небольшой удельный вес, и они находятся во взвешенном состоянии.
Коагулянт (в данном случае — это сульфат алюминия) несет на себе положительный ион. Он сжимает двойной электрический слой и нейтрализует его. Частицы получают дестабилизированный вид. Они окружают коагулянт при установлении контакта с ним. Если смесь в этот момент быстро перемешать, то химическое вещество получит однородную дисперсию. Это позволит увеличить максимальный контакт между частицами.
Если перемешивать смесь несколько минут, то примеси коагулируют в более крупные хлопья. Крупные частицы, увеличиваясь в размерах и приобретая больший вес, начинают осаждаться под действием силы тяжести.
Очищенная вода теоретически должна быть чистой, без любых примесей. Но на практике коагулянт содержится в очищенной воде. Чем жестче вода, тем выше его концентрация. Это связано с тем, что в жесткой воде есть большое содержание гидроксида кальция и карбоната натрия, вступающих в реакцию с сульфатом алюминия и осаждающих алюминий в виде нерастворимого студенистого осадка гидроксида алюминия. Для измерения концентрации коагулирующего вещества в воде применяют концентратомеры, или солемеры. Хотя на самом деле концентратомерами называют приборы, определяющие концентрацию кислот и щелочей. Солемеры устанавливают для определения концентрации растворов солей.
Применение в пищевой и фармацевтической промышленности.
Сульфат алюминия известен как алюминиевые квасцы, или добавка E 520.
В пищевом производстве E 520 относится к стабилизаторам. Его получают из природных руд: боксита, алунита, глиноземов. Они подвергаются реакции с серной кислотой высокой концентрации при температурах +100…+250 °C. По окончании процесса получают соль с высоким коэффициентом чистоты.
Добавка E 520 отпускается в таре с дополнительными вставками, защищающими содержимое от влаги.
Сульфат алюминия применяют в рыбоперерабатывающей отрасли для сохранения товарного вида рыбы и предупреждения распада волокон. Стабилизатор используется при консервировании плодов и овощей. Добавка используется в кондитерской промышленности в производстве засахаренных и глазированных в сахаре фруктов.
Но основное применение добавки E 520 – для очистки питьевых и сточных вод. Вещество взаимодействует с примесями, которые выпадают в осадок. Он оседает на дно емкостей или водоемов. Вода пропускается поточным методом через систему специальных фильтров, где очищается и осветляется, после чего становится пригодной для питья и применения в производстве.
Другие области применения.
Сульфат алюминия также используется:
Вещество применяется как гидроизолятор в бетонных конструкциях. Сульфат алюминия используется в производстве огнетушителей.
Им обрабатывают шерстяные ткани для удерживания красящих пигментов. Процесс называется протрава шерстяных волокон. В водном растворе образуется дисперсная гидроокись алюминия, которая поглощается и хорошо удерживается волокнами шерсти. Протравленные волокна приобретают способность поглощать красители за счет адсорбированной ими гидроокиси алюминия.
Сульфат алюминия
| Сульфат алюминия | |
|---|---|
 | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES | |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Содержание
Физические свойства
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Сульфат алюминия
Сульфат алюминия растворим в воде и, в основном, используется в качестве флокулянта для очистки питьевой и технической воды станциями очистки сточных вод, а также в производстве бумаги.
Сульфат алюминия иногда упоминается как серная кислота, квасцы алюмоаммиачные или пищевая добавка Е 523. Безводная форма встречается в природе как редкий минерал Миллозевичит, содержащийся в вулканических средах, а также получается при сжигании угольных отходов. Сульфат алюминия образует множество различных гидратов, в числе которых кристаллогидрат Al2(SO4)3*16H2O и октадекагидрат Al2(SO4)3*18H2O.
Сульфат алюминия обладает способностью поглощать и удерживать молекулы воды из окружающей атмосферы.
Получение сульфата алюминия технического возможно путем добавления гидроксида алюминия Al(OH)3 в серную кислоту H2SO 4.
Также возможно получение сульфата алюминия из тетрагидроксоалюмината натрия.
Сульфат алюминия – это белое или почти белое кристаллической формы или в виде порошка соединение без запаха. Он растворим в воде, не летуч и легковоспламеняем. Сульфат алюминия обладает чрезвычайно кислым вкусом.
Применение сульфата алюминия
Раствор сульфата алюминия используется для очистки воды и как краситель в обработке текстиля. В процессе очистки воды раствор сульфата алюминия приводит к коагулированию, нежелательные примеси и загрязненные частицы оседают на дно сосуда и легко отфильтровываются.
При растворении в большом количестве нейтральной или слегка щелочной воды, раствор сульфата алюминия образует студенистый осадок гидроксида алюминия Al(OH)3, который используется при печати и окрашивании тканей, так как является нерастворимым пигментом.
Сульфат алюминия иногда используется для снижения pH почвы сада, что в свою очередь приводит при выращивании некоторых видов цветов (Гортензии) к их повторному цветению.
Сульфат алюминия является активным ингредиентом некоторых антиперспирантов.
В строительстве он используется в качестве гидроизолятора и ускорителя в производстве бетона.
Сульфат алюминия может быть использован в борьбе с моллюсками, насекомыми и слизняками.

В медицине сульфат алюминия входит в состав лекарств, облегчающих боль и дискомфорт, вызванные укусами насекомых. Он помогает разрушить токсичные химические вещества, содержащиеся в укусах, и помогает уменьшить их воздействие на кожу. Эти препараты выпускается в виде спреев, которые наносятся непосредственно на пораженные участки кожи и эффективнее помогают, если будут использованы сразу же после укуса.
Вред сульфата алюминия
Сульфат алюминия вреден при проглатывании или вдыхании. Вдыхание паров сульфата алюминия вызывает кашель и, возможно, одышку.
При контакте с кожей или глазами сульфат алюминия вызывает раздражение, покраснение, зуд и боль. Употребление сульфата алюминия внутрь приводит к сильному раздражению кишечника и желудка, сопровождаемое рвотой, тошнотой и диареей.
Это соединение может вызывать сильные ожоги, если контактирует с открытыми участками кожи.
Первая помощь при отравлении сульфатом алюминия
При попадании сульфата алюминия на кожу или в глаза необходимо промыть пораженный участок водой. В случае вдыхания паров необходимо выйти из токсичной области и медленно отдышаться. Если сульфат алюминия был применен внутрь, необходимо выпить стакан молока, а затем спровоцировать рвоту.
При отравлении сульфатом алюминия ни в коем случае нельзя использовать бикарбонаты, так как такое сочетание в буквальном смысле является взрывным.
Хранение сульфата алюминия
Сульфат алюминия необходимо хранить в прохладном, сухом месте в плотно закрытой таре, не смешивая с другими веществами.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Большинство женщин способно получать больше удовольствия от созерцания своего красивого тела в зеркале, чем от секса. Так что, женщины, стремитесь к стройности.
В течение жизни среднестатистический человек вырабатывает ни много ни мало два больших бассейна слюны.
В нашем кишечнике рождаются, живут и умирают миллионы бактерий. Их можно увидеть только при сильном увеличении, но, если бы они собрались вместе, то поместились бы в обычной кофейной чашке.
Образованный человек меньше подвержен заболеваниям мозга. Интеллектуальная активность способствует образованию дополнительной ткани, компенсирующей заболевшую.
Ученые из Оксфордского университета провели ряд исследований, в ходе которых пришли к выводу, что вегетарианство может быть вредно для человеческого мозга, так как приводит к снижению его массы. Поэтому ученые рекомендуют не исключать полностью из своего рациона рыбу и мясо.
В стремлении вытащить больного, доктора часто перегибают палку. Так, например, некий Чарльз Йенсен в период с 1954 по 1994 гг. пережил более 900 операций по удалению новообразований.
Печень – это самый тяжелый орган в нашем теле. Ее средний вес составляет 1,5 кг.
Когда влюбленные целуются, каждый из них теряет 6,4 ккалорий в минуту, но при этом они обмениваются почти 300 видами различных бактерий.
Согласно исследованиям ВОЗ ежедневный получасовой разговор по мобильному телефону увеличивает вероятность развития опухоли мозга на 40%.
Наши почки способны очистить за одну минуту три литра крови.
Препарат от кашля «Терпинкод» является одним из лидеров продаж, совсем не из-за своих лечебных свойств.
По статистике, по понедельникам риск получения травм спины увеличивается на 25%, а риск сердечного приступа – на 33%. Будьте осторожны.
Стоматологи появились относительно недавно. Еще в 19 веке вырывать больные зубы входило в обязанности обычного парикмахера.
74-летний житель Австралии Джеймс Харрисон становился донором крови около 1000 раз. У него редкая группа крови, антитела которой помогают выжить новорожденным с тяжелой формой анемии. Таким образом, австралиец спас около двух миллионов детей.
Суставы после коронавируса могут быть повреждены. Дело в том, что новая коронавирусная инфекция ударяет практически по всем органам человека, и суставы не исклю.
Сульфат алюминия, характеристика, свойства и получение, химические реакции
Сульфат алюминия, характеристика, свойства и получение, химические реакции.
Сульфат алюминия – неорганическое вещество, имеет химическую формулу Al2(SO4)3.
Краткая характеристика сульфата алюминия:
Сульфат алюминия – неорганическое вещество белого цвета.
Химическая формула сульфата алюминия Al2(SO4)3.
Хорошо растворяется в воде, этиленгликоле. Плохо растворим в этаноле.
С водой сульфат алюминия образует кристаллогидраты с различным содержанием воды Al2(SO4)3·nH2O, где n может быть вплоть до 18. Наиболее распространенными являются гексадекагидрат Al2(SO4)3·16H2O и октадекагидрат Al2(SO4)3·18H2O.
Устойчив при обычной температуре.
Сульфат алюминия пожаро- и взрывобезопасен. По степени воздействия на организм продукт относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.005.
В земной коре сульфат алюминия находится как в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат алюминия в чистом состоянии распространён в природе в виде минерала миллозевичита. В форме кристаллогидратов сульфат алюминия встречается в природе в виде минерала алуногена Al2(SO4)3·17H2O.
Двойные соли сульфат алюминия образует с сульфатами ряда металлов, к которым, к примеру, относится и природный минерал алунит K2SO4·Al2(SO4)3·Al(OH)3.
В пищевой промышленности сульфат алюминия используется в виде добавки Е520.
Физические свойства сульфата алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al2(SO4)3 |
| Синонимы и названия иностранном языке | aluminium sulphate (aluminum sulfate (англ.) |
алюминий сернокислый (рус.)
Получение сульфата алюминия:
В промышленности сульфат алюминия получается взаимодействием гидроксида алюминия с серной кислотой.
В лаборатории сульфат алюминия получают в результате следующих химических реакций:
Химические свойства сульфата алюминия. Химические реакции сульфата алюминия:
1. реакция взаимодействия сульфата алюминия и гидроксида натрия :
В результате реакции образуются гидроксид алюминия и сульфат натрия.
2. реакция взаимодействия сульфата алюминия и гидроксида калия :
В результате реакции образуются гидроксид алюминия и сульфат калия.
3. реакция взаимодействия сульфата алюминия и гидроксида лития :
В результате реакции образуются гидроксид алюминия и сульфат лития.
4. реакция взаимодействия сульфата алюминия и нитрата бария:
5. реакция взаимодействия сульфата алюминия и нитрата свинца:
В результате реакции образуются сульфат свинца и нитрат алюминия.
6. реакция взаимодействия сульфата алюминия и фосфата натрия :
В результате реакции образуются фосфат алюминия и сульфат натрия.
7. реакция взаимодействия сульфата алюминия и фосфата калия :
В результате реакции образуются фосфат алюминия и сульфат калия.
8. реакция взаимодействия сульфата алюминия и гидрокарбоната натрия:
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
9. реакция взаимодействия сульфата алюминия и гидрокарбоната кальция:
В результате реакции образуются сульфат кальция, гидроксид алюминия и оксид углерода (IV). Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
10. реакция взаимодействия сульфата алюминия и карбоната натрия и воды:
11. реакция термического разложения сульфата алюминия:
12. реакция термического разложения октадекагидрата сульфата алюминия:
Октодекагидрат сульфата алюминия разлагается на сульфат алюминия и воду.
Применение и использование сульфата алюминия:
Сульфат алюминия используется во множестве отраслей промышленности и для бытовых нужд:
– как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения;
– в фотографии входит в составы стабилизирующих растворов и дубящих фиксажей;
– как пищевая добавка Е520;
– в качестве морилки при крашении и печати текстильных изделий;
– в бумажной, текстильной, кожевенной и других отраслях промышленности.



















