сукцинат хитозана что это
Тема: Хитозана сукцинат
Опции темы
Поиск по теме
Отображение
Хитозана сукцинат
Сырье: хитиновый панцирь камчатского краба
• Степень замещения 75
• Динамическая вязкость 2% р-ра 2100 мПа
Сукцинат хитозана представляет собой соль деацетилированного хитина и янтарной кислоты. Благодаря деацетилированию, хитозан приобретает два важных свойства, обуславливающие особенности и сферу его использования.
• Сукцинат хитозана хорошо растворим в воде;
• Его деацитилированные и замещенные группы при значениях рН Основные свойства
• Антимикробное
Данное свойство нашло свое применение в различных перевязочных материалах. Нетканые материалы, пропитанные растворами солей хитозана (либо сочетанием хитозана и альгината натрия) предлагаются к использованию в военно-полевой медицине.
• Кровоостанавливающее
Благодаря поожительному заряду, соли хитозана связываются с отрицательно заряженной поверхностью клеточной мембраны эритроцитов, что запускает более быстрое формирование фибрина и формирование тромба.
• Иммуномодулирующее (иммуностимулирующее)
Сукцинат хитозана используется в качестве адьюванта вакцины. Его добавки к вакцине позволяет повысить ее эффективность, усиливая иммунный ответ.
Использование в косметике:
• Антимикробная и противоперхотная добавка в шампуни, гели для душа, гели для интимной гигиены и пр.
• В качестве пребиотической добавки;
Известно, что олигомеры хитозана стимулируют рост молочнокислых бактерий (введение в питательную среду 0,01% раствора аскорбата олигосахаридов хитозана в 10 раз стимулирует размножение и рост некоторых бифидо- и лактобактерий)
• Как катионная, уменьшающая электростатическое напряжение, облегчающая расчесывание волос добавка в кондиционеры, ополаскиватели для волос.
• В качестве естественного хумектанта в косметике;
Считается, что хитозановые гели увеличивают время контакта лечебных компонентов со слизистой и улучшают транспортировку полярных веществ сквозь роговой слой.
Растворимость:
• Сукцинат хитозана растворим в воде
• Хлопья предварительно можно диспергировать в небольших обьемах глицерина с последующим добавлением воды.
Согласно «Рекомендуемым уровням потребления пищевых и биологчески активных веществ», суточная норма потребления хитозана до 5 г/сутки.
Хитозан может использоваться в качестве дополнительного, либо основного гелеобразователя для создания фармацевтических субстанций, например, в трансбуккальных гелях. Считается, что хитозановые гели увеличивают время контакта лечебных компонентов со слизистой и улучшают транспортировку полярных веществ сквозь роговой слой.
Широко используется в ветеринарии как в качестве кормовой добавки, так и в разнообразных наружных средствах – в составе антисептических, антибактериальных препаратов наружного применения, в косметике для животных.
В пищевой промышленности, хитозан используют виноделя в качестве естественного сорбента и вещества, уменьшающего естественное прокисание вина.
Хитозан используется с сельском хозяйстве в качестве биопестицида (повышает устойчиваость растений к некоторым грибкам), стимулирует поглощение питательных веществ, улучшает всхожесть и рост растений. Используется 0,25% раствор солей хитозана.
Считается, что хитин/хитозан является натуральным природнм активным ингредиентом биоконтроля. Это один из наиболее распространенных биоразлагаемых материалов в мире. Продукты распада хитина всегда содержатся в воде и почве.
Норма ввода: от 0,1%
Использованы материалы http://lifebio.ru
Сукцинат хитозана что это
Хитозан – природный полимер XXI века. Уникальные свойства хитина и хитозана привлекают внимание большого числа специалистов самых разных специальностей. Роль полимеров в нашей жизни является общепризнанной, и все области их применения в быту, промышленном производстве, науке, медицине, культуре трудно даже просто перечислить. Если до XX века человеком использовались полимеры природного происхождения – крахмал, целлюлоза (дерево, хлопок, лен), природные полиамиды (шелк), природные полимерные смолы на основе изопрена – каучук, гуттаперча, то развитие химии органического синтеза в XX веке привело к появлению в различных областях деятельности человека огромного разнообразия полимеров синтетического происхождения – пластмасс, синтетических волокон и т.п. Происшедший технологический прорыв не только кардинально изменил нашу жизнь, но и породил массу проблем, связанных с охраной здоровья человека и защитой окружающей среды.
Поэтому закономерным является большой интерес науки и промышленности к поиску и использованию полимеров природного происхождения, таких как хитин и хитозан. Эти полимеры обладают рядом интереснейших свойств, высокой биологической активностью и совместимостью с тканями человека, животных и растений, не загрязняют окружающую среду, поскольку полностью разрушаются ферментами микроорганизмов, могут широко применяться в проведении природоохранных мероприятий.
Реакция сопровождается одновременным разрывом гликозидных связей полимера т.е. уменьшением молекулярной массы изменением надмолекулярной структуры степени кристалличности и т.д. Таким образом, хитозан представляет собой полидисперсный по молекулярной массе полимер D-глюкозамина содержащий 5-15% ацетамидных групп а также до 1% групп соединенных с аминокислотами и пептидами. Процесс проводят обычно с помощью концентрированных щелочей при повышенных температурах. Первым опытом получения хитозана было сплавление хитина с твердой щелочью при 1800С. Этим способом получали продукт со степенью деацетилирования (СД) 95% но значительно деструктированный (до 20 единиц).
N- и О-сульфатированные производные частично деацетилированного карбоксиметилхитина не только препятствуют свертыванию крови благодаря селективной адсорбции антитромбина но и резко уменьшают интенсивность деления раковых клеток.
Однородные гибкие не дающие трещин хитозановые пленки обладают избирательной проницаемостью подобно другим полимерным покрытиям на поверхности плодов и овощей играют роль микробного фильтра и/или регулируют состав газов у поверхности и в толще тканей влияя тем самым на активность и тип дыхания что в целом способствует продлению сроков хранения растительного сырья. Помимо этого покрытие из хитозана вызывает некоторые морфологические изменения в возбудителях порчи томатов и перца. Пленка хитозана способствующая продлению срока хранения мороженого тунца вероятнее всего играет роль барьера регулирующего проникновение кислорода воздуха и испарение воды. Хитозан присутствуя в составе пищевых продуктов положительно влияет на их биологическую ценность. Кроме того хитозан относится к диетическим волокнам которые не усваиваются организмом человека а в кислой среде желудка образует раствор высокой вязкости. Как компонент пищи или как лечебно профилактический препарат хитозан проявляет свойства энтеросорбента иммуномодулятора антисклеротического и антиартрозного фактора регулятора кислотности желудочного сока ингибитора пепсина и др. [11].
Хитозан отличается от большинства природных и химически синтезированных гелеобразователей применяемых в косметике тем что при биологических значениях рН они имеют положительный заряд т.е. является поликатионом (если рН
Сукцинат хитозана что это
Композитный материа́л, компози́т – искусственно созданный неоднородный сплошной материал, состоящий из двух или более компонентов с чёткой границей раздела между ними. В большинстве композитов (за исключением слоистых) компоненты можно разделить на матрицу (или связующее) и включённые в неё армирующие элементы (или наполнители). В композитах конструкционного назначения армирующие элементы обычно обеспечивают необходимые механические характеристики материала (прочность, жёсткость и т.д.), а матрица обеспечивает совместную работу армирующих элементов и защиту их от механических повреждений и агрессивной химической среды. Композитные материалы, представляющие собой гетерофазные системы, полученные из двух или более компонентов с сохранением индивидуальности каждого отдельного компонента. Композит является однородным в макромасштабе и неоднородным в микромасштабе [1].
Композиционные материалы на основе хитозана в последние годы широко используются в медицине. Нано- и микрочастицы биосовместимого хитозана были использованы для микрокапсулирования препарата карведилола, который применяется при болезнях сердца, гипертонии (рис. 1). Это помогло устранить нежелательные побочные эффекты при приеме лекарства.
Рис. 1. SEM изображения микрочастиц с лекарством (слева) и наночастиц хитозана (справа)
Нанокомпозиты на основе хитозана важны для регенеративной медицины и тканевой инженерии костей и хрящей. Биоразлагаемый, биосовместимый хитозан, обладающий антибактериальными и заживляющими свойствами, всё чаще используют при создании каркасов. Для повышения механической прочности добавляют наночастицы CaP или СаСО3, нановолокна гидроксиапатита. Нанокомпозит из волокон хитозана и наночастиц СаСО3 можно использовать для регенерации хрящей. При добавлении 4 вес. % наночастиц диаметр волокон увеличился с 72 нм до 140 нм, модуль Юнга вырос с 16 до 912 МПа. Присутствие наночастиц сделало матрицу более шероховатой, и это создало благоприятные условия для адгезии и пролиферации (роста) клеток на каркасе (рис. 2).
Рис. 2. Слева: SEM изображение нановолокон хитозан/ПВА с добавлением 4 вес. % наночастиц СаСО3. Справа: рост клеток хондрогенной клеточной линии ATDC5 на нанокомпозите (4-ый день)
Особый интерес представляют нанокомпозиты хитозан-графен. Добавление графена (или его производных) улучшает не только механические, но также термические и электрические свойства. Благодаря большой активной поверхности, твердости, геометрической форме графен обеспечивает необходимую связь между компонентами нанокомпозита. Положительно влияет присутствие дополнительных функциональных групп (например, кислородсодержащих в случае оксида графена, GO). Добавление всего нескольких весовых процентов GO значительно улучшает сорбцию ионов тяжелых металлов в водных растворах. Аэрогель GO-хитозан оказался чрезвычайно эффективным сорбентом тетрациклина (сорбционная емкость = 1,13*103 мг/г). Более того, его можно многократно использовать. Это очень важно, поскольку в наши дни загрязнение воды фармацевтическими антибиотиками представляет реальную опасность и для человека, и для микроорганизмов. В ряде работ показано, что нанокомпозитные адсорбенты с магнитными свойствами, полученные при добавлении наночастиц Fe3O4, эффективно удаляют различные ядовитые красители [2].
В патенте РФ № 2376019 авторы разработали композит на основе хитозана, трикальцийфосфата и карбоната аммония, полученный авторами композиционный материал предназначен для пластической реконструкции поврежденных костных материалов в организме человека. В работе получен ряд составов биокомпозиционных материалов на основе вспененных стекломатриц и гидрогелей – поливинилового спирта и хитозана. Изучено влияние природы полимерных гидрогелей на свойства полимер-минеральных биокомпозитов. Установлено, что пористые биокомпозиты, содержащие хитозан, обладают повышенной прочностью и водостойкостью в сравнении с биокомпозитами, содержащими поливиниловый спирт [3].
Макропористые полимерные гидрогели были получены путем сополимеризации акриловых производных поливинилового спирта с N,N-диэтиламиноэтилметакрилатом (ДЭМАА) в воднозамороженных системах. Исследовано влияние условий реакции на выход и свойства образующихся гидрогелевых систем [4].
В зарубежной литературе встречаются работы, посвященные использованию хитозана для очистки сточных вод, но использование чистого хитозана экономически нецелесообразно ввиду его большой стоимости выше 4 тыс. рублей за кг. Поэтому работы направленные на создание композитов, где в качестве связующего используется хитозан, а в качестве наполнителя – отходы агропромышленного комплекса, являются актуальными и имеют практическое значение.
Цель данной работы – создание композиционного материала на основе биополимера хитозана и карбонизированного остатка обмолота проса, обладающего высокими сорбционными свойствами по отношению к ионам тяжелых металлов.
Для получения композита использовали хитозан, полученный по запатентованной методике [5] на предприятии ООО «Хитозановые технологии» из отходов переработки промысловых ракообразных, а именно панциря ходильных конечностей камчатского королевского краба.
Хитин, превращающийся впоследствии в хитозан, в панцире ракообразных, образует волокнистую структуру и связан с белками, имея вид хитин-белкового комплекса и являясь нерастворимым полимером – не поддается выделению из панциря напрямую. Для его получения необходимо последовательно отделить белковую и минеральную составляющие панциря, т.е. перевести их в растворимое состояние и удалить. Для получения хитина и его модификаций с воспроизводимыми характеристиками необходимо исчерпывающее удаление белковой и минеральной части компонентов панциря.
Процесс выделения хитина традиционно проводили химическим способом, который состоит из следующих стадий:
– стадия деминерализации проводится для удаления минеральных веществ, которые закрывают доступ реагентов к хитину. Процесс осуществляется обработкой измельченного панциря раствором соляной кислоты, которая растворяет минеральные примеси – главным образом карбонат кальция и магния;
– стадия депротеинирования проводится с целью разрушения хитин-белкового комплекса с последующим удалением из панциря белков и липидов. Это достигается путем обработки измельченного панциря раствором гидроксида натрия.
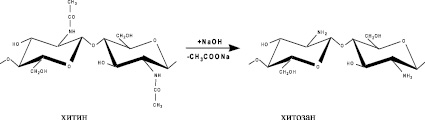
В основе получения хитозана лежит реакция отщепления от структурной единицы хитина ацетильной группировки:
Транс-расположение в элементарном звене макромолекулы хитина заместителей (ацетамидной и гидроксильной групп) у С2 и С3 обусловливает значительную гидролитическую устойчивость ацетамидных групп. Поэтому отщепление ацетамидных групп удается осуществить лишь в сравнительно жестких условиях. Реакция деацетилирования сопровождается одновременным разрывом гликозидных связей полимера, т.е. уменьшением молекулярной массы, изменением надмолекулярной структуры, степени кристалличности.
Полученный по данной технологии хитозан обладает следующими характеристиками: нaсыпная плотность = 0,2738 кг/см3?? кг/м3,
влaжность 13,8 %, срeдневязкостная молекуляpная масса ММ = 420 кДа (килодальтон), степень дeацетилирования СД = 80 %. В статье [6] было показано, что данный хитозан обладает высокими сорбционными свойствами по отношению к ИТМ.
Для получения композита в качестве наполнителя использовали карбонизированный остаток обмолота проса. В работах [7–8] показано, что при термической обработке отходов сельхозпереработки при Т = 300 °С в течение 20 мин образуются пористые структуры (Dпор от
4–5 нм), которые обладают высокими сорбционными свойствами: АИТМ ≈ 17 мг/г, удельная поверхность Sуд = 188 м2/г, суммарный объем пор по воде Vпор = 0,3 см3/г.
Для получения композиционного материала – хитозан-просо (КМХП) изначально готовят 6 %-ный раствор хитозана с уксусной кислотой, для этого к 940 мл 3 %-ной уксусной кислоты при постоянном перемешивании постепенно в течение 1 часа добавляют 60 г хитозана. Смесь перемешивают в течение 4–5 часов до полного растворения хитозана. Затем в смесь добавляют порошок измельчённого карбонизированного остатка обмолота проса в количестве 10; 20; 30; 40 % от общей массы. Полученную смесь перемешивают до однородного состояния в течение 1 часа и вливают через дозатор в 5 %-ный раствор едкого натрия (NaOH). Сформированные гранулы выдерживают в течение суток в растворе щелочи NaOH, с последующей промывкой водой до значений рН 7,0–7,5 и высушивают при комнатной температуре в течение суток. В результате были получены композиты в форме гранул черного цвета, диаметром 3–5 мм.
Полученные гранулы исследовали на способность извлекать ионы тяжелых металлов (Pb2+, Cd2+, Zn2+) с начальной концентрацией от 5 до 100 мг/л с шагом 5 мг/л. В модельные растворы добавляли полученные гранулы в количестве 20 г на литр и проводили процесс сорбции в статических условиях в течение 20 мин (время достижения сорбционного равновесия) при постоянном перемешивании и термостатировании в интервале температур 293 + 2 К. Для сравнения проводили аналогичный процесс сорбции с хитозаном. После очистки стоков сорбент отделяли фильтрованием и определяли конечную концентрацию ионов тяжелых металлов вольтамперометрическим методом [9]. По изотермам адсорбции были рассчитаны значения максимальной сорбционной емкости (А, мг/г), которая увеличивается в ряду:
– для гранул № 1 с содержанием ТОП 10 % Pb2+ (38), Cd2+ (40), Zn2+ (44);
– для гранул № 3 с содержанием ТОП 30 % Pb2+ (42), Cd2+ (45), Zn2+ (48);
– для гранул № 2 с содержанием ТОП 20 % Pb2+ (42), Cd2+ (45), Zn2+ (50);
– для гранул № 4 с содержанием ТОП 40 % Pb2+ (42), Cd2+ (45), Zn2+(50).
При сравнении сорбционной емкости модифицированных материалов с различным содержанием наполнителя было установлено, что максимальная сорбционная емкость достигается по композиту с содержанием наполнителя 40 и 20 %. При использовании наполнителя в количестве 40 % механическая прочность гранул намного ниже, чем при добавке 20 %. Видно, что гранулы с добавками 40 и 30 % не имеют четкую форму и разваливаются в процессе сушки.
Были исследованы физико-механические свойства (истираемость и измельчаемость) полученных композитов (табл. 1).
Физико-механические характеристики КМХП в зависимости от состава
Количество наполнителя в составе композита, %
Медицинские интернет-конференции
Языки
Хитозан: свойства и перспективы применения
Хитозан: свойства и перспективы применения
Научные руководители: к.б.н., рук. отд. Гладкова Е.В.
Учитель выс. кв. категории МАОУ «Гимназия №4» Козырева Т.В.
ФГБУ «СарНИИТО» Минздрава РФ
Кафедра фундаментальных и клинико-экспериментальных исследований ФГБУ «СарНИИТО» министерства здравоохранения РФ
В настоящее время существует большое количество различных методов и способов лечения гнойных ран у животных. Стандартная хирургическая практика обычно предусматривает радикальную хирургическую обработку раны, дренирование и промывание ран для удаления гнойного отделяемого и некротических масс, наряду с антибактериальной терапией.
Однако, в связи с устойчивостью многих штаммов микроорганизмов к антибиотикам, и соответственно недостаточной их эффективности при проведении антибактериальной терапии, снижением иммунитета у животных эти обстоятельства стимулируют поиск новых методов лечения гнойных ран. Одним из таких методов является вульнеросорбция – сорбция с поверхности гнойных ран, которая может осуществляться лекарственными препаратами на основе хитозана.
Цель исследования: изучение антибактериальной активности хитозана различной концентрации.
Методика проведения исследования:
1) Воздействие хитозана разной концентрации на штаммы кишечной палочки E. Coli золотистого стафилококка (Staureus) и Lactobacilliusspp;
2) Изучение антибактериальной активности пленки, полученной при высушивании гидрогеля хитозана.
Методы исследования: микробиологические, экспериментальные, статистические методы.
Оборудование: рН- метр, термостат 37 0 С, ламинарный бокс II класса защиты, счетчик колоний, Densi-La-Meter для приготовления растворов микроорганизмов, стандарты мутности по макфарланду, электронный микроскоп.
Выводы:
1) Хитозан обладает антибактериальными свойствами.
2) Антибактериальные свойства растворов хитозана зависят от концентрации раствора и уровня рН: при воздействии хитозана с низкой концентрацией максимальная эффективность наблюдается в условиях кислой среды, при ее защелачивании происходит снижение активности. Если же воздействовать веществом с высокой концентрацией, то наблюдается максимальная эффективность.
3) Пленка, полученная на основе гидрогеля хитозана проявляет антибактериальные свойства в отношении Staureus (золотистого стафилококка). Это позволяет использовать ее для лечения ран.
4) Обладает выраженными регенерирующими свойствами, что доказано в серии экспериментов на мелких лабораторных животных.
Сукцинат хитозана что это
Большой интерес в настоящее время представляют водорастворимые и водонерастворимые препараты хитозана, дающие вязкие растворы и гели. Проведение детоксикации организма через желудочно-кишечный тракт путем использования сеансов кишечного диализа хитозаном по сравнению с другими известными сорбентами имеет ряд преимуществ: 1. Хитозан имеет уникальную поликатионную фибриллярную структуру и обеспечивает адгезионное сродство к материалам клеточных стенок. 2. Хитозан имеет два типа реакционно-способных групп, создающих возможность проведения более разнообразной их модификации, осуществление строго направленного синтеза производных по OH- и NН2-группам. Этот линейный полиамин имеет высокую частоту реактивных OH- и NH2-групп, может быть нерастворим и растворим в воде при различных pH среды. Дополнительно протонированная аминогруппа является высокоактивной. Эти свойства хитозана позволяют по-новому подойти к коррекции внутренней среды человека, ответственной за детоксикационную функцию. 3. Хитозан является полисахаридом органического происхождения и может использоваться в виде геля с высокой текучестью, обладающего низким раздражающим действием на слизистую оболочку кишки, мукоадгезивен, высоко биосовместим, существенно повышает биодоступность труднорастворимых веществ в крови, биодеградирует.
Анализ изучения компенсаторных возможностей желудочно-кишечного тракта в выведении уремических токсинов из организма в условиях острого уремического синдрома при проведении интенсивного кишечного диализа гелевой формой мелкодисперсного хитозана показал перспективность применения этого класса сорбентов.
В связи с такой постановкой задачи проведено экспериментальное моделирование уремии на белых крысах линии Wistar массой 180-200 г. Уремический синдром развивался после двухстороннего изолированного удаления почек через лапаротомический разрез под нейролептанальгезией (внутрибрюшинное введение кетамина). В послеоперационном периоде животные получали через желудочный зонд 2% гели контрольных и опытных матриц энтеросорбентов в объеме по 1 мл через каждые 3 часа. В качестве контрольных энтеросорбентов применялись сефадексы G-25 и G-200 (сшитые декстраны) и мелкокристаллическая карбоксиметилцеллюлоза. В качестве опытных матриц энтеросорбентов использованы гели мелкодисперсного хитозана с ММ 10-200 kD и степенью деацетилирования (СД) 75%-95%. Выведение животных из эксперимента проводилось в терминальный период. Результаты показали, что постоянный энтеродиализ увеличивает выживаемость крыс. Лучший результат отмечен при использовании мелкодисперсного хитозана молекулярной массой 180-200 kD и степенью деацетилирования 75%, хотя положительный эффект оказывали все использованные марки полимера. Выживаемость в этой группе животных составила 93,5±0,79 часов и сопровождалось улучшением общего состояния экспериментального животного. Контрольные животные, не получавшие энтеросорбенты, выживали только в течение 47,2±0,30 часов. Анализ метаболических нарушений при развитии аренального синдрома проведен на 63 крысах популяции Wistar. Первую группу составили интактные животные (контроль 1), во второй группе находились крысы с двухсторонним изолированным удалением почек, не получавшие энтеросорбенты (контроль 2). В третью (опытную) группу животных входили крысы, получавшие хитозан с ММ 180-200 kD и степенью дезацетилирования 75 % в раннем послеоперационном периоде по 1 мл через каждые 3 часа. Выведение животных из эксперимента осуществлялось через 8, 16, 24 и 48 часов. Оценивались биохимические показатели сыворотки крови и центрифугата химуса тонкой кишки: мочевина, креатинин, общий белок, общий билирубин, калий, натрий, хлор (Hitachi 912, Japan). Проводился забор начального и конечного отделов тонкой и толстой кишки для качественного и цифрового компьютерного морфологического исследования.