что значит иммунокомпрометированный пациент
Иммунокомпрометированные пациенты в многопрофильном лечебном учреждении
Полный текст:
Аннотация
Ключевые слова
Об авторах
Список литературы
1. Rich R.R., Fleisher T.A., Shearer W.T. et al. Clinical Immunology: Principles and Practice. 4th Ed. Elsevier; 2013.
2. Chear C.T., Ripen A.M., Mohamed S.A., Dhaliwal J.S. A novel BTK gene mutation creates a de-novo splice site in an X-linked agammaglobulinemia patient. Gene. 2015; 560 (2): 245–253. DOI: 10.1016/j.gene.2015.02.019.
3. Hacein-Bey-Abina S., Hauer J., Lim A. et al. Efficacy of gene therapy for X-linked severe combined immunodeficiency. N. Engl. J. Med. 2010; 363 (4): 355–419. DOI: 10.1056/NEJMoa1000164.
4. Audemard-Verger A., Descloux E., Ponard D. et al. Infections Revealing complement deficiency in adults: A french nationwide study enrolling 41 patients. Medicine (Baltimore). 2016; 95 (19): 1–4. DOI: 10.1097/MD.0000000000003548.
5. Gokengin D., Oprea C., Uysal S., Begovac J. The growing HIV epidemic in Central Europe: a neglected issue? J. Virus Erad. 2016; 2 (3): 156–217.
6. Pruetpongpun N., Khawcharoenporn T., Damronglerd P. et al. Disseminated talaromyces marneffei and Mycobacterium abscessus in a patient with anti-interferon-#g autoantibodies. Open Forum Infect Dis. 2016; 3 (2): 1–4. DOI: 10.1093/ofid/ofw093.
7. Готье С.В., Мойсюк Я.Г., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2014 году. VII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2015; 17 (2): 7–22. DOI:10.15825/1995-1191-2015-2-7-22.
8. Готье С.В., Хомяков С.М. Оценка потребности населения в трансплантации органов, донорского ресурса и планирование эффективной сети медицинских организаций (центров трансплантации). Вестник трансплантологии и искусственных органов. 2013; (3): 11–24.
9. Burroughs M., Moscona A. Immunization of pediatric solid organ transplant candidates and recipients. Clin. Infect. Dis. 2000; 30 (6): 857–869. DOI: 10.1086/313823.
10. Rubin L.G., Levin M.J., Ljungman P. et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin. Infect. Dis. 2014: 58 (3): 309–318. DOI: 10.1093/cid/cit816.
11. Heijstek M.W., Ott de Bruin L.M., Bijl M. et al. EULAR recommendations for vaccination in paediatric patients with rheumatic diseases. Ann. Rheum. Dis. 2011; 70 (10): 1704–1712. DOI: 10.1136/ard.2011.150193.
12. Harpaz R., Ortega-Sanchez I.R., Seward J.F. Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 2008; 57 (RR-5): 1–30.
13. Островский Ю.П., Рачок Л.В., Гребенюк И.А. и др. Инфекционные осложнения у пациентов, перенесших ортотопическую трансплантацию сердца. Вестник трансплантологии и искусственных органов. 2011; (4): 24–31.
14. Биличенко Т.Н., Аргунова А.Н., Антонова О.А. и др. Частота пневмококковой пневмонии у взрослых больных терапевтических стационаров на трех территориях Российской Федерации. Пульмонология. 2013; (4): 30–36.
15. Позиция ВОЗ по полисахаридной пневмококковой вакцине. Еженедельный эпидемиологический бюллетень. 2008; 83 (42): 373–384.
16. Moberley S., Holden J., Tatham D.P., Andrews R.M. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst. Rev. 2008; (1): CD000422.
17. Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23 valent pneumococcal polysaccharide vaccine (PPSV23). Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 2010; 59 (34): 1102–1106.
18. Каракина М.Л. Регистр взрослых пациентов с первичными иммунодефицитами Свердловской области. Общественное здоровье и здравоохранение. 2016; (1); 57–63.
19. Виноградов А.В., Бельтюков Е.К., Каракина М.Л. и др. Опыт организации оказания персонализированной медицинской помощи больным первичными иммунодефицитами в медицинских организациях Свердловской области. Уральский медицинский журнал. 2014; 6 (120): 31–34.
20. Бельтюков Е.К., Виноградов А.В., Тузанкина И.А., Каракина М.Л. Об организации специализированной медицинской помощи взрослому населению Свердловской области по профилю «Аллегология и иммунология». Российский иммунологический журнал. 2014; (3): 482–483.
21. Виноградов А.В., Бельтюков Е.К., Каракина М.Л., Чадова Е.А. Организация оказания медицинской помощи взрослым больным первичными иммунодефицитами с дефектами антителопродукции в Свердловской области. Уральский медицинский журнал, 2015; 9 (132): 57–60.
22. Shearer W.T., Fleisher A., Buckley R.H. et al. Recommendations for live viral and bacterial vaccines in immunodeficient patients and their close contacts. J. Allergy Clin. Immunol. 2014; 133 (4): 961–966. DOI: 10.1016/j.jaci.2013.11.043.
23. Aguilar C., Malphettes M., Donadieu J. et al. Prevention of infections during primary immune deficiencies. Immunocompromised Hosts. Clinical Infectious Diseases Advance Access published September 28, 2014. Available at: http://cid.oxfordjournals.org
24. Снегова Н.Ф., Харит С.М., Лянко Л.М. Основные подходы к иммунизации детей с первичными иммунодефицитами. Бюллетень «Вакцинация. Новости вакцинопрофилактики». Иммунодефициты. 2003; 6 (30): 32–35.
25. International Diabetes Federation Diabetes Atlas, 5th ed. Brussels; 2011. Available at: http://www.idf.org/diabetesatlas
26. Kornum J.B., Thomsen R.W., Riis A. et al. Type 2 diabetes and pneumonia outcomes: A population-based cohort study. Diabetes Care. 2007; 30 (9): 2251–2257. DOI: 10.2337/dc06-2417.
27. Smith S.A., Poland G.A. Use of influenza and pneumococcal vaccines in people with diabetes. Diabetes Care. 2000; 23 (1): 95–108.
28. Fiore A.E., Shay D.K., Broder K. et al. Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 2008; 57 (RR-7): 1–60.
29. American Diabetes Association. Standards of Medical Care in Diabetes – 2012. Diabetes Care. 2012; 35 (Suppl. 1): S11–S63. DOI: 10.2337/dc12-s011.
30. Ощепков А.В., Цаур Г.А., Есева С.С. и др. Эпидемиологические аспекты болезни Крона в Свердловской области. Вестник уральской медицинской академической науки. 2015; (3): 36–38.
Вакцинопрофилактика иммунокомпрометированных пациентов
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «29» марта 2019 года
Протокол №60
Название протокола: Вакцинопрофилактика иммунокомпрометированных пациентов
Код(ы) МКБ-10: нет
Дата разработки протокола: 2018 год.
Сокращения, используемые в протоколе:
| АбКДС | – | адсорбированная бесклеточная коклюшно- дифтерийно столбнячная вакцина |
| БЦЖ | – | вакцина против туберкулеза |
| ИПВ | – | инактивированная полиовакцина |
| ОПВ | – | оральная полиомиелитная вакциной |
| ТГСК | – | трансплантация гемопоэтических стволовых клеток |
Пользователи протокола: врачи общей практики, участковые терапевты, педиатры, медицинские сестеры прививочного кабинета (иммунопрофилактики), инфекционисты, аллегологи-иммунологи.
Категория пациентов: взрослые, дети
В данном разделе представлен Национальный календарь профилактических прививок в РК [2].
Схема вакцинации в Республике Казахстан:
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Цель проведения процедуры/вмешательства:
Профилактика инфекционных заболеваний, предупреждаемых вакцинацией у лиц с врожденным или приобретенным иммунодефицитным состоянием.
Показания и противопоказания к процедуре
Показания к процедуре/вмешательству:
— плановая вакцинация
— вакцинация по эпидемиологическим показаниям
Таблица 1 – Иммунокомпроментированные состояния
| № | Нозологические формы | Показания к процедуре |
| 1 | Врожденный (первичный) иммунодефицит | Плановая вакцинация/вакцинация по эпидпоказаниям |
| 2 | Приобретенный(вторичный) иммунодефицит -трансплантациюгемопоэтических стволовых клеток (ТГСК) -трансплантация цельного органа -ВИЧ-инфекция | Плановая вакцинация/вакцинация по эпидпоказаниям |
В таблице 2 и 3 представлены вакцинация лиц с врожденным иммунодефицитом.
| Инактивированная вакцина | Врожденный иммунодефицит (дефицит B-клеток, T-лейкоцитов, системы комплемента, смешанные дефекты, нарушения фагоцитоза и нейтрофильные нарушения) |
| Вакцина против дифтерии | Применяется в плановом порядке |
| Вакцина против гемофильной палочки типа b (Hib) | Дети в возрасте младше 5 лет: применяется в плановом порядке Лица в возрасте от 5 лет: рекомендуется одна доза, однократно |
| Вакцина против гепатита A | Применяется по показанию |
| Вакцина против гепатита B | Рекомендуется |
| Противогриппозная вакцина (инактивированная) | Рекомендуется |
| Вакцина против коклюша | Применяется в плановом порядке |
| Пневмококковая конъюгатная 13-и валентная вакцина | Рекомендуется |
| Вакцина против полиомиелита (инактивированная) | Применяется в плановом порядке |
| Вакцина против бешенства | Применяется по показанию |
| Вакцина против столбняка | Применяется в плановом порядке |
| Живая ослабленная вакцина | Врожденный иммунодефицит | ||||
| Дефицит гуморального звена иммунитета | Дефицит клеточного звена иммунитета | Нарушение фагоцитоза и нейтрофильные нарушения | Дефицит системы комлемента | ||
| Полное отсутствие антител | Снижение продукции антител | ||||
| БЦЖ- вакцина | Противопоказана | Применяется по показанию | Противопоказана | Противопоказана | Применяется по показанию |
| Противогриппозная вакцина (живая) | Противопоказана | Применяется по показаниям | Противопоказана | Применяется по показаниям | Применяется по показаниям |
| Вакцина против кори, краснухи, эпидемического паротита | Применяется по показаниям | Применяется в плановом порядке | Противопоказана | Применяется в плановом порядке | Применяется в плановом порядке |
| Вакцина против желтой лихорадки | Противопоказана | Применяется по показаниям | Противопоказана | Применяется по показаниям | Применяется по показаниям |
1 через три месяца в случае восстановления иммунитета после консультации специалиста по трансплантации и иммунолога.
| Вакцина | До трансплантации | После трансплантации (если не было вакцинации до трансплантации) |
| Вакцина против дифтерии | Применяется в плановом порядке | Применяется в плановом порядке |
| Вакцина против гемофилической палочки типа b (Hib) | Дети в возрасте младше 5 лет: применяется в плановом порядке. Лица в возрасте от 5 лет: рекомендуется одна доза, однократно | Дети в возрасте младше 5 лет: применяется в плановом порядке. Лица в возрасте от 5 лет: рекомендуется одна доза, однократно |
| Вакцина против гепатита A | Применяется, если есть показания. (рекомендуется кандидатам на трансплантацию с хронической печеночной недостаточностью. | Применяется, если есть показания |
| Вакцина против гепатита B | Применяется в плановом порядке | Применяется в плановом порядке (после трансплантации реципиентам рекомендуется более высокая доза. После вакцинации рекомендуется провести серологическое исследование anti- HBs с проведением ревакцинации, если ответ составляет менее 10 МЕ/Л. Рекомендуется периодический мониторинг титров anti-HBs) |
| Вакцина против гриппа (инактивированная) | Рекомендуется каждый год | Рекомендуется каждый год |
Таблица 6- Вакцинация ВИЧ-инфицированных лиц
1 Применение в плановом порядке: Следуйте графикам плановой вакцинации с применением ревакцинирующих доз по графику
2 Если нет существенного подавления иммунитета.
к ИПВ:
— немедленные аллергические реакции на неомицин или стрептомицин, используемые в производстве вакцин;
вакцине, содержащей столбнячный анатоксин (АДС-М, АС):
— синдром Гийена-Барре, развившийся в течение шести недель после предыдущего введения вакцины, содержащей столбнячный анатоксин;
к вакцинам, содержащим аттенуированные живые вирусы:
— анафилактические реакции на белок куриного яйца (если вакцинные вирусы выращивают в куриных эмбрионах), аминогликозиды, неомицин и другие антибиотики, используемые в производстве вакцин;
к вакцине против гриппа, полученной на куриных эмбрионах:
— аллергические реакции на белок куриного яйца, компоненты среды для культивирования штаммов (белки, антибиотики и другие вещества);
вакцине против ВГВ и другим рекомбинантным или комплексным вакцинам, содержащим отдельные рекомбинантные иммуногены: немедленные аллергические реакции на компоненты дрожжеподобных грибов, бактерий или других клеток, применяемых в производстве вакцин.
Перечень основных и дополнительных диагностических мероприятий:
— Основные диагностические мероприятия: осмотр врача общей практики/ терапевта/педиатра
— Дополнительные диагностические мероприятия: прививаемого лица перед проведением профилактических прививок проводят;
— в случае предъявления им жалоб на ухудшение состояния здоровья;
— при наличии объективных симптомов заболеваний;
— при непереносимости вакцин – консультация аллерголога-иммнолога.
Требования к проведению процедуры/вмешательства [15]:
— Профилактические прививки проводятся в специально оборудованных прививочных кабинетах медицинских организаций и (или) организаций образования при наличии лицензии на осуществление первичной медико-санитарной помощи, консультативно-диагностической и (или) стационарной медицинской помощи взрослому и (или) детскому населению.
— Прививочные кабинеты обеспечиваются наборами для неотложной и противошоковой терапии с инструкцией по их применению.
— В случае отсутствия медицинской организации в населенном пункте, медицинского работника в медицинской организации профилактические прививки проводятся выездной прививочной бригадой. В состав выездной прививочной бригады, укомплектованной автотранспортом, термоконтейнером, прививочным материалом, одноразовыми и самоблокирующимися шприцами, противошоковыми препаратами, входит квалифицированный врач и прививочная медицинская сестра, имеющие разрешение к проведению профилактических прививок.
— В прививочном кабинете не допускается проведение других медицинских процедур (манипуляций).
— Перед проведением профилактической прививки иммунокомпрометированных пациентов врач общей практики или педиатр (по показаниям иммунолог-аллерголог) при отсутствии противопоказаний к иммунизации оформляет допуск к проведению прививки в медицинском документе прививаемого, предоставляет прививаемому или его родителям или законному представителю полную и объективную информацию о профилактической прививке, возможных реакциях и неблагоприятных проявлениях после иммунизации, последствиях отказа от прививки. У пациентов
Добровольное информированное согласие или отказ на проведение профилактических прививок оформляется в письменном виде.
Индикаторы эффективности процедуры:
1. выработка в организме специфических антител
2. отсутствие инфекционного заболевания
Препараты (действующие вещества), применяющиеся при лечении
| Вакцина пневмококковая полисахаридная конъюгированная адсорбированная инактивированная, жидкая, 13 валентная |
| Вакцина против кори, краснухи и эпидемического паротита (The vaccine against measles, mumps and rubella) |
Группы препаратов согласно АТХ, применяющиеся при лечении
| (J07BG) Вакцина для профилактики бешенства |
| (J07BC) Вакцина для профилактики гепатита |
| (J07BB) Вакцина для профилактики гриппа |
| (J07AF) Вакцина для профилактики дифтерии |
| (J07AG) Вакцина для профилактики инфекций, вызываемых Haemophilus influenza B |
| (J07AJ) Вакцина для профилактики коклюша |
| (J07AL) Вакцина для профилактики пневмококковой инфекции |
| (J07AM) Вакцина для профилактики столбняка |
| (J07AN) Вакцина для профилактики туберкулеза |
| (J07BF) Вакцины для профилактики полиомиелита |
| (J07BX) Другие вакцины для профилактики вирусных инфекций |
Информация
Источники и литература
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
1) Кошерова Бахыт Нургалиевна – доктор медицинских наук, профессор, НАО «Медицинский университет Караганды», проректор по клинической работе и непрерывному профессиональному развитию, высшая квалификационная категория;
2) Баешева Динагуль Аяпбековна – доктор медицинских наук, заведующая кафедрой детских инфекционных болезней НАО «Медицинский университет Астана»;
3) Дуйсенова Амангуль Куандыковна – доктор медицинских наук, профессор, заведующая кафедрой инфекционных болезней с курсом дерматовенерологии АО «Национальный Медицинский университет», высшая квалификационная категория;
4) Ким Антонина Аркадьевна – кандидат медицинских наук, НАО «Медицинский университет Караганды», профессор кафедры инфекционных болезней и дерматовенерологии;
5) Жунусов Ержан Сейполович – доктор Рhd, НАО «Медицинский университет Караганды».
Указание на отсутствие конфликта интересов: нет.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие по мере накоплений знаний по новым вакцинам с уровнем доказательности.
Что значит иммунокомпрометированный пациент
И.В. Нестерова (1), С.В. Ковалева (2), Г.А. Чудилова (2), Л.В. Ломтатидзе (2), О.Н. Шинкарева (2), В.В. Малиновская (3)
(1) ФГАОУ ВО «Российский университет дружбы народов», Минобрнауки РФ, Москва; (2) ГБОУ ВПО «КубГМУ» Минздрава России, Краснодар; (3) ФГБУ «НИИЭМ им. Н.Ф. Гамалеи» Минздрава России, Москва
Проблема реабилитации диспансерной группы часто и длительно болеющих (ЧДБ) детей не теряет своей актуальности и сегодня, несмотря на широкое освещение вопросов, связанных с оптимизацией используемых приемов и методов, которые в большинстве случаев позволяют добиваться позитивных клинических результатов. В то же время среди ЧДБ детей имеются пациенты, не отвечающие на традиционные методы реабилитации и, несмотря на кажущуюся адекватность проводимых лечебных мероприятий, продолжающие болеть респираторными инфекциями (вирусными, бактериальными или вирусно-бактериальными) с высокой степенью частоты. Такие пациенты, как правило, относятся к категории иммунокомпрометированных, при этом частота эпизодов ОРВИ может достигать 15–24 и более в год. Такая высокая частота возвратных респираторных инфекций является клиническим проявлением инфекционного синдрома, ассоциированного с нарушениями механизмов функционирования противовирусной и антибактериальной иммунной защиты, а также с дефектами системы интерферонов (ИФН). Кроме того, показано, что у детей возвратные ОРВИ часто ассоциированы с различными активными и/или латентными герпесвирусными инфекциями [1–5].
При контакте с вирусами должна происходить немедленная активация врожденного иммунитета – продукция ИФН I типа и провоспалительных цитокинов, которые инициируют последующее включение в активную работу механизмов адаптивного иммунитета. ИФН реализуют свои эффекты через когнитивные рецепторные комплексы (IFNAR и IFNGR) [6, 7]. При острой вирусной инфекции значительно повышаются уровни ИФН и более 70% клеток находятся в состоянии антивирусного статуса, т.е. защищены от внедрения вирусов, и способны активно их обезвреживать. В то же время тяжелые вирусные инфекции повреждают систему ИФН [8], могут приводить к ее истощению и как следствие – присоединению вторичной инфекции. Описаны врожденные генетические дефекты синтеза ИФНα/β и ИФНγ, дефекты рецепторов к ИФНα и ИФНγ (IFNAR и IFNGR), которые сопровождаются клиническими проявлениями тяжелой вирусной и/или микобактериальной инфекции. С другой стороны, многочисленными исследованиями убедительно показано, что вторичное приобретенное нарушение системы ИФН также влечет за собой снижение противовирусной резистентности. Вирусы используют различные контрмеры для борьбы с системой ИФН. Они могут не только ускользать от воздействия ИФН, но и ингибировать действие ИФН, нарушать их продукцию посредством разнообразных механизмов [9–12]. Описаны приобретенные дефекты в системе ИФН у лиц, страдающих повторными ОРВИ и различными герпесвирусными инфекциями (ГВИ). Кроме того, показана возможность длительной персистенции респираторных вирусов, в т.ч. и непосредственно в клетках иммунной системы (ИС) [2, 3, 6, 13].
Наиболее широко в комплексе иммунореабилитационных мероприятий для иммунокомпрометированных детей с повторными ОРВИ и ГВИ используются различные препараты рекомбинантного ИФНα2, что обусловлено универсальным противовирусным, антибактериальным и иммуномодулирующим характером действия ИФНα2 [1, 5, 13–15]. Многолетний опыт использования рекомбинантного ИФНα2 показал, что наряду с позитивными эффектами в ряде случаев при проведении интерферонотерапии у детей как в острый период, так и при повторных ОРВИ, рецидивирующей и/или активной различной ГВИ не удается достичь стойкой и длительной клинико-иммунологической ремиссии, элиминации вирусных патогенов [15]. Предложена и доказана целесообразность модификации интерферонотерапии, заключающейся в применении увеличенных доз и длительности курса терапии в острый период ОРВИ у детей с отягощенным преморбидным фоном [1, 14]. При повышенной восприимчивости к ОРВИ у детей, наличии иммунодефицита и интерферонодефицита обоснованно использование пролонгированной терапии (не менее 2,0–2,5 месяцев) рекомбинантным ИФНα с постепенным «шаг за шагом» снижением суточной дозы препарата каждые 2–4 недели. Однако даже при таком подходе у части иммунокомпрометированных детей при существенном увеличении длительности клинически благополучного периода не удается добиться желаемого клинического эффекта, восстановления нарушенных функций ИС и системы ИФН [13]. В то же время имеются пациенты, страдающие не только возвратными вирусными, но и бактериальными инфекциями респираторного тракта и лимфоглоточного кольца, у которых наряду с нарушениями в системе ИФН имеют место дефекты функционирования противобактериального иммунитета, манифестирующие частыми обострениями хронического тонзиллита, хронического синусита, хронического отита и т.д.
Исходя из изложенного, нами сделано предположение о возможности повышения клинической эффективности и улучшения результатов реабилитации иммунокомпрометированных детей с возвратными ОРВИ, с возвратными ОРВИ осложняющимися частыми обострениями хронической бактериальной инфекции лимфоглоточного кольца и респираторного тракта, ассоциированными с рецидивирующими и латентными ГВИ, за счет оптимизации сочетанной пролонгированной интерферонотерапии с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией.
Цель исследования: разработать эффективную программу интерферонотерапии в сочетании с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией для иммунокомпрометированных детей, страдающих возвратными вирусными или вирусно-бактериальными респираторными инфекциями, ассоциированными с рецидивирующими и/или латентными ГВИ.
Материал и методы
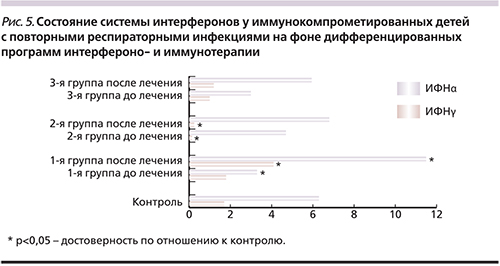
Под нашим наблюдением находились 47 детей в возрасте от 5 до 8 лет обоего пола: 1-я группа – 13 детей, страдавших повторными ОРВИ, ассоциированными с моноили микстГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа); 2-я группа – 14 детей, страдавших повторными ОРВИ, ассоциированными с моноили микст-ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа); 3-я группа – 20 детей с повторными ОРВИ, ассоциированными с хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа) и хронической ЛОР-патологией. Контрольную группу составили 20 условно здоровых детей, сопоставимых по полу и возрасту. Тестирование состояния ИС и ИФН-статуса проводилось дважды – до и после проведения курсов интерферонои иммунотерапии вне периода острых клинических проявлений респираторных и герпетических инфекций, хронических заболеваний ЛОР-органов. Исследованы: а) субпопуляции Т-, В-лимфоцитов, естественных киллерных клеток (ЕКК) (Beckman Coulter, США); б) уровень сывороточных IgA, IgM, IgG (ИФА); в) фагоцитарная и микробицидная функции нейтрофильных гранулоцитов (НГ) с определением количества активно фагоцитирующих НГ (%ФАН, ФАНабс), оценкой процессов киллинговой активности (ФЧ и ФИ) и переваривания (%П, ИП, ИППА); г) NADPH-оксидазная активность НГ – NBT-тест спонтанный и стимулированный St. aureus (штамм 209): %ФПК, СЦИ и коэффициент мобилизации (КМ – %ФПКст/%ФПКсп.); д) ИФНстатус – уровень сывороточных ИФНα, ИФНγ (ИФА). Детекция герпесвирусов проводилась серологическими и ПЦР-методами. Для выявления типичной и атипичной бактериальной флоры использовались бактериологические посевы из носои ротоглотки, ПЦР и серодиагностика. Для оценки клинической эффективности комбинированной интерферонои иммунотерапии использовались клинические критерии: частота и длительность ОРВИ, длительность клинически благополучного периода. Статистическую обработку данных проводили в программном пакете StatSoft Statistica 6.0. Для сравнения групп использовали непараметрические критерии: U-критерий Манна–Уитни и критерий Вилкоксона. Различие групп полагали статистически значимым при р 0,05) (рис. 5). Значительный дефицит ИФНγ имел место во 2-й группе (0,11±0,07 против 1,78±0,53 пг/мл в контроле, р 0,05). В 3-й группе также выявлено дефектное функционирование системы ИФН. Так, на фоне персистенции респираторных вирусов и репликации герпесвирусов уровень сывороточного ИФНα и ИФНγ не возрастал в ответ на контакт с вирусами, а оставался в пределах контрольных значений (ИФНα – 5,07±0,25 против 6,42±1,05 пг/мл в контроле, р>0,05; ИФНγ – 1,05±0,11 против 1,78±0,53 пг/мл в контроле, р>0,05) (рис. 5). Таким образом, в 100% случаев у детей с повторными ОРВИ установлены дефекты системы ИФН в виде снижения уровня ИФНα и/или ИФНγ либо отсутствия адекватного ответа на вирусную нагрузку системы ИФН.
На основе выявленных нарушений функционирования иммунной и интерфероновой систем нами разработаны программы оптимизированной монотерапии рекомбинантным человеческим ИФНα2b (ИФНɑ2b) в комбинации с антиоксидантами (аскорбиновая кислота и α-токоферола ацетат) и комбинированной интерферонои иммуномодулирующей терапии, учитывающие дифференцированные подходы к реабилитации иммунокомпрометированных детей с повторными ОРВИ. Обследованные иммунокомпрометированные дети, рандомизированные на три группы в зависимости от клинико-иммунологического статуса, получали следующие программы интерферонои иммунотерапии (табл. 1).
В результате проведения базисной системной и локальной терапии ИФНα2b в виде моноили комбинированной интерферонои иммунотерапии продемонстрирована высокая клиническая эффективность разработанных программ лечения детей с повторными ОРВИ, ассоциированными с ГВИ без сопутствующей хронической ЛОР-патологии (группы 1 и 2) или сопровождающимися хроническими заболеваниями ЛОР-органов (группа 3) как после окончания курсового лечения, так и в катамнезе через 1 год (рис. 1). В рамках программного лечения регистрировались единичные, как правило неосложненные, ОРВИ. После окончания курсового лечения частота эпизодов ОРВИ сократилась в 12,6 раза в 1-й группе, в 16,8 – во 2-й, в 10,7 раза – в 3-й группе. Продолжительность клинически благополучного периода существенно возросла (в 3 раза; р1 0,05) и восстановился баланс между CD3+CD4+и CD3+CD8+-лимфоцитами (р>0,05). При этом абсолютное содержание СD16+CD56+-лимфоцитов осталось повышенным (р 0,05), а ИФНγ при тенденции к повышению оставался ниже контрольных значений (с 0,11±0,07 до 0,21±0,12 пг/мл против 1,78±0,53 пг/мл в контроле; р 0,05). Одновременно после курса терапии количество других клеток с цитотоксической направленностью действия – ЕКК – также снизилось незначительно и по-прежнему было достоверно повышенным (р 0,05) при одновременной нормализации поглотительных функций (ФИ – 2,16±0,16; р>0,05). Сохраняется некоторое снижение процессов киллинга и переваривания НГ (ИП – 1,37±0,13; р 0,05) и ИФНγ (с 1,05±0,11 до 1,21±0,86 пг/мл против 1,78±0,53 пг/мл в контроле; р>0,05) в пределах контрольных значений (рис. 5), что сопровождалось позитивными клиниколабораторными параллелями в виде уменьшения вирусной нагрузки: снижения частоты ОРВИ, репликации герпесвирусов.
Следует отметить, что дифференцированные подходы к выбору тактики интерферонои иммунотерапии иммунокомпрометированных детей с повторными ОРВИ демонстрируют различные позитивные модулирующие клинико-иммунологические эффекты во всех группах исследования, направленные на восстановление полноценности реагирования преимущественно врожденного иммунитета и не оказывающие негативного воздействия на имеющийся адекватный ответ адаптивного противовирусного и антибактериального иммунитета. При использовании пролонгированной в адекватных дозах моноинтерферонотерапии и комбинированной интерферонои иммуномодулирующей терапии побочных эффектов, в т.ч. характерных для парентеральных интерферонов, не зарегистрировано ни во время проведения лечения, ни через год наблюдения в катамнезе (табл. 2).
Заключение
Программы комбинированной интерферонои иммунотерапии, разработанные для лечения и реабилитации иммунокомпрометированных детей с повторными ОРВИ (от 8 до 24 и более эпизодов в год), хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа) с сопутствующей хронической ЛОР-патологией или без таковой, показали высокую клиническую эффективность: значительное снижение частоты эпизодов повторных ОРВИ, при этом длительность клинически благополучного периода увеличилась с 6 до 11 месяцев в год. Одновременно значительно сократилось число детей с рецидивами орофациальной формы ВПГ I/II типов инфекции и случаи возникновения обострения ГВИ были единичными. Отмечено также уменьшение репликативной активности герпесвирусов (ВЭБ, ЦМВ, ВГЧ VI). Выявлена и позитивная иммунологическая эффективность: отмечен модулирующий характер влияний предложенных программ лечения на Т-клеточное и гуморальное звенья ИС, ЕКК, НГ, систему ИФН. Адекватные дозы монотерапии рекомбинантным ИФНα2 способствуют значимому повышению уровней ИФНα и ИФНγ у детей с ассоциированными повторными ОРВИ и различными ГВИ (1-я группа). Достигнутый эффект повышения уровней сывороточного ИФНα и ИФНγ необходим для элиминации или прекращения репликации респираторных или герпесвирусов. Такое повышение уровней сывороточного ИФНα и ИФНγ является признаком позитивной активации продукции ИФН и коррелирует с позитивной клинической динамикой. Использование интерферонотерпии в комбинации с глюкозоаминилмурамилдипептидом позволило скорректировать дефектное функционирование системы не только ИФН (восстановление преимущественно уровня ИФНα), но и НГ у детей с ассоциированными повторными респираторными и различными ГВИ (2-я группа). При наличии вирусно-бактериального процесса (3-я группа), ассоциированного с неадекватной работой системы ИФН в сочетании с дефектным функционированием НГ и гуморального звена, включение в программу лечения ИРС-19 на фоне пролонгированной терапии ИФНα2b демонстрирует весомые преимущества, связанные с эффективной коррекцией выявленных нарушений, преимущественно гуморального и лимфоцитарного звеньев. Таким образом, отмечена дифференцированность влияний различных программ интерферонои иммунотерапии на восстановление дефектных звеньев ИС и системы ИФН: при выявлении мононарушений в системе ИФН имеет место восстановление уровней сывороточного ИФНα в 100% случаев на фоне пролонгированной терапии ИФНα2b в адекватных дозах, в случаях выраженных дефектов функционирования НГ и нарушений системы ИФН выявлены преимущества комбинированной терапии ИФНα2b и глюкозоаминилмурамилдипептидом, при преобладании дефектов сывороточных иммуноглобулинов и нарушений системы ИФН продемонстрированы позитивные эффекты влияний ИФНα2b и ИРС-19. При этом следует особо подчеркнуть, что ни у одного иммунокомпрометированного ребенка во всех трех группах исследования проведение интерферонотерапии ИФНα2b не сопровождалось побочными эффектами, характерными для парентеральных интерферонов, – ни во время проведения лечения, ни через год наблюдения в катамнезе.
Литература
1. Захарова И.Н., Торжхоева Л.Б., Заплатников А.Л., Коровина Н.А., Малиновская В.В., Чеботарева Т.А., Глухарева Н.С., Курбано-ва Х.И., Короид Н.В., Выжлова Е.Н. Модифицированная интерферонотерапия острых респираторных инфекций у детей раннего возраста: патогенетическое обоснование и эффективность. Российский вестник перинатологии и педиатрии. 2011;3:49–54.
2. Нестерова И.В., Клещенко Е.И., Ковалева С.В., Алексеева О.Н., Чудилова Г.А., Ломтатидзе Л.В. Проблемы лечения вирусно-бактериальных инфекций у часто и длительно болеющих иммунокомпрометированных детей. Российский аллергологический журнал. 2011;2:86–93.
3. Нестерова И.В., Кокова Л.Н., Ломтатидзе Л.В. Значимость коррекции интерферонового статуса в комплексной терапии хронического упорно-рецидивирующего орофасциального герпеса. Цитокины и воспаление. 2010;9(2):67–72.
4. Нестерова И.В., Ковалева С.В., Клещенко Е.И., Шинкарева О.Н., Малиновская В.В., Выжлова Е.Н. Ретроспективный анализ клинической эффективности коротких курсов интерферонов в лечении ОРВИ у иммунокомпрометированных ЧДБ детей. Педиатрия. 2014;93(2):62–67.
5. Маркова Т.П. Часто болеющие дети: взгляд иммунолога. М., 2014. 192 с.
6. Alsharifi M., Regner M., Blanden R., Lobigs M., Lee E., Koskinen A., Mullbacher A. Exhaustion of type I interferon response following an acute viral infection. J. Immunol. 2006;177:3235–41.
7. Malmgaard L. Induction and regulation of IFNs during viral infections. J. Interferon Cytokine Res. 2004;24(8):439–54.
8. Kitagawa Y., Yamaguchi M., Zhou M., Komatsu T., Nishio M., Sugiyama T., Takeuchi K., Itoh M., Gotoh B. A tryptophan-rich motif in the human parainfluenza virus type 2 V protein is critical for the blockade of toll-like receptor 7 (TLR7) – and TLR9-dependent signaling. J. Virol. 2011;85:4606–11.
9. Ren J., Liu T., Pang L., Li K, Garofalo RP, Casola A, Bao X. A novel mechanism for the inhibition of interferon regulatory factor-3-dependent gene expression by human respiratory syncytial virus NS1 protein. J. Gen Virol. 2011;92(9):2153–59.
10. Haller O., Weber F. The interferon response circuit in antiviral host defense. Verh. K Acad. Geneeskd. Belg. 2009;71(1–2):73–86.
11. Shi L., Ramaswamy M., Manzel L.J., Look D.C. Inhibition of Jak1-dependent signal transduction in airway epithelial cells infected with adenovirus. Am. J. Respir. Cell Mol. Biol. 2007;37:720–28.
12. Randall R.E., Goodbourn S. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures. J. Gen.Virol. 2008;89:1–47.
13. Нестерова И.В., Малиновская А.В., Тарака-нов В.А., Ковалева С.В. Интерфероно- и иммунотерапия в практике лечения часто и длительно болеющих детей и взрослых. Capricorn Publishing Inc., 2004. 160 с.
14. Учайкин В.Ф. Информационное письмо. Усовершенствованный способ лечения острых респираторных вирусных инфекций, в том числе гриппа у детей, имеющих функциональные и морфофункциональные отклонения в состоянии здоровья (относящихся к II–IV группам здоровья). Информационное письмо. М., 2012.
15. Нестерова И.В., Ковалева С.В. Клещенко Е.И, Чудилова Г.А., Ломтатидзе Л.В., Шинкарева О.Н., Парфенов В.В., Кольцов В.Д. Оптимизация тактики интерфероно- и иммунотерапии в реабилитации иммунокомпрометированных детей с повторными респираторными и герпетическими вирусными инфекциями. Педиатрия. 2014;93(3):66–72.