что делать если в организме не хватает мелатонин
Нехватка мелатонина
Сон — один из самых важных факторов, когда речь идет об улучшении вашей производительности и концентрации. Мелатонин гормон сна оказывает сильное влияние. При нехватке мелатонина появляются признаки беспокойства, плохая реакция на стресс, бессонница и слишком раннее утреннее пробуждение. Мелатонин гормон, который вырабатывается самостоятельно, но по разным причинам (описаны ниже), его уровень может снижаться. При этом, вы можете его контролировать, и поспособствовать повышению выработки его в организме.
Что такое мелатонин?
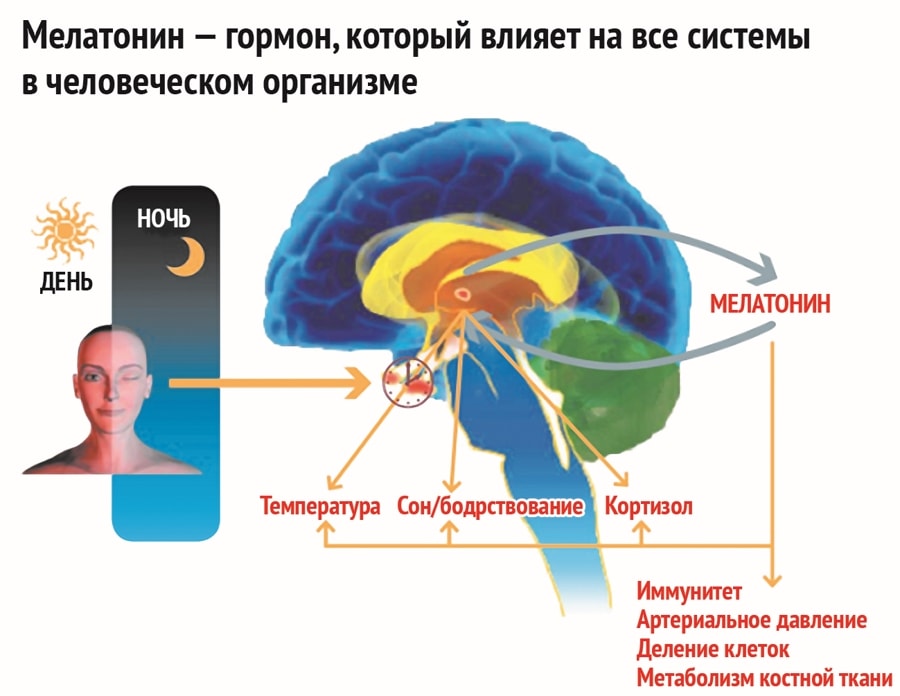
Мелатонин это один из основных гормонов эпифиза. Простыми словами его называют «гормон сна». Нехватка мелатонина в организме приводит к развитию проблем со сном, включая трудности при засыпании.
Выработка мелатонина шишковидной железой происходит в четком суточном (циркадном) ритме, с пиковыми уровнями в ночное время. После образования он выделяется в кровоток и спинномозговую жидкость (жидкость вокруг головного и спинного мозга) и передает сигналы в отдаленные органы. Мелатонин циркулирует от мозга ко всем частям тела. Ткани, экспрессирующие белки, называемые рецепторами, специфичными для мелатонина, способны обнаруживать пик циркулирующего мелатонина в ночное время, и это сигнализирует организму, что это ночь. Уровни мелатонина в ночное время как минимум в 10 раз выше дневных концентраций.
В дополнение к своему циркадному ритму, уровни мелатонина также имеют сезонный (или годичный) ритм, с более высокими уровнями осенью и зимой, когда ночи длиннее, и более низкими уровнями весной и летом. В период полового созревания мелатонин вырабатывается в меньшем количестве.
Было доказано, гормон мелатонин замедляет процесс старения в таких тканях, как мозг. Поскольку это мощный антиоксидант, он помогает защитить все ткани организма.
Другие исследования показали преимущества мелатонина в снижении веса, сердечной функции, профилактике рака груди/рака простаты, митохондриальной функции, улучшении исхода инсульта, симптомах болезни Паркинсона, высоком кровяном давлении, болезни Альцгеймера, фертильности, диабете 2 типа и иммунной функции.
Причины дефицита мелатонина:
Выработка мелатонина – что влияет на процесс?
При недостатке мелатонина необходимо приступить к действиям, которые усилят его выработку и повысят уровень в организме. Примечательно, что для этого не обязательно принимать медицинские препараты. Для нормальной выработки гормона требуется:
Простые советы помогут в вопросе как восполнить недостаток мелатонина и нормализуют другие процессы. Для восстановления организма достаточно следовать установленным правилам. Главная задача человека – это стимуляция естественной выработки собственного гормона. Только в таком ключе можно добиться эффективного сна.
Где содержится мелатонин
Гормон мелатонин нигде не содержится, а вот вещества, отвечающие за его выработку, находятся в обычных продуктах питания. Употребление определенного списка продукции способствует естественной стимуляции производства и ликвидации дефицита.
Для восстановления организма и устранения нехватки мелатонина необходимо употреблять следующие продукты:
Список обширный. Не обязательно есть все указанные продукты, достаточно выбрать часть из них. Регулярное употребление способствует естественной стимуляции выработки гормона, что позволяет восполнить дефицит без лекарственных препаратов.
Медицинские препараты
При появлении симптомов дефицита мелатонина можно использовать медицинские препараты. Но применять их можно только по показаниям, после диагностики и оценки общего состояния пациента. Современные лекарственные средства оказывают седативное и снотворное действие. Главная их задача – не восстановление уровня мелатонина, а улучшение процесса засыпания и нормализация ночного сна.
Злоупотреблять лекарственными препаратами не рекомендуется. Восстановить уровень мелатонина можно естественным путем.
Когда нужно обратиться в МЦ Алтимед?
Обращаться за помощью в медицинский центр Алтимед необходимо при появлении явных признаков нехватки мелатонина:
Диагностика и лечение недостатка мелатонина в МЦ Алтимед
Мелатонин для сна очень важен. Чтобы проверить его уровень в организме, необходимо пройти обследование, но для этого не обязательно сдавать кровь и проходить другие этапы, которые вызывают дискомфорт и болезненные ощущения.
Наш медицинский центр предлагает новые виды диагностики, которые проводятся неинвазивно, но точность – 100%.
Функциональный скрининг показывает в целом состояние организма. Фиксирует волновые процессы в организме.
ATM Vega Test – это возможность узнать причину заболевания, определить тяжесть и какие органы повреждены. Но главное, что основываясь на полученных результатах, специалист сможет назначить вам наиболее эффективное лечение. Уже после первой процедуры вы почувствуете улучшение.
Как проходит лечение нехватки мелатонина в МЦ Алтимед?
Если у вас нехватка мелатонина, рекомендуется обратиться к специалистам и пройти курс терапии. Это очень важно, для нормализации сна, повышения производительности и улучшения самочувствия.
Мы используем инновационное оборудование собственного производства, которое доказало свою эффективность в борьбе с бессонницей, за счет повышения уровня мелатонина.
Аппарат для электромагнитной (PEMF) терапии в домашних условиях ATM
Helper ML – это ваша возможность вернуть себе спокойствие и сон. Он мягко воздействует на организм частотно-волновой терапией.
Использовать его легко, достаточно включить нужный режим и подождать 20-30 минут (в зависимости от назначенного вам курса).
Транскраниальная магнитная стимуляция помогает вовремя отходить ко сну, быстро засыпать и не пробуждаться среди ночи. При болезни, нарушении выработки гормонов, в организме пропадает нужная синхронизация работы всех органов, а частотно-волновая терапия позволяет её наладить.
Медицинский центр Алтимед использует аппарат АТМ ТР собственного производства, для ТМС – транскраниально магнитной стимуляции.
Вам обязательно расскажут, как его использовать, и уже после первого сеанса вы ощутите его положительное воздействие.
Почему стоит выбрать МЦ Алтимед для лечения нехватки мелатонина?
Записывайтесь на консультацию по номеру 0-800-600-0-80 (бесплатно).
Университет
В гормоне сна находят все более интересные свойства
— Мелатонин по праву можно называть гормоном современности, — считает профессор кафедры эндокринологии БГМУ, доктор медицинских наук Алла Шепелькевич.
— Ведь раньше человек жил в большей взаимосвязи с природой, подчиняясь ее ритмам: ложился спать, когда стемнеет, вставал с первым солнцем. Сегодня эти механизмы стали нарушаться, в том числе из–за перелетов, стрессов, работы в ночное время суток. А ведь уже давно доказано, что такой образ жизни очень сказывается на здоровье человека, способствуя развитию сердечных патологий, онкозаболеваний, сахарного диабета.
Ведь неспроста же говорят, что сон — лучшее лекарство. Выспавшийся и отдохнувший человек всегда чувствует себя здоровее. Пока мы спим, мелатонин, подобно ремонтной бригаде, по кирпичику укрепляет наш организм, лечит все поломки и восстанавливает силы. В этот момент активируются антиоксидантные и иммуномоделирующие свойства гормона сна. Он препятствует выработке активных радикалов, а значит, защищает нас от старения, рака и сердечных заболеваний. К слову, уровень мелатонина оказывает влияние и на снижение гормонов стресса.
Многие свойства мелатонина пока еще пристально изучаются наукой. К примеру, не до конца понятны его противоопухолевые механизмы. Но уже точно известно, что такими свойствами гормон сна безусловно обладает. Ученые заметили: у женщин, работающих в ночные смены, риск онкопатологий возрастает на 40 — 60%. Весьма показательны эксперименты на животных. Скажем, когда мышам искусственно увеличили длину светлого времени суток, их продолжительность жизни сократилась в среднем на 20%. Также замечено, что мелатонин сказывается не только на суточных ритмах, но и на реакции организма на смену времен года. Стоит увеличиться солнечному свету и долготе дня, как снижается и уровень мелатонина. Тогда многие млекопитающие, ведущие дневной образ жизни, приступают к поиску партнеров. Подобную закономерность ученые выявили и у людей: половое влечение в короткие дни года значительно ниже, чем в длинные. Необходим мелатонин и для нормального протекания беременности. Именно благодаря его помощи регулируется обновление клеток плаценты.
Секреты хорошего сна
Организму будет привычнее засыпать и просыпаться в одно и то же время — соблюдайте режим дня.
То, как прошел ваш день, обязательно скажется на сне. Хорошо влияют на него прогулки на свежем воздухе, расслабляющие ванны, чай с ромашкой.
Спать надо при выключенном свете, с задернутыми шторами. Не засыпайте под телевизор и не злоупотребляйте кофе — так вы не сможете быстро успокоиться и уснуть.
Старайтесь лечь спать не позже полуночи. Ведь именно на это время приходится пик выработки мелатонина. Если вы все же засиделись допоздна, то комнату лучше освещать не очень яркой настольной лампой.
Кстати
Во многих продуктах также содержится мелатонин. Есть он в незначительных дозах в бананах, какао, мясе индейки, бобовых и соевых. Однако если даже усиленно налегать на них, восполнить серьезную нехватку мелатонина вряд ли удастся: основные его запасы производятся самим организмом ночью во время сна.
Ольга Савицкая
Советская Белоруссия, 19 января 2017
Самый «главный витамин»
На дворе конец такого долгожданного и, к сожалению, как обычно, короткого лета. Кто-то съездил на море, кто-то покорил очередную вершину, а кто-то просидел весь отпуск в душном офисе и не получил достаточного количества «солнечного» витамина, в котором так нуждается наш организм.
Витамин D неспроста называют витамином «солнца». В отличие от других питательных веществ, он практически не содержится в пище и вырабатывается только тогда, когда наша кожа подвергается воздействию ультрафиолетовых лучей. Но, учитывая наше непродолжительное лето, говорить о необходимой дозе витамина не приходится. Почему же именно этот витамин так нужен нашему организму, и что делать, если погреться на солнышке удается не всегда? Разобраться в проблеме нам поможет эндокринолог РКБ им. Семашко Эржена Бальжинимаева.
Самый «главный витамин»
Сегодня же ученые витамин D называют самым «главным витамином». Он регулирует практически все обменные процессы в нашем организме. В первую очередь, витамин D важен для маленьких детей, беременных женщин и пожилых людей. А ещё для людей со смуглой кожей, ведь они риску дефицита подвержены более остальных.
Так, к симптомам нехватки этого витамина относят: быструю утомляемость глаз, снижение остроты зрения, трещинки на эмали зубов, проблемы с менструальным циклом, мышечную слабость, хронические боли, хроническую усталость и частые простудные заболевания. Кроме этого, недостаток витамина D может привести к остеопорозу и тяжелым переломам (например, шейки бедра), сахарному диабету 1 типа у детей, ожирению, рахиту и задержке развития у малышей. Остановимся на некоторых из них.
Топ-5 самых распространенных симптомов дефицита витамина D
— Частые простуды. Витамин D крайне важен для нормальной работы нашей иммунной системы. Без достаточного количества витамина иммунные клетки не смогут вовремя реагировать на угрозу, делая организм более восприимчивым к разным инфекциям.
— Отсутствие настроения. Витамин D играет одну из главных ролей в поддержании здорового уровня серотонина в мозге. Речь идет о нейротрансмиттерах, которые нужны нам для отличного настроения и избежания сезонных депрессий.
— Хроническая усталость. Также витамин D нужен нашему организму для преобразования пищи в энергию. Если вы постоянно чувствуете усталость, это может означать, что организм не усваивает питательные вещества из пищи, что, в свою очередь, может быть спровоцировано как раз дефицитом витамина D.
— Слабые кости. Помимо всего вышеперечисленного, витамин D необходим для регуляции кальция и фосфатов в организме. Эти минералы имеют важное значение для здоровья костей и зубов.
— Боли в мышцах. Витамин D поддерживает и функцию мышц. Дело в том, что, попадая в клетки мышечной ткани, он усиливает частоту мышечных сокращений, помогая мышцам оставаться сильными и эластичными. Это защищает их от разрывов и мелких повреждений, в том числе во время тренировок.
Сегодня существуют три способа «доставки» витамина в организм. Самое простое – «снабдить» тело витамином с помощью солнечных лучей.
Специалисты рекомендуют бывать на солнце не менее трех раз в неделю – от 10 до 15 минут в открытой одежде и без солнцезащитного крема. При этом летом надо выбирать для «профилактического загара» утренние и вечерние часы, когда ультрафиолетовое излучение еще не очень активно и не наносит повреждений коже. Витамин можно получить и в солярии. В случае если вы решили им воспользоваться, уточните срок действия лампы для загара, советуют медики. Важно понимать, что «впрок» регулярным загаром на летнем солнце и в солярии витамин D запасти нельзя.
Также получить витамин D можно из сливочного масла, молочных продуктов и яичного желтка. Небольшое количество витамина есть и в продуктах растительного происхождения, например, петрушке и крапиве, а также в грибах.
Но все далеко не так просто, прием препаратов должен проводиться по рекомендации врача и в строго определенные периоды. Стоит помнить, что витамин D способен накапливаться в организме. И если принимать препараты бесконтрольно, есть риск довести уровень витамина до состояния гипервитаминоза, что также плохо.
Узнать свой уровень витамина D можно, сдав анализ крови из вены. Что касается государственных медицинских учреждений республики, то такой анализ делают в РКБ им. Семашко.
Что делать если в организме не хватает мелатонин
Треть жизни человек проводит во сне и это полезно!
Возможно не всем известно, что делает для нашего организма сон, но, каждый знает, что слишком долгое его отсутствие ухудшает самочувствие, настроение, а хороший ночной сон заряжает бодростью и желанием двигаться навстречу новому дню.
Медленная фаза продолжается около 75% от всего времени сна и состоит из трех стадий — N1, N2 и N3.
Стадия N2 (сон средней глубины или поверхностный сон) характеризуется более глубоким сном. Частота сердечных сокращений и частота дыхания продолжают замедляться, мышцы становятся более расслабленными, движение глаз прекращается, температура тела снижается. Эта стадия обычно самая продолжительная из всех стадий сна.
Стадия N3-4 (стадия глубокого и наиболее глубокого сна) играет важную роль в том, чтобы после сна человек почувствовал себя бодрым. Сердцебиение, дыхание и активность мозговых волн достигают самого низкого уровня, мышцы расслабляются максимально. Разбудить человека в этот момент трудно. При пробуждении он некоторое время дезориентирован. Сначала этот этап более продолжителен, но в течение ночи его продолжительность уменьшается.
Фаза быстрого сна REM наступает примерно через 90 минут после засыпания. Как следует из названия, глаза двигаются довольно быстро. Частота дыхания, частота сердечных сокращений и артериальное давление увеличиваются.
Во время быстрого сна мы видим сны.
Продолжительность каждого цикла быстрого сна увеличивается с течением ночи. Многочисленные исследования также связывают быстрый сон с консолидацией памяти (процесс преобразования кратковременных воспоминаний в долговременные). Продолжительность стадии быстрого сна уменьшается с возрастом, в результате чего больше времени занимают стадии быстрого сна. Проснувшись в этот момент человек помнит и может детально рассказать сновидение.
Эти этапы повторяются циклически в течение ночи до момента пробуждения.
Адаптироваться к смене дня и ночи помогают циркадные ритмы
Как они работают?
Свет проникает в глаза (даже через закрытые веки во время сна), стимулируя сигнал передаваемый сетчаткой в головной мозг.
Сон необходим
Недостаток сна сказывается не только на настроении.
Человек с дефицитом сна более подвержен следующим заболеваниям:
Про мелатонин
Исследования показывают, что мелатонин имеет отношение не только ко сну.
Гормон сна снижает выработку цитокинов, вызывающих воспаление, является антиоксидантом, нейтрализующим клетки свободных радикалов и ограничивающим окислительный стресс и повреждения, которые способствуют воспалению. Как антиоксидант, мелатонин также может помочь при расстройствах мозга, таких как болезнь Паркинсона, сердечных заболеваниях, таких как аритмия.
Секреция мелатонина подавляется светом.
В этом смысле хороши шторы блэкаут, чтобы не отвлекали фонари, машины за окном, убрать телефон,отключить сигналы уведомлений, выключить телевизор, ночник, свет в коридоре, любую подсветку.
С возрастом выработка мелатонина снижается.
Мелатонин доступен в виде добавок, обычно в виде таблеток или капсул. Большинство добавок мелатонина производятся в лаборатории.
Мелатонин может немного сократить время, необходимое для засыпания, улучшить симптомы смены часовых поясов, но может вызвать дневную сонливость.
Люди обычно используют мелатонин при расстройствах сна, таких как бессонница и при нарушении сна во время смены часовых поясов.
Самостоятельно принимать мелатонин не стоит, необходимо обратиться к врачу чтобы обсудить возможные противопоказания, исключить аллергическую реакцию и уточнить взаимодействие с другими лекарствами. Кратковременное использование добавок мелатонина вероятно безопасно для большинства людей, но информации о долгосрочной безопасности добавок мелатонина нет.
Кому сколько спать?
По обновленным данным Национального фонда сна (США), молодые люди (возраст 18-25 лет) и взрослые (возраст 26-64 лет) должны спать от 7 до 9 часов, но не менее 6 часов и не более 10 часов (для взрослых) или 11 часов (для молодых людей). Пожилые люди (65 лет и старше) должны спать от 7 до 8 часов, но не менее 5 или более 9 часов.
Детям и подросткам требуется значительно больше сна:
Что еще нужно для полноценного сна
Что делать если в организме не хватает мелатонин
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Мелатонин (N-ацетил-5-метокситриптамин) – вещество, открытое американским дерматологом А. Лернером. В организме позвоночных животных небольшие количества мелатонина выделяются сетчаткой глаз и значительные – некоторыми клетками слизистой кишечника, но главным источником системного мелатонина является эпифиз. Мелатонин синтезируется из незаменимой аминокислоты триптофана. Ритм его секреции эпифизом носит четко выраженный циркадианный характер. Уровень указанного гормона в крови начинает повышаться в вечернее время, совпадая с уменьшением уровня освещенности, достигает максимума в середине ночи (в 2–3 часа), затем прогрессивно уменьшается к утру. В дневное время секреция мелатонина остается на очень низком уровне. Циркадианный ритм выработки мелатонина эпифизом задается супрахиазматическим ядром таламуса (СХЯ) в зависимости от уровня освещенности 2.
Мелатонин выполняет функцию химического переносчика информации из циркадианного водителя ритма. Центральные мелатониновые рецепторы МТ1 и МТ2 сосредоточены преимущественно в СХЯ, в котором мелатонин действует по принципу обратной негативной связи. Кроме того, наличие МТ1 и МТ2 рецепторов в сосудах, адипоцитах, печени, поджелудочной железе определяет функции мелатонина в регуляции цикла сон-бодрствование и синхронизации наступления сна с изменением метаболических процессов и функционирования внутренних органов. Нарушение циркадианного ритма синтеза мелатонина приводит к развитию десинхроноза, который проявляется в рассогласовании суточных ритмов в работе различных функциональных систем и развитию целого ряда заболеваний.
В среднем, в организме взрослого человека синтезируется за день около 30 мг мелатонина. В крови человека более 80% циркулирующего мелатонина имеет эпифизарное происхождение. Период полужизни мелатонина в организме человека составляет, по разным данным, от 30 до 50 минут. Инактивация мелатонина происходит главным образом в печени, где под воздействием системы микросомальных окислительных ферментов он превращается в 6-оксимелатонин. Большая часть окисленного мелатонина выводится с мочой и калом в виде сульфатного конъюгата 6-сульфатоксимелатонина (6-оксиМТ).
В настоящее время в клинической лабораторной диагностике существуют методы с аналитическими характеристиками, позволяющими определять как содержания мелатонина в плазме и слюне, так и его производного 6-оксиМТ в моче. Вследствие выраженных почасовых колебаний уровня мелатонина в крови и быстром распаде мелатонина (период полувыведения не более 50 минут), объективная оценка содержания мелатонина возможна только при постановке катетера и многократном в течение суток заборе крови, что не может быть рекомендовано для широкого применения в клинической практике. В связи с этим наиболее широко в настоящее время применяется оценка содержания основного метаболита мелатонина 6-сульфатоксимелатонина в моче. Учитывая выраженную зависимость синтеза мелатонина от времени суток, принято оценивать концентрацию или экскрецию 6-оксиМТ отдельно в ночной и дневной порциях мочи.
Стандартизация преаналитического этапа определения метаболитов мелатонина в моче должна стать обязательной процедурой при использовании этого теста в диагностических целях. Данные об экскреции 6-СОМТ могут стать основанием для определения дополнительных показаний к назначению мелатонина при лечении инсомнии и других заболеваний. В оценке метаболизма мелатонина в клинической практике кроме уровня ночной экскреции его метаболитов важным может оказаться уровень дневной, ночной и вечерней экскреции и соотношение этих параметров.
Сложность в интерпретации полученных данных по экскреции мелатонина у пациентов связана с большим разбросом индивидуальных значений. Выраженные индивидуальные колебания уровня мелатонина среди здоровых испытуемых связывают с вариабельностью размеров шишковидной железы. Данные аутопсии выявили значительную вариабельность размеров шишковидной железы, достигающую 20-кратных различий между индивидуумами [3]. Такие же, значительные колебания в уровне секреции мелатонина отмечались многими исследователями у здоровых испытуемых 5. Исследование соотношения размеров шишковидной железы у 122 мужчин в возрасте 75 ± 2,2 лет с помощь МРТ и количеством 6-оксиМТ в утренней порции мочи выявило сильную корреляцию объема паренхимы с уровнем 6-оксиМТ, при значительной вариабельности как объема паренхимы (от 65 до 503 мм 3 ), так и концентрации мелатонина в утренней порции мочи (21 ± 16 нг/мл) [6]. Зависимости между секрецией мелатонина и наличием кист или кальцификатов в шишковидной железе выявлено не было. Единственным значимым для синтеза мелатонина явился объем паренхимы, состоящий из активных пинеалоцитов. В другом исследовании была выявлена значимая связь между объемом паренхимы и количеством 6-оксиМТ в суточной моче [7]. Важным выводом этих исследований явилось доказательство связи уровня секреции мелатонина с объемом паренхимы, а не объемом всей шишковидной железы, которая может включать как кисты, так и кальцификаты. Эта зависимость осталась значимой после исключения влияния возраста, наличия инсомнии, индекса массы тела.
Факторы, определяющие снижение синтеза мелатонина эпифизом
Возраст. Синтез мелатонина шишковидной железой быстро нарастает после рождения ребенка, достигая максимума к 2-4 годам. Резкое снижение синтеза мелатонина происходит в пубертатном периоде и затем отмечается медленное прогрессивное снижение синтеза мелатонина в течение жизни (рис. 1). Прогрессивное снижение синтеза мелатонина при нормальном старении связывают с уменьшением объема функционально активной шишковидной железы в связи с ее кальцифицированием, дегенерацией супрахиазматического ядра, гормональными перестройками в организме. Отмечается преимущественное снижение синтеза ночного мелатонина с достаточно большими индивидуальными колебаниями.
Рис. 1. Снижение синтеза мелатонина с возрастом
( Цит по Journal of anti-aging medicine; Pierpaoli W; 2(4):343-348 (1999)
Вредные привычки. Снижение уровня мелатонина выявлено у активных курильщиков [8]. Употребление алкоголя также снижает синтез мелатонина и вызывает нарушения сна [9].
Лекарственные средства. Многие лекарственные средства, широко используемые в современной медицине, значительно снижают синтез эндогенного мелатонина. В этот перечень входят бета-блокаторы [10, 11], бензодиазепины [12], нестероидные противовоспалительные средства [13,14]. Наиболее значимым для секреции мелатонина является прием бета-блокаторов, которые вызывают снижение секреции мелатонина до 50%. Именно снижение синтеза мелатонина является одной из важнейших причин развития инсомнии при приеме этих лекарственных средств.
Освещенность. Другим важным фактором, определяющим снижение синтеза мелатонина эпифизом является освещенность. При сохранении даже незначительного внешнего освещения в вечернее и ночное время (включенный компьютер, огни наружной рекламы, ночник) секреция мелатонина эпифизом будет нарушена. Оценка концентрации мелатонина в крови во время сна у здоровых волонтеров показала снижение синтеза мелатонина более чем на 50% при сне с сохраненным светом, по сравнению со сном в темноте. Выявлена также значимая разница в синтезе мелатонина в зависимости от интенсивности освещенности комнаты перед сном [15].
Характерная для современной жизни искусственная иллюминация в ночное время тормозит синтез эндогенного мелатонина. По данным многочисленных исследований прогрессивное увеличение освещенности в ночное время наносит серьезную угрозу здоровью жителям Земли. Нарушение циркадианной динамики синтеза мелатонина, связанное с освещенностью и работой в ночное время проявляется десинхронозами, которые повышают риск развития различных соматических, нейродегенеративных заболеваний и рака [1, 16].
Расстройства цикла «сон-бодрствование». Расстройства цикла «сон-бодрствование» включают синдром задержки фазы сна, синдром опережающей фазы сна, расстройство цикла «сон-бодрствование» при сменной работе и при смене часовых поясов (jet lag). Мелатонин играет ведущую роль в лечение этих расстройств сна.
Синдром задержки фазы сна – при этом расстройстве привычное время сна задерживается по отношению к желаемому и принятому в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на невозможность заснуть и трудности при пробуждении в желаемое или назначенное время суток. Позднее засыпание сопровождается мучительным утренним пробуждением и сонливостью в первую половину дня. Распространенность данного состояния максимальна среди подростков и составляет 7-16 %. Показана роль генетических факторов в развитии этого синдрома. Характерным является сдвиг синтеза эндогенного мелатонина на более позднее, чем в норме время. Лечение этого синдрома включает прием мелатонина за час до желаемого сна и использование фототерапии при пробуждении.
Синдром опережающей фазы сна – при этом нарушении привычное время сна наступает раньше, чем желаемое или принятое в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на сильную тягу ко сну в вечернее время и раннее окончательное пробуждение. Распространенность этого синдрома не превышает 1 % среди лиц среднего возраста. В лечении синдрома опережающей фазы сна используется хронотерапевтический подход.
Расстройство цикла «сон-бодрствование» при сменной работе – состояние, характеризующееся симптомами инсомнии и дневной сонливости, возникающее в связи со сменным графиком труда. Проявления расстройства зависят от графика труда. Необходимо соблюдать рекомендации по гигиене сна и организовывать максимально возможную продолжительность сна в условиях сменной работы. Медикаментозная терапия включает использование мелатонина при необходимости спать в дневное время, фототерапию и психостимуляторы для уменьшения сонливости при необходимости работать в ночное время.
Расстройство цикла «сон-бодрствование» при смене часовых поясов (jet lag) – это состояние, проявляющееся инсомнией, избыточной дневной сонливостью и нарушением дневного функционирования которые возникли при быстром перемещении через 2 и более часовых поясов. Причиной развития расстройства является возникшее несоответствие деятельности внутреннего пейсмейкера с локальным временем. Выраженность возникающего после перелета дискомфорта зависит от направления перелета, возраста, хронотипа. При перелете в восточном направлении возникают трудности засыпания, при перелете в западном направлении возникает необходимость ложиться спать позже, что переносится легче. Обычно симптомы держатся не более 2-3 дней, пока происходит адаптация к новому часовому поясу. При недостаточной адаптации к новым условиям рекомендуется использование Z-гипнотиков. Другим средством, облегчающим фазовый сдвиг, является мелатонин.
Заболевания, при которых доказана эффективность лечения мелатонином
Нейродегенерация и мелатонин. Многочисленные нейродегенеративные заболевания, среди которых наибольшее внимание приковано к болезни Паркинсона (БП) и болезни Альцгеймера (БА), сопровождаются различными нарушениями сна. Более того, дефицит сна имеет существенное значение для прогрессирования деменции, так как дренажная функция и удаление продуктов обмена из головного мозга, в том числе амилоида, происходит преимущественно во сне [24]. Прогрессирование нейродегенеративных заболеваний связано также с окислительным стрессом и дисфункцией митохондрий. Наличие у мелатонина выраженных антиоксидантных свойств, а также способности избирательно накапливаться в мембранах митохондрий, нормализуя их работу, рассматривается как ведущий механизм нейропротективного действия мелатонина при болезни Альцгеймера [25]. Исследования по изучению секреции мелатонина при БА малочисленны и свидетельствуют об отсутствии корреляции между БА, нарушением сна и уровнем секреции 6-оксиМТ [26]. В тоже время показано, что длительный (1-4 месяца) прием мелатонина в дозах от 3 до 9 мг способствует нормализации сна и имеет потенциальное положительное влияние на когнитивные функции при болезни Альцгеймера [27, 28].
Отдельного упоминания заслуживает нарушение сна в виде нарушения поведения в фазу быстрого сна. Расстройство поведения в фазу быстрого сна (РПБС) проявляется различной двигательной и речевой активностью. Двигательная активность варьирует от отдельных вздрагиваний до сложных агрессивных форм поведения с толканием, хватанием предметов, что может приводить к травматизации, как самого пациента, так и партнера по постели. Двигательная активность часто сопровождается речевой продукцией. В отличие от снохождения пациенты не покидают кровать, глаза их закрыты. Эпизоды возникают преимущественно во второй половине ночи, во время быстрого сна и характер двигательной и речевой продукции отражает характер сновидений.
Распространенность РПБС в популяции составляет 1-2 %, возникает преимущественно в возрасте старше 50 лет. Выделяют идиопатическое РПБС, и вторичное, развивающиеся у пациентов с синуклеинопатиями (болезнь Паркинсона, деменция с тельцами Леви, мультисистемная атрофия), аутоиммунными заболеваниями (нарколепсия, лимбический энцефалит), с очаговыми поражениями ствола мозга (инсульт, рассеянный склероз), при абстиненции и отмене ряда психотропных средств (антихолинергических и серотонинергических). Так как почти у всех пациентов с идиопатическим РПБС в дальнейшем развивается нейродегенеративное заболевание, эта категория РПБС тоже может быть отнесена к вторичным.
Препаратом выбора является клоназепам в дозе 0,5 – 2,0 мг за 30 минут до сна (уровень А). Клоназепам значительно снижает двигательную активность и травматизм, связанный с РПБС. Ограничениями для использования являются наличие деменции, нарушений походки и синдрома обструктивного апноэ сна, так как клоназепам будет усиливать эти проявления.
Мелатонин в дозе 3-12 мг может быть использован для лечения РПБС (уровень В). Его эффективность в контроле как первичного, так и ассоциированного с синуклеинопатиями РПБС меньше, чем у клоназепама, но больше, чем у других используемых средств. Мелатонин может быть препаратом выбора при лечении РПБС у пациентов с когнитивными расстройствами, нарушениями походки и синдромом обструктивного апноэ сна [29]. Мелатонин может назначаться как изолированно, так и в сочетании с клоназепамом.
Инсомния и мелатонин. Инсомния — повторные нарушения инициации, продолжительности, консолидации или качества сна, случающиеся, несмотря на наличие достаточного количества времени и условий для сна, и проявляющиеся нарушением дневной деятельности разного вида. Нарушения сна наряду с головными болями и дорсалгиями являются наиболее частыми жалобами при обращении к неврологу. По данным эпидемиологии, инсомния встречается у 28–45 % популяции и в половине случаев является важной проблемой требующей лечения. При этом 1,5–3 % популяции постоянно и 25–29 % эпизодически принимают снотворные препараты.
Наступление сна и его отдельных стадий связано с деятельностью сложной сети нервных структур, которая функционирует с помощью различных нейромедиаторных систем, среди которых важную роль отводят мелатонину. Эти представления позволяют предположить возможный дефицит эндогенного мелатонина у пациентов с инсомнией и обосновывают назначение экзогенного мелатонина.
В настоящее время имеется большое количество исследований свидетельствующих об эффективности использования мелатонина с целью улучшения качества и эффективности сна. Эффективность препаратов мелатонина при инсомнии подтверждена как в зарубежных, так и в отечественных исследованиях 31. Показано, что длительное применение не сопровождается снижением эффективности или развитием серьезных нежелательных явлений [34]. Проведение мета-анализа клинических испытаний применения экзогенного мелатонина [35] доказало его эффективность в лечении инсомнии. Были получены данные о значимом снижении времени наступления сна у пациентов с первичными расстройствами сна, получавшими экзогенный мелатонин по сравнению с группой плацебо.
Анисимов В.Н. Мелатонин: роль в организме, применение в клинике / Спб.: Изд-во «Система». 2007. 40 с.
Ковальзон В.М. Основы сомнологии: Физиология и нейрохимия цикла «бодрствование — сон» / М.: БИНОМ., Лаборатория знаний. 2012. 239 с.
Hasegawa A., Ohtsubo K., Mori W. Pineal gland in old age; quantitative and qualitative morphological study of 168 human autopsy cases // Brain Res. 1987. Vol.409. №2. P. 343–349.
Arendt J. Melatonin and human rhythms // Chronobiol Int. 2006. Vol.23. № 1–2. P. 21–37.
Bergiannaki J.D., Soldatos C.R., Paparrigopoulos T.J. et al. Low and high melatonin excretors among healthy individuals // J Pineal Res. 1995. Vol.18. № 3. P. 159–164.
Kunz D., Schmitz S., Mahlberg R. et al. A new concept for melatonin deficit: on pineal calcification and melatonin excretion // Neuropsychopharmacology. 1999. Vol. 21. № 6. P. 765–772.
Ozguner F., Koyu A., Cesur G. Active smoking causes oxidative stress and decreases blood melatonin levels // Toxicol Ind Health. 2005. Vol. 21. № 1-2. P. 21–26.
Kuhlwein E., Hauger R.L., Irwin M.R. Abnormal nocturnal melatonin secretion and disordered sleep in abstinent alcoholics // Biol Psychiatry. 2003. Vol.54. № 12. P. 1437–1443.
Cowen P.J., Bevan J.S., Gosden B., Elliott S.A. Treatment with beta-adrenoceptor blockers reduces plasma melatonin concentration // Br J Clin Pharmacol. 1985; Vol. 19. № 2. P. 258–260.
Rommel T., Demisch L. Influence of chronic beta-adrenoreceptor blocker treatment on melatonin secretion and sleep quality in patients with essential hypertension // J Neural Transm Gen Sect. 1994. Vol. 95. № 1. P. 39–48.
McIntyre I.M., Burrows G.D., Norman T.R. Suppression of plasma melatonin by a single dose of the benzodiazepine alprazolam in humans // Biol Psychiatry. 1988 Vol. 24. № 1. P. 108–112.
Murphy P.J., Badia P., Myers B.L. et al. Nonsteroidal anti-inflammatory drugs affect normal sleep patterns in humans // Physiol Behav. 1994. Vol. 55. № 6. P. 1063–1066.
Surrall K, Smith J.A., Bird H., Okala B. et al. Effect of ibuprofen and indomethacin on human plasma melatonin // J Pharm Pharmacol. 1987. Vol. 39. № 10. P. 840–843.
Gooley J.J., Chamberlain K., Smith K.A. et al. Exposure to room light before bedtime suppresses melatonin onset and shortens melatonin duration in humans // J Clin Endocrinol Metab. 2011. Vol.96. № 3. P. 463–472.
Reiter R.J., Tan D.X., Korkmaz A. et al. Light at night, chronodisruption, melatonin suppression, and cancer risk: a review // Crit Rev Oncog. 2007. Vol. 13 P. 303-328.
Możdżan M., Możdżan M., Chałubiński M. The effect of melatonin on circadian blood pressure in patients with type 2 diabetes and essential hypertension // Arch Med Sci. 2014. Vol. 29. № 4. P. 669-675.
Калинченко С.Ю., Тюзиков И.А. Дефицит мелатонина, ожирение и инсулинорезистентность: очевидные и неочевидные взаимосвязи // Вопросы диетологии. 2017. Т. 7. № 2. С. 23–32.
Anisimov V.N., Popovich I.G., Zabezhinski M.A.et al. Melatonin as antioxidant, geroprotector and anticarcinogen // Biochim Biophys Acta. 2006; Vol. 1757. № 5-6. P. 73-89.
Mazzoccoli G., Carughi S., De Cata A. et al. Melatonin and cortisol serum levels in lung cancer patients at different stages of disease // Med Sci Monit. 2005. №11. P. 284-288.
Lissoni P., Paolorossi F., Ardizzoia A. et al. A randomized study of chemotherapy with cisplatin plus etoposide versus chemoendocrine therapy with cisplatin, etoposide and the pineal hormone melatonin as a first-line treatment of advanced non-small cell lung cancer patients in a poor clinical state // J Pineal Res. 1997. Vol. 23. P. 15-19.
Lissoni P. Biochemotherapy with standard chemotherapies plus the pineal hormone melatonin in the treatment of advanced solid neoplasms // Pathol Biol (Paris). 2007. Vol. 55. P. 201-204.
Leon J., Acuna-Castroviejo D., Escames G. Et al. Melatonin mitigates mitochondrial malfunction // J. Pineal Res. 2005. Vol. 38. P. 1–9.
Luboshitzky R., Shen-Orr Z., Tzischichinsky O. Et al. Actigraphic sleep-wake patterns and urinary 6-sulfatoxymelatonin excretion in patients with Alzheimer’s disease // Chronobiol Int. 2001 Vol. 18. №3. P. 513-524.
Cardinali D.P., Vigo D. E., Olivar N. et al. Melatonin Therapy in Patients with Alzheimer’s Disease // Antioxidants (Basel) 2014. Vol. 3. № 2. P. 245–277.
Hughes R.J., Sack R.L., Lewy A.J. The role of melatonin and circadian phase in age-related sleep-maintenance insomnia: assessment in clinical trial of melatonin replacement // Sleep. 1998. Vol. 21. P. 52– 68.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin exretion in insomnia and its relation to the response to melatonin replacement therapy // Am j med. 2004. Vol. 116 № 2. P. 91– 95.
Ellis C. M., Lemmens G., Parkes D. Melatonin and insomnia // J. Sleep Res. 1996. Vol. 5. P. 61–65.
Полуэктов М.Г., Левин Я.И., Бойко А.Н. с соавт. Результаты российского мультицентрового исследования эффективности и безопасности мелаксена (мелатонин) для лечения нарушений сна у пациентов с хронической церебральной сосудистой недостаточностью // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112. № 9. С. 26–31.
Andersen L.P., Gögenur I., Rosenberg J., Reiter R.J. The Safety of melatonin in humans // Clin. Drug Investig. 2016. Vol. 36. № 3. Р. 169–175.
Ferracioli-Oda E., Qawasmi A., Bloch M.H. Meta-analysis: melatonin for the treatment of primary sleep disorders // PLoS One. 2013. Vol. 8. № 5. ID e63773.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin excretion in insomnia and its relation to the response to melatonin replacement therapy // Am. J. Med. 2004. Vol.116. P. 91 – 95.
Attenburrow, M.E.J. Dowling B.A., Sharpley P.J. et al. Case-study of evening melatonin concentration in primary insomnia // Brit med j. 1996. Vol. 312. P. 1263 – 1264.
Тихомирова О.В., Бутырина Е.В., Зыбина Н.Н.. Фролова М.Ю. Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии / Медицинский алфавит. Современная лаборатория. 2013. №3. С. 46 – 52.
Lushington, K., Lack L., Kennaway D.J. et al. 6-Sulfatoxymelatonin excretion and self-reported sleep in good sleeping controls and 55-80-year-old insomniacs // J sleep res. 1998. Vol. 7. P. 75 – 83.
Lushington, K. Dawson D., Kennaway D.J. et al. The relationship between 6-sulphatoxymelatonin and polysomnographic sleep in good sleeping controls and wake maintence insomniacs, aged 55-80 years // J sleep res. 1999. Vol. 8. P. 57 – 64.
Hajak, G., Rodenbeck A., Staedt J. et al. Nocturnal plasma melatonin excretion in patients suffering from chronic primary insomnia // J. pineal res. 1995. Vol. 19. P. 116 – 122.
Тихомирова Ольга Викторовна
Заведующий отделом клинической неврологии и медицины сна
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Гормон шишковидной железы мелатонин является предметом интенсивных исследований в связи с его многофункциональностью и широким терапевтическим потенциалом. В обзоре представлены данные о зависимости синтеза эндогенного мелатонина от времени суток, возраста, размеров шишковидной железы, освещенности, приема бета-блокаторов и ряда других медикаментов. Обсуждаются результаты исследований по нарушению секреции и эффективности использования экзогенного мелатонина при расстройствах цикла сон-бодрствование, инсомнии, нейродегенерации, сахарном диабете, онкологических заболеваниях.
Мелатонин, экскреция 6-сульфатоксимелатонина, терапия, нарушения сна
Melatonin Parasecretion and Replacement Therapy Efficacy at Sleep Disturbances
N.N. ZYBINA, О.V. TIKHOMIROVA
Nikiforov Russian Center of Emergency and Radiation Medicine, EMERCOM of Russia, Saint-Petersburg
Melatonin, pineal gland hormone, is a subject of active studies due to its multifunctional performance and wide therapeutic potential. The review presents data on dependence of endogenous melatonin synthesis on the time of day, age, pineal gland size, lighting conditions, administration of beta-blockers and a number of other medications. The article discusses the results of studies on parasecretion and efficacy of exogenous melatonin use at sleep-wake cycle disturbances, insomnia, neurodegeneration, diabetes mellitus and oncological diseases.
Key words: Melatonin, 6-Sulfatoxymelatonin excretion, therapy, sleep disorders.
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Мелатонин (N-ацетил-5-метокситриптамин) – вещество, открытое американским дерматологом А. Лернером. В организме позвоночных животных небольшие количества мелатонина выделяются сетчаткой глаз и значительные – некоторыми клетками слизистой кишечника, но главным источником системного мелатонина является эпифиз. Мелатонин синтезируется из незаменимой аминокислоты триптофана. Ритм его секреции эпифизом носит четко выраженный циркадианный характер. Уровень указанного гормона в крови начинает повышаться в вечернее время, совпадая с уменьшением уровня освещенности, достигает максимума в середине ночи (в 2–3 часа), затем прогрессивно уменьшается к утру. В дневное время секреция мелатонина остается на очень низком уровне. Циркадианный ритм выработки мелатонина эпифизом задается супрахиазматическим ядром таламуса (СХЯ) в зависимости от уровня освещенности 1.
Мелатонин выполняет функцию химического переносчика информации из циркадианного водителя ритма. Центральные мелатониновые рецепторы МТ1 и МТ2 сосредоточены преимущественно в СХЯ, в котором мелатонин действует по принципу обратной негативной связи. Кроме того, наличие МТ1 и МТ2 рецепторов в сосудах, адипоцитах, печени, поджелудочной железе определяет функции мелатонина в регуляции цикла сон-бодрствование и синхронизации наступления сна с изменением метаболических процессов и функционирования внутренних органов. Нарушение циркадианного ритма синтеза мелатонина приводит к развитию десинхроноза, который проявляется в рассогласовании суточных ритмов в работе различных функциональных систем и развитию целого ряда заболеваний.
В среднем, в организме взрослого человека синтезируется за день около 30 мг мелатонина. В крови человека более 80% циркулирующего мелатонина имеет эпифизарное происхождение. Период полужизни мелатонина в организме человека составляет, по разным данным, от 30 до 50 минут. Инактивация мелатонина происходит главным образом в печени, где под воздействием системы микросомальных окислительных ферментов он превращается в 6-оксимелатонин. Большая часть окисленного мелатонина выводится с мочой и калом в виде сульфатного конъюгата 6-сульфатоксимелатонина (6-оксиМТ).
В настоящее время в клинической лабораторной диагностике существуют методы с аналитическими характеристиками, позволяющими определять как содержания мелатонина в плазме и слюне, так и его производного 6-оксиМТ в моче. Вследствие выраженных почасовых колебаний уровня мелатонина в крови и быстром распаде мелатонина (период полувыведения не более 50 минут), объективная оценка содержания мелатонина возможна только при постановке катетера и многократном в течение суток заборе крови, что не может быть рекомендовано для широкого применения в клинической практике. В связи с этим наиболее широко в настоящее время применяется оценка содержания основного метаболита мелатонина 6-сульфатоксимелатонина в моче. Учитывая выраженную зависимость синтеза мелатонина от времени суток, принято оценивать концентрацию или экскрецию 6-оксиМТ отдельно в ночной и дневной порциях мочи.
Стандартизация преаналитического этапа определения метаболитов мелатонина в моче должна стать обязательной процедурой при использовании этого теста в диагностических целях. Данные об экскреции 6-СОМТ могут стать основанием для определения дополнительных показаний к назначению мелатонина при лечении инсомнии и других заболеваний. В оценке метаболизма мелатонина в клинической практике кроме уровня ночной экскреции его метаболитов важным может оказаться уровень дневной, ночной и вечерней экскреции и соотношение этих параметров.
Сложность в интерпретации полученных данных по экскреции мелатонина у пациентов связана с большим разбросом индивидуальных значений. Выраженные индивидуальные колебания уровня мелатонина среди здоровых испытуемых связывают с вариабельностью размеров шишковидной железы. Данные аутопсии выявили значительную вариабельность размеров шишковидной железы, достигающую 20-кратных различий между индивидуумами [3]. Такие же, значительные колебания в уровне секреции мелатонина отмечались многими исследователями у здоровых испытуемых 4. Исследование соотношения размеров шишковидной железы у 122 мужчин в возрасте 75 ± 2,2 лет с помощь МРТ и количеством 6-оксиМТ в утренней порции мочи выявило сильную корреляцию объема паренхимы с уровнем 6-оксиМТ, при значительной вариабельности как объема паренхимы (от 65 до 503 мм 3 ), так и концентрации мелатонина в утренней порции мочи (21 ± 16 нг/мл) [6]. Зависимости между секрецией мелатонина и наличием кист или кальцификатов в шишковидной железе выявлено не было. Единственным значимым для синтеза мелатонина явился объем паренхимы, состоящий из активных пинеалоцитов. В другом исследовании была выявлена значимая связь между объемом паренхимы и количеством 6-оксиМТ в суточной моче [7]. Важным выводом этих исследований явилось доказательство связи уровня секреции мелатонина с объемом паренхимы, а не объемом всей шишковидной железы, которая может включать как кисты, так и кальцификаты. Эта зависимость осталась значимой после исключения влияния возраста, наличия инсомнии, индекса массы тела.
Факторы, определяющие снижение синтеза мелатонина эпифизом
Возраст. Синтез мелатонина шишковидной железой быстро нарастает после рождения ребенка, достигая максимума к 2-4 годам. Резкое снижение синтеза мелатонина происходит в пубертатном периоде и затем отмечается медленное прогрессивное снижение синтеза мелатонина в течение жизни (рис. 1). Прогрессивное снижение синтеза мелатонина при нормальном старении связывают с уменьшением объема функционально активной шишковидной железы в связи с ее кальцифицированием, дегенерацией супрахиазматического ядра, гормональными перестройками в организме. Отмечается преимущественное снижение синтеза ночного мелатонина с достаточно большими индивидуальными колебаниями.
Рис. 1. Снижение синтеза мелатонина с возрастом
( Цит по Journal of anti-aging medicine; Pierpaoli W; 2(4):343-348 (1999)
Вредные привычки. Снижение уровня мелатонина выявлено у активных курильщиков [8]. Употребление алкоголя также снижает синтез мелатонина и вызывает нарушения сна [9].
Лекарственные средства. Многие лекарственные средства, широко используемые в современной медицине, значительно снижают синтез эндогенного мелатонина. В этот перечень входят бета-блокаторы [10, 11], бензодиазепины [12], нестероидные противовоспалительные средства [13,14]. Наиболее значимым для секреции мелатонина является прием бета-блокаторов, которые вызывают снижение секреции мелатонина до 50%. Именно снижение синтеза мелатонина является одной из важнейших причин развития инсомнии при приеме этих лекарственных средств.
Освещенность. Другим важным фактором, определяющим снижение синтеза мелатонина эпифизом является освещенность. При сохранении даже незначительного внешнего освещения в вечернее и ночное время (включенный компьютер, огни наружной рекламы, ночник) секреция мелатонина эпифизом будет нарушена. Оценка концентрации мелатонина в крови во время сна у здоровых волонтеров показала снижение синтеза мелатонина более чем на 50% при сне с сохраненным светом, по сравнению со сном в темноте. Выявлена также значимая разница в синтезе мелатонина в зависимости от интенсивности освещенности комнаты перед сном [15].
Характерная для современной жизни искусственная иллюминация в ночное время тормозит синтез эндогенного мелатонина. По данным многочисленных исследований прогрессивное увеличение освещенности в ночное время наносит серьезную угрозу здоровью жителям Земли. Нарушение циркадианной динамики синтеза мелатонина, связанное с освещенностью и работой в ночное время проявляется десинхронозами, которые повышают риск развития различных соматических, нейродегенеративных заболеваний и рака [1, 16].
Расстройства цикла «сон-бодрствование». Расстройства цикла «сон-бодрствование» включают синдром задержки фазы сна, синдром опережающей фазы сна, расстройство цикла «сон-бодрствование» при сменной работе и при смене часовых поясов (jet lag). Мелатонин играет ведущую роль в лечение этих расстройств сна.
Синдром задержки фазы сна – при этом расстройстве привычное время сна задерживается по отношению к желаемому и принятому в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на невозможность заснуть и трудности при пробуждении в желаемое или назначенное время суток. Позднее засыпание сопровождается мучительным утренним пробуждением и сонливостью в первую половину дня. Распространенность данного состояния максимальна среди подростков и составляет 7-16 %. Показана роль генетических факторов в развитии этого синдрома. Характерным является сдвиг синтеза эндогенного мелатонина на более позднее, чем в норме время. Лечение этого синдрома включает прием мелатонина за час до желаемого сна и использование фототерапии при пробуждении.
Синдром опережающей фазы сна – при этом нарушении привычное время сна наступает раньше, чем желаемое или принятое в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на сильную тягу ко сну в вечернее время и раннее окончательное пробуждение. Распространенность этого синдрома не превышает 1 % среди лиц среднего возраста. В лечении синдрома опережающей фазы сна используется хронотерапевтический подход.
Расстройство цикла «сон-бодрствование» при сменной работе – состояние, характеризующееся симптомами инсомнии и дневной сонливости, возникающее в связи со сменным графиком труда. Проявления расстройства зависят от графика труда. Необходимо соблюдать рекомендации по гигиене сна и организовывать максимально возможную продолжительность сна в условиях сменной работы. Медикаментозная терапия включает использование мелатонина при необходимости спать в дневное время, фототерапию и психостимуляторы для уменьшения сонливости при необходимости работать в ночное время.
Расстройство цикла «сон-бодрствование» при смене часовых поясов (jet lag) – это состояние, проявляющееся инсомнией, избыточной дневной сонливостью и нарушением дневного функционирования которые возникли при быстром перемещении через 2 и более часовых поясов. Причиной развития расстройства является возникшее несоответствие деятельности внутреннего пейсмейкера с локальным временем. Выраженность возникающего после перелета дискомфорта зависит от направления перелета, возраста, хронотипа. При перелете в восточном направлении возникают трудности засыпания, при перелете в западном направлении возникает необходимость ложиться спать позже, что переносится легче. Обычно симптомы держатся не более 2-3 дней, пока происходит адаптация к новому часовому поясу. При недостаточной адаптации к новым условиям рекомендуется использование Z-гипнотиков. Другим средством, облегчающим фазовый сдвиг, является мелатонин.
Заболевания, при которых доказана эффективность лечения мелатонином
Нейродегенерация и мелатонин. Многочисленные нейродегенеративные заболевания, среди которых наибольшее внимание приковано к болезни Паркинсона (БП) и болезни Альцгеймера (БА), сопровождаются различными нарушениями сна. Более того, дефицит сна имеет существенное значение для прогрессирования деменции, так как дренажная функция и удаление продуктов обмена из головного мозга, в том числе амилоида, происходит преимущественно во сне [24]. Прогрессирование нейродегенеративных заболеваний связано также с окислительным стрессом и дисфункцией митохондрий. Наличие у мелатонина выраженных антиоксидантных свойств, а также способности избирательно накапливаться в мембранах митохондрий, нормализуя их работу, рассматривается как ведущий механизм нейропротективного действия мелатонина при болезни Альцгеймера [25]. Исследования по изучению секреции мелатонина при БА малочисленны и свидетельствуют об отсутствии корреляции между БА, нарушением сна и уровнем секреции 6-оксиМТ [26]. В тоже время показано, что длительный (1-4 месяца) прием мелатонина в дозах от 3 до 9 мг способствует нормализации сна и имеет потенциальное положительное влияние на когнитивные функции при болезни Альцгеймера [27, 28].
Отдельного упоминания заслуживает нарушение сна в виде нарушения поведения в фазу быстрого сна. Расстройство поведения в фазу быстрого сна (РПБС) проявляется различной двигательной и речевой активностью. Двигательная активность варьирует от отдельных вздрагиваний до сложных агрессивных форм поведения с толканием, хватанием предметов, что может приводить к травматизации, как самого пациента, так и партнера по постели. Двигательная активность часто сопровождается речевой продукцией. В отличие от снохождения пациенты не покидают кровать, глаза их закрыты. Эпизоды возникают преимущественно во второй половине ночи, во время быстрого сна и характер двигательной и речевой продукции отражает характер сновидений.
Распространенность РПБС в популяции составляет 1-2 %, возникает преимущественно в возрасте старше 50 лет. Выделяют идиопатическое РПБС, и вторичное, развивающиеся у пациентов с синуклеинопатиями (болезнь Паркинсона, деменция с тельцами Леви, мультисистемная атрофия), аутоиммунными заболеваниями (нарколепсия, лимбический энцефалит), с очаговыми поражениями ствола мозга (инсульт, рассеянный склероз), при абстиненции и отмене ряда психотропных средств (антихолинергических и серотонинергических). Так как почти у всех пациентов с идиопатическим РПБС в дальнейшем развивается нейродегенеративное заболевание, эта категория РПБС тоже может быть отнесена к вторичным.
Препаратом выбора является клоназепам в дозе 0,5 – 2,0 мг за 30 минут до сна (уровень А). Клоназепам значительно снижает двигательную активность и травматизм, связанный с РПБС. Ограничениями для использования являются наличие деменции, нарушений походки и синдрома обструктивного апноэ сна, так как клоназепам будет усиливать эти проявления.
Мелатонин в дозе 3-12 мг может быть использован для лечения РПБС (уровень В). Его эффективность в контроле как первичного, так и ассоциированного с синуклеинопатиями РПБС меньше, чем у клоназепама, но больше, чем у других используемых средств. Мелатонин может быть препаратом выбора при лечении РПБС у пациентов с когнитивными расстройствами, нарушениями походки и синдромом обструктивного апноэ сна [29]. Мелатонин может назначаться как изолированно, так и в сочетании с клоназепамом.
Инсомния и мелатонин. Инсомния — повторные нарушения инициации, продолжительности, консолидации или качества сна, случающиеся, несмотря на наличие достаточного количества времени и условий для сна, и проявляющиеся нарушением дневной деятельности разного вида. Нарушения сна наряду с головными болями и дорсалгиями являются наиболее частыми жалобами при обращении к неврологу. По данным эпидемиологии, инсомния встречается у 28–45 % популяции и в половине случаев является важной проблемой требующей лечения. При этом 1,5–3 % популяции постоянно и 25–29 % эпизодически принимают снотворные препараты.
Наступление сна и его отдельных стадий связано с деятельностью сложной сети нервных структур, которая функционирует с помощью различных нейромедиаторных систем, среди которых важную роль отводят мелатонину. Эти представления позволяют предположить возможный дефицит эндогенного мелатонина у пациентов с инсомнией и обосновывают назначение экзогенного мелатонина.
В настоящее время имеется большое количество исследований свидетельствующих об эффективности использования мелатонина с целью улучшения качества и эффективности сна. Эффективность препаратов мелатонина при инсомнии подтверждена как в зарубежных, так и в отечественных исследованиях 32. Показано, что длительное применение не сопровождается снижением эффективности или развитием серьезных нежелательных явлений [34]. Проведение мета-анализа клинических испытаний применения экзогенного мелатонина [35] доказало его эффективность в лечении инсомнии. Были получены данные о значимом снижении времени наступления сна у пациентов с первичными расстройствами сна, получавшими экзогенный мелатонин по сравнению с группой плацебо.
Анисимов В.Н. Мелатонин: роль в организме, применение в клинике / Спб.: Изд-во «Система». 2007. 40 с.
Ковальзон В.М. Основы сомнологии: Физиология и нейрохимия цикла «бодрствование — сон» / М.: БИНОМ., Лаборатория знаний. 2012. 239 с.
Hasegawa A., Ohtsubo K., Mori W. Pineal gland in old age; quantitative and qualitative morphological study of 168 human autopsy cases // Brain Res. 1987. Vol.409. №2. P. 343–349.
Arendt J. Melatonin and human rhythms // Chronobiol Int. 2006. Vol.23. № 1–2. P. 21–37.
Bergiannaki J.D., Soldatos C.R., Paparrigopoulos T.J. et al. Low and high melatonin excretors among healthy individuals // J Pineal Res. 1995. Vol.18. № 3. P. 159–164.
Kunz D., Schmitz S., Mahlberg R. et al. A new concept for melatonin deficit: on pineal calcification and melatonin excretion // Neuropsychopharmacology. 1999. Vol. 21. № 6. P. 765–772.
Ozguner F., Koyu A., Cesur G. Active smoking causes oxidative stress and decreases blood melatonin levels // Toxicol Ind Health. 2005. Vol. 21. № 1-2. P. 21–26.
Kuhlwein E., Hauger R.L., Irwin M.R. Abnormal nocturnal melatonin secretion and disordered sleep in abstinent alcoholics // Biol Psychiatry. 2003. Vol.54. № 12. P. 1437–1443.
Cowen P.J., Bevan J.S., Gosden B., Elliott S.A. Treatment with beta-adrenoceptor blockers reduces plasma melatonin concentration // Br J Clin Pharmacol. 1985; Vol. 19. № 2. P. 258–260.
Rommel T., Demisch L. Influence of chronic beta-adrenoreceptor blocker treatment on melatonin secretion and sleep quality in patients with essential hypertension // J Neural Transm Gen Sect. 1994. Vol. 95. № 1. P. 39–48.
McIntyre I.M., Burrows G.D., Norman T.R. Suppression of plasma melatonin by a single dose of the benzodiazepine alprazolam in humans // Biol Psychiatry. 1988 Vol. 24. № 1. P. 108–112.
Murphy P.J., Badia P., Myers B.L. et al. Nonsteroidal anti-inflammatory drugs affect normal sleep patterns in humans // Physiol Behav. 1994. Vol. 55. № 6. P. 1063–1066.
Surrall K, Smith J.A., Bird H., Okala B. et al. Effect of ibuprofen and indomethacin on human plasma melatonin // J Pharm Pharmacol. 1987. Vol. 39. № 10. P. 840–843.
Gooley J.J., Chamberlain K., Smith K.A. et al. Exposure to room light before bedtime suppresses melatonin onset and shortens melatonin duration in humans // J Clin Endocrinol Metab. 2011. Vol.96. № 3. P. 463–472.
Reiter R.J., Tan D.X., Korkmaz A. et al. Light at night, chronodisruption, melatonin suppression, and cancer risk: a review // Crit Rev Oncog. 2007. Vol. 13 P. 303-328.
Możdżan M., Możdżan M., Chałubiński M. The effect of melatonin on circadian blood pressure in patients with type 2 diabetes and essential hypertension // Arch Med Sci. 2014. Vol. 29. № 4. P. 669-675.
Калинченко С.Ю., Тюзиков И.А. Дефицит мелатонина, ожирение и инсулинорезистентность: очевидные и неочевидные взаимосвязи // Вопросы диетологии. 2017. Т. 7. № 2. С. 23–32.
Anisimov V.N., Popovich I.G., Zabezhinski M.A.et al. Melatonin as antioxidant, geroprotector and anticarcinogen // Biochim Biophys Acta. 2006; Vol. 1757. № 5-6. P. 73-89.
Mazzoccoli G., Carughi S., De Cata A. et al. Melatonin and cortisol serum levels in lung cancer patients at different stages of disease // Med Sci Monit. 2005. №11. P. 284-288.
Lissoni P., Paolorossi F., Ardizzoia A. et al. A randomized study of chemotherapy with cisplatin plus etoposide versus chemoendocrine therapy with cisplatin, etoposide and the pineal hormone melatonin as a first-line treatment of advanced non-small cell lung cancer patients in a poor clinical state // J Pineal Res. 1997. Vol. 23. P. 15-19.
Lissoni P. Biochemotherapy with standard chemotherapies plus the pineal hormone melatonin in the treatment of advanced solid neoplasms // Pathol Biol (Paris). 2007. Vol. 55. P. 201-204.
Leon J., Acuna-Castroviejo D., Escames G. Et al. Melatonin mitigates mitochondrial malfunction // J. Pineal Res. 2005. Vol. 38. P. 1–9.
Luboshitzky R., Shen-Orr Z., Tzischichinsky O. Et al. Actigraphic sleep-wake patterns and urinary 6-sulfatoxymelatonin excretion in patients with Alzheimer’s disease // Chronobiol Int. 2001 Vol. 18. №3. P. 513-524.
Cardinali D.P., Vigo D. E., Olivar N. et al. Melatonin Therapy in Patients with Alzheimer’s Disease // Antioxidants (Basel) 2014. Vol. 3. № 2. P. 245–277.
Hughes R.J., Sack R.L., Lewy A.J. The role of melatonin and circadian phase in age-related sleep-maintenance insomnia: assessment in clinical trial of melatonin replacement // Sleep. 1998. Vol. 21. P. 52– 68.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin exretion in insomnia and its relation to the response to melatonin replacement therapy // Am j med. 2004. Vol. 116 № 2. P. 91– 95.
Ellis C. M., Lemmens G., Parkes D. Melatonin and insomnia // J. Sleep Res. 1996. Vol. 5. P. 61–65.
Полуэктов М.Г., Левин Я.И., Бойко А.Н. с соавт. Результаты российского мультицентрового исследования эффективности и безопасности мелаксена (мелатонин) для лечения нарушений сна у пациентов с хронической церебральной сосудистой недостаточностью // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112. № 9. С. 26–31.
Andersen L.P., Gögenur I., Rosenberg J., Reiter R.J. The Safety of melatonin in humans // Clin. Drug Investig. 2016. Vol. 36. № 3. Р. 169–175.
Ferracioli-Oda E., Qawasmi A., Bloch M.H. Meta-analysis: melatonin for the treatment of primary sleep disorders // PLoS One. 2013. Vol. 8. № 5. ID e63773.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin excretion in insomnia and its relation to the response to melatonin replacement therapy // Am. J. Med. 2004. Vol.116. P. 91 – 95.
Attenburrow, M.E.J. Dowling B.A., Sharpley P.J. et al. Case-study of evening melatonin concentration in primary insomnia // Brit med j. 1996. Vol. 312. P. 1263 – 1264.
Тихомирова О.В., Бутырина Е.В., Зыбина Н.Н.. Фролова М.Ю. Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии / Медицинский алфавит. Современная лаборатория. 2013. №3. С. 46 – 52.
Lushington, K., Lack L., Kennaway D.J. et al. 6-Sulfatoxymelatonin excretion and self-reported sleep in good sleeping controls and 55-80-year-old insomniacs // J sleep res. 1998. Vol. 7. P. 75 – 83.
Lushington, K. Dawson D., Kennaway D.J. et al. The relationship between 6-sulphatoxymelatonin and polysomnographic sleep in good sleeping controls and wake maintence insomniacs, aged 55-80 years // J sleep res. 1999. Vol. 8. P. 57 – 64.
Hajak, G., Rodenbeck A., Staedt J. et al. Nocturnal plasma melatonin excretion in patients suffering from chronic primary insomnia // J. pineal res. 1995. Vol. 19. P. 116 – 122.
Тихомирова Ольга Викторовна
Заведующий отделом клинической неврологии и медицины сна
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Гормон шишковидной железы мелатонин является предметом интенсивных исследований в связи с его многофункциональностью и широким терапевтическим потенциалом. В обзоре представлены данные о зависимости синтеза эндогенного мелатонина от времени суток, возраста, размеров шишковидной железы, освещенности, приема бета-блокаторов и ряда других медикаментов. Обсуждаются результаты исследований по нарушению секреции и эффективности использования экзогенного мелатонина при расстройствах цикла сон-бодрствование, инсомнии, нейродегенерации, сахарном диабете, онкологических заболеваниях.
Мелатонин, экскреция 6-сульфатоксимелатонина, терапия, нарушения сна
Melatonin Parasecretion and Replacement Therapy Efficacy at Sleep Disturbances
N.N. ZYBINA, О.V. TIKHOMIROVA
Nikiforov Russian Center of Emergency and Radiation Medicine, EMERCOM of Russia, Saint-Petersburg
Melatonin, pineal gland hormone, is a subject of active studies due to its multifunctional performance and wide therapeutic potential. The review presents data on dependence of endogenous melatonin synthesis on the time of day, age, pineal gland size, lighting conditions, administration of beta-blockers and a number of other medications. The article discusses the results of studies on parasecretion and efficacy of exogenous melatonin use at sleep-wake cycle disturbances, insomnia, neurodegeneration, diabetes mellitus and oncological diseases.
Key words: Melatonin, 6-Sulfatoxymelatonin excretion, therapy, sleep disorders.
мм 3 ), так и концентрации мелатонина в утренней порции мочи (21 ± 16 нг/мл) [6]. Зависимости между секрецией мелатонина и наличием кист или кальцификатов в шишковидной железе выявлено не было. Единственным значимым для синтеза мелатонина явился объем паренхимы, состоящий из активных пинеалоцитов. В другом исследовании была выявлена значимая связь между объемом паренхимы и количеством 6-оксиМТ в суточной моче [7]. Важным выводом этих исследований явилось доказательство связи уровня секреции мелатонина с объемом паренхимы, а не объемом всей шишковидной железы, которая может включать как кисты, так и кальцификаты. Эта зависимость осталась значимой после исключения влияния возраста, наличия инсомнии, индекса массы тела.
Факторы, определяющие снижение синтеза мелатонина эпифизом
Возраст. Синтез мелатонина шишковидной железой быстро нарастает после рождения ребенка, достигая максимума к 2-4 годам. Резкое снижение синтеза мелатонина происходит в пубертатном периоде и затем отмечается медленное прогрессивное снижение синтеза мелатонина в течение жизни (рис. 1). Прогрессивное снижение синтеза мелатонина при нормальном старении связывают с уменьшением объема функционально активной шишковидной железы в связи с ее кальцифицированием, дегенерацией супрахиазматического ядра, гормональными перестройками в организме. Отмечается преимущественное снижение синтеза ночного мелатонина с достаточно большими индивидуальными колебаниями.
Рис. 1. Снижение синтеза мелатонина с возрастом
( Цит по Journal of anti-aging medicine; Pierpaoli W; 2(4):343-348 (1999)
Вредные привычки. Снижение уровня мелатонина выявлено у активных курильщиков [8]. Употребление алкоголя также снижает синтез мелатонина и вызывает нарушения сна [9].
Лекарственные средства. Многие лекарственные средства, широко используемые в современной медицине, значительно снижают синтез эндогенного мелатонина. В этот перечень входят бета-блокаторы [10, 11], бензодиазепины [12], нестероидные противовоспалительные средства [13,14]. Наиболее значимым для секреции мелатонина является прием бета-блокаторов, которые вызывают снижение секреции мелатонина до 50%. Именно снижение синтеза мелатонина является одной из важнейших причин развития инсомнии при приеме этих лекарственных средств.
Освещенность. Другим важным фактором, определяющим снижение синтеза мелатонина эпифизом является освещенность. При сохранении даже незначительного внешнего освещения в вечернее и ночное время (включенный компьютер, огни наружной рекламы, ночник) секреция мелатонина эпифизом будет нарушена. Оценка концентрации мелатонина в крови во время сна у здоровых волонтеров показала снижение синтеза мелатонина более чем на 50% при сне с сохраненным светом, по сравнению со сном в темноте. Выявлена также значимая разница в синтезе мелатонина в зависимости от интенсивности освещенности комнаты перед сном [15].
Характерная для современной жизни искусственная иллюминация в ночное время тормозит синтез эндогенного мелатонина. По данным многочисленных исследований прогрессивное увеличение освещенности в ночное время наносит серьезную угрозу здоровью жителям Земли. Нарушение циркадианной динамики синтеза мелатонина, связанное с освещенностью и работой в ночное время проявляется десинхронозами, которые повышают риск развития различных соматических, нейродегенеративных заболеваний и рака [1, 16].
Расстройства цикла «сон-бодрствование». Расстройства цикла «сон-бодрствование» включают синдром задержки фазы сна, синдром опережающей фазы сна, расстройство цикла «сон-бодрствование» при сменной работе и при смене часовых поясов (jet lag). Мелатонин играет ведущую роль в лечение этих расстройств сна.
Синдром задержки фазы сна – при этом расстройстве привычное время сна задерживается по отношению к желаемому и принятому в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на невозможность заснуть и трудности при пробуждении в желаемое или назначенное время суток. Позднее засыпание сопровождается мучительным утренним пробуждением и сонливостью в первую половину дня. Распространенность данного состояния максимальна среди подростков и составляет 7-16 %. Показана роль генетических факторов в развитии этого синдрома. Характерным является сдвиг синтеза эндогенного мелатонина на более позднее, чем в норме время. Лечение этого синдрома включает прием мелатонина за час до желаемого сна и использование фототерапии при пробуждении.
Синдром опережающей фазы сна – при этом нарушении привычное время сна наступает раньше, чем желаемое или принятое в социальной среде не менее чем на 2 часа, что определяется по жалобам пациента на сильную тягу ко сну в вечернее время и раннее окончательное пробуждение. Распространенность этого синдрома не превышает 1 % среди лиц среднего возраста. В лечении синдрома опережающей фазы сна используется хронотерапевтический подход.
Расстройство цикла «сон-бодрствование» при сменной работе – состояние, характеризующееся симптомами инсомнии и дневной сонливости, возникающее в связи со сменным графиком труда. Проявления расстройства зависят от графика труда. Необходимо соблюдать рекомендации по гигиене сна и организовывать максимально возможную продолжительность сна в условиях сменной работы. Медикаментозная терапия включает использование мелатонина при необходимости спать в дневное время, фототерапию и психостимуляторы для уменьшения сонливости при необходимости работать в ночное время.
Расстройство цикла «сон-бодрствование» при смене часовых поясов (jet lag) – это состояние, проявляющееся инсомнией, избыточной дневной сонливостью и нарушением дневного функционирования которые возникли при быстром перемещении через 2 и более часовых поясов. Причиной развития расстройства является возникшее несоответствие деятельности внутреннего пейсмейкера с локальным временем. Выраженность возникающего после перелета дискомфорта зависит от направления перелета, возраста, хронотипа. При перелете в восточном направлении возникают трудности засыпания, при перелете в западном направлении возникает необходимость ложиться спать позже, что переносится легче. Обычно симптомы держатся не более 2-3 дней, пока происходит адаптация к новому часовому поясу. При недостаточной адаптации к новым условиям рекомендуется использование Z-гипнотиков. Другим средством, облегчающим фазовый сдвиг, является мелатонин.
Заболевания, при которых доказана эффективность лечения мелатонином
Нейродегенерация и мелатонин. Многочисленные нейродегенеративные заболевания, среди которых наибольшее внимание приковано к болезни Паркинсона (БП) и болезни Альцгеймера (БА), сопровождаются различными нарушениями сна. Более того, дефицит сна имеет существенное значение для прогрессирования деменции, так как дренажная функция и удаление продуктов обмена из головного мозга, в том числе амилоида, происходит преимущественно во сне [24]. Прогрессирование нейродегенеративных заболеваний связано также с окислительным стрессом и дисфункцией митохондрий. Наличие у мелатонина выраженных антиоксидантных свойств, а также способности избирательно накапливаться в мембранах митохондрий, нормализуя их работу, рассматривается как ведущий механизм нейропротективного действия мелатонина при болезни Альцгеймера [25]. Исследования по изучению секреции мелатонина при БА малочисленны и свидетельствуют об отсутствии корреляции между БА, нарушением сна и уровнем секреции 6-оксиМТ [26]. В тоже время показано, что длительный (1-4 месяца) прием мелатонина в дозах от 3 до 9 мг способствует нормализации сна и имеет потенциальное положительное влияние на когнитивные функции при болезни Альцгеймера [27, 28].
Отдельного упоминания заслуживает нарушение сна в виде нарушения поведения в фазу быстрого сна. Расстройство поведения в фазу быстрого сна (РПБС) проявляется различной двигательной и речевой активностью. Двигательная активность варьирует от отдельных вздрагиваний до сложных агрессивных форм поведения с толканием, хватанием предметов, что может приводить к травматизации, как самого пациента, так и партнера по постели. Двигательная активность часто сопровождается речевой продукцией. В отличие от снохождения пациенты не покидают кровать, глаза их закрыты. Эпизоды возникают преимущественно во второй половине ночи, во время быстрого сна и характер двигательной и речевой продукции отражает характер сновидений.
Распространенность РПБС в популяции составляет 1-2 %, возникает преимущественно в возрасте старше 50 лет. Выделяют идиопатическое РПБС, и вторичное, развивающиеся у пациентов с синуклеинопатиями (болезнь Паркинсона, деменция с тельцами Леви, мультисистемная атрофия), аутоиммунными заболеваниями (нарколепсия, лимбический энцефалит), с очаговыми поражениями ствола мозга (инсульт, рассеянный склероз), при абстиненции и отмене ряда психотропных средств (антихолинергических и серотонинергических). Так как почти у всех пациентов с идиопатическим РПБС в дальнейшем развивается нейродегенеративное заболевание, эта категория РПБС тоже может быть отнесена к вторичным.
Препаратом выбора является клоназепам в дозе 0,5 – 2,0 мг за 30 минут до сна (уровень А). Клоназепам значительно снижает двигательную активность и травматизм, связанный с РПБС. Ограничениями для использования являются наличие деменции, нарушений походки и синдрома обструктивного апноэ сна, так как клоназепам будет усиливать эти проявления.
Мелатонин в дозе 3-12 мг может быть использован для лечения РПБС (уровень В). Его эффективность в контроле как первичного, так и ассоциированного с синуклеинопатиями РПБС меньше, чем у клоназепама, но больше, чем у других используемых средств. Мелатонин может быть препаратом выбора при лечении РПБС у пациентов с когнитивными расстройствами, нарушениями походки и синдромом обструктивного апноэ сна [29]. Мелатонин может назначаться как изолированно, так и в сочетании с клоназепамом.
Инсомния и мелатонин. Инсомния — повторные нарушения инициации, продолжительности, консолидации или качества сна, случающиеся, несмотря на наличие достаточного количества времени и условий для сна, и проявляющиеся нарушением дневной деятельности разного вида. Нарушения сна наряду с головными болями и дорсалгиями являются наиболее частыми жалобами при обращении к неврологу. По данным эпидемиологии, инсомния встречается у 28–45 % популяции и в половине случаев является важной проблемой требующей лечения. При этом 1,5–3 % популяции постоянно и 25–29 % эпизодически принимают снотворные препараты.
Наступление сна и его отдельных стадий связано с деятельностью сложной сети нервных структур, которая функционирует с помощью различных нейромедиаторных систем, среди которых важную роль отводят мелатонину. Эти представления позволяют предположить возможный дефицит эндогенного мелатонина у пациентов с инсомнией и обосновывают назначение экзогенного мелатонина.
В настоящее время имеется большое количество исследований свидетельствующих об эффективности использования мелатонина с целью улучшения качества и эффективности сна. Эффективность препаратов мелатонина при инсомнии подтверждена как в зарубежных, так и в отечественных исследованиях 32. Показано, что длительное применение не сопровождается снижением эффективности или развитием серьезных нежелательных явлений [34]. Проведение мета-анализа клинических испытаний применения экзогенного мелатонина [35] доказало его эффективность в лечении инсомнии. Были получены данные о значимом снижении времени наступления сна у пациентов с первичными расстройствами сна, получавшими экзогенный мелатонин по сравнению с группой плацебо.
Анисимов В.Н. Мелатонин: роль в организме, применение в клинике / Спб.: Изд-во «Система». 2007. 40 с.
Ковальзон В.М. Основы сомнологии: Физиология и нейрохимия цикла «бодрствование — сон» / М.: БИНОМ., Лаборатория знаний. 2012. 239 с.
Hasegawa A., Ohtsubo K., Mori W. Pineal gland in old age; quantitative and qualitative morphological study of 168 human autopsy cases // Brain Res. 1987. Vol.409. №2. P. 343–349.
Arendt J. Melatonin and human rhythms // Chronobiol Int. 2006. Vol.23. № 1–2. P. 21–37.
Bergiannaki J.D., Soldatos C.R., Paparrigopoulos T.J. et al. Low and high melatonin excretors among healthy individuals // J Pineal Res. 1995. Vol.18. № 3. P. 159–164.
Kunz D., Schmitz S., Mahlberg R. et al. A new concept for melatonin deficit: on pineal calcification and melatonin excretion // Neuropsychopharmacology. 1999. Vol. 21. № 6. P. 765–772.
Ozguner F., Koyu A., Cesur G. Active smoking causes oxidative stress and decreases blood melatonin levels // Toxicol Ind Health. 2005. Vol. 21. № 1-2. P. 21–26.
Kuhlwein E., Hauger R.L., Irwin M.R. Abnormal nocturnal melatonin secretion and disordered sleep in abstinent alcoholics // Biol Psychiatry. 2003. Vol.54. № 12. P. 1437–1443.
Cowen P.J., Bevan J.S., Gosden B., Elliott S.A. Treatment with beta-adrenoceptor blockers reduces plasma melatonin concentration // Br J Clin Pharmacol. 1985; Vol. 19. № 2. P. 258–260.
Rommel T., Demisch L. Influence of chronic beta-adrenoreceptor blocker treatment on melatonin secretion and sleep quality in patients with essential hypertension // J Neural Transm Gen Sect. 1994. Vol. 95. № 1. P. 39–48.
McIntyre I.M., Burrows G.D., Norman T.R. Suppression of plasma melatonin by a single dose of the benzodiazepine alprazolam in humans // Biol Psychiatry. 1988 Vol. 24. № 1. P. 108–112.
Murphy P.J., Badia P., Myers B.L. et al. Nonsteroidal anti-inflammatory drugs affect normal sleep patterns in humans // Physiol Behav. 1994. Vol. 55. № 6. P. 1063–1066.
Surrall K, Smith J.A., Bird H., Okala B. et al. Effect of ibuprofen and indomethacin on human plasma melatonin // J Pharm Pharmacol. 1987. Vol. 39. № 10. P. 840–843.
Gooley J.J., Chamberlain K., Smith K.A. et al. Exposure to room light before bedtime suppresses melatonin onset and shortens melatonin duration in humans // J Clin Endocrinol Metab. 2011. Vol.96. № 3. P. 463–472.
Reiter R.J., Tan D.X., Korkmaz A. et al. Light at night, chronodisruption, melatonin suppression, and cancer risk: a review // Crit Rev Oncog. 2007. Vol. 13 P. 303-328.
Możdżan M., Możdżan M., Chałubiński M. The effect of melatonin on circadian blood pressure in patients with type 2 diabetes and essential hypertension // Arch Med Sci. 2014. Vol. 29. № 4. P. 669-675.
Калинченко С.Ю., Тюзиков И.А. Дефицит мелатонина, ожирение и инсулинорезистентность: очевидные и неочевидные взаимосвязи // Вопросы диетологии. 2017. Т. 7. № 2. С. 23–32.
Anisimov V.N., Popovich I.G., Zabezhinski M.A.et al. Melatonin as antioxidant, geroprotector and anticarcinogen // Biochim Biophys Acta. 2006; Vol. 1757. № 5-6. P. 73-89.
Mazzoccoli G., Carughi S., De Cata A. et al. Melatonin and cortisol serum levels in lung cancer patients at different stages of disease // Med Sci Monit. 2005. №11. P. 284-288.
Lissoni P., Paolorossi F., Ardizzoia A. et al. A randomized study of chemotherapy with cisplatin plus etoposide versus chemoendocrine therapy with cisplatin, etoposide and the pineal hormone melatonin as a first-line treatment of advanced non-small cell lung cancer patients in a poor clinical state // J Pineal Res. 1997. Vol. 23. P. 15-19.
Lissoni P. Biochemotherapy with standard chemotherapies plus the pineal hormone melatonin in the treatment of advanced solid neoplasms // Pathol Biol (Paris). 2007. Vol. 55. P. 201-204.
Leon J., Acuna-Castroviejo D., Escames G. Et al. Melatonin mitigates mitochondrial malfunction // J. Pineal Res. 2005. Vol. 38. P. 1–9.
Luboshitzky R., Shen-Orr Z., Tzischichinsky O. Et al. Actigraphic sleep-wake patterns and urinary 6-sulfatoxymelatonin excretion in patients with Alzheimer’s disease // Chronobiol Int. 2001 Vol. 18. №3. P. 513-524.
Cardinali D.P., Vigo D. E., Olivar N. et al. Melatonin Therapy in Patients with Alzheimer’s Disease // Antioxidants (Basel) 2014. Vol. 3. № 2. P. 245–277.
Hughes R.J., Sack R.L., Lewy A.J. The role of melatonin and circadian phase in age-related sleep-maintenance insomnia: assessment in clinical trial of melatonin replacement // Sleep. 1998. Vol. 21. P. 52– 68.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin exretion in insomnia and its relation to the response to melatonin replacement therapy // Am j med. 2004. Vol. 116 № 2. P. 91– 95.
Ellis C. M., Lemmens G., Parkes D. Melatonin and insomnia // J. Sleep Res. 1996. Vol. 5. P. 61–65.
Полуэктов М.Г., Левин Я.И., Бойко А.Н. с соавт. Результаты российского мультицентрового исследования эффективности и безопасности мелаксена (мелатонин) для лечения нарушений сна у пациентов с хронической церебральной сосудистой недостаточностью // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112. № 9. С. 26–31.
Andersen L.P., Gögenur I., Rosenberg J., Reiter R.J. The Safety of melatonin in humans // Clin. Drug Investig. 2016. Vol. 36. № 3. Р. 169–175.
Ferracioli-Oda E., Qawasmi A., Bloch M.H. Meta-analysis: melatonin for the treatment of primary sleep disorders // PLoS One. 2013. Vol. 8. № 5. ID e63773.
Leger D., Laudon M., Zisapel N. Nocturnal 6-sulfatoxymelatonin excretion in insomnia and its relation to the response to melatonin replacement therapy // Am. J. Med. 2004. Vol.116. P. 91 – 95.
Attenburrow, M.E.J. Dowling B.A., Sharpley P.J. et al. Case-study of evening melatonin concentration in primary insomnia // Brit med j. 1996. Vol. 312. P. 1263 – 1264.
Тихомирова О.В., Бутырина Е.В., Зыбина Н.Н.. Фролова М.Ю. Оценка экскреции основного метаболита мелатонина в диагностике психофизиологической инсомнии / Медицинский алфавит. Современная лаборатория. 2013. №3. С. 46 – 52.
Lushington, K., Lack L., Kennaway D.J. et al. 6-Sulfatoxymelatonin excretion and self-reported sleep in good sleeping controls and 55-80-year-old insomniacs // J sleep res. 1998. Vol. 7. P. 75 – 83.
Lushington, K. Dawson D., Kennaway D.J. et al. The relationship between 6-sulphatoxymelatonin and polysomnographic sleep in good sleeping controls and wake maintence insomniacs, aged 55-80 years // J sleep res. 1999. Vol. 8. P. 57 – 64.
Hajak, G., Rodenbeck A., Staedt J. et al. Nocturnal plasma melatonin excretion in patients suffering from chronic primary insomnia // J. pineal res. 1995. Vol. 19. P. 116 – 122.
Тихомирова Ольга Викторовна
Заведующий отделом клинической неврологии и медицины сна
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Нарушение секреции мелатонина и эффективность заместительной терапии при расстройствах сна
Н.Н. ЗЫБИНА, О.В. ТИХОМИРОВА
Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России, Санкт-Петербург
Гормон шишковидной железы мелатонин является предметом интенсивных исследований в связи с его многофункциональностью и широким терапевтическим потенциалом. В обзоре представлены данные о зависимости синтеза эндогенного мелатонина от времени суток, возраста, размеров шишковидной железы, освещенности, приема бета-блокаторов и ряда других медикаментов. Обсуждаются результаты исследований по нарушению секреции и эффективности использования экзогенного мелатонина при расстройствах цикла сон-бодрствование, инсомнии, нейродегенерации, сахарном диабете, онкологических заболеваниях.
Мелатонин, экскреция 6-сульфатоксимелатонина, терапия, нарушения сна
Melatonin Parasecretion and Replacement Therapy Efficacy at Sleep Disturbances
N.N. ZYBINA, О.V. TIKHOMIROVA
Nikiforov Russian Center of Emergency and Radiation Medicine, EMERCOM of Russia, Saint-Petersburg
Melatonin, pineal gland hormone, is a subject of active studies due to its multifunctional performance and wide therapeutic potential. The review presents data on dependence of endogenous melatonin synthesis on the time of day, age, pineal gland size, lighting conditions, administration of beta-blockers and a number of other medications. The article discusses the results of studies on parasecretion and efficacy of exogenous melatonin use at sleep-wake cycle disturbances, insomnia, neurodegeneration, diabetes mellitus and oncological diseases.
Key words: Melatonin, 6-Sulfatoxymelatonin excretion, therapy, sleep disorders.