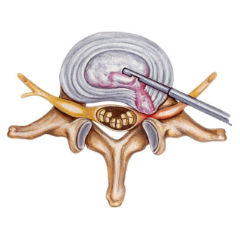
что делать если болит шов после операции на животе
боль после операции
Боль в области шва и другие виды боли
Почему не проходит боль после операции? Как снять боль после операции? Каковы причины боли после операции? – в данной статье мы поможем найти ответы на эти и подобные вопросы, а именно – расскажем об эффективном и безопасном методе лечения боли после операции, о причинах и симптомах этого заболевания, а также о наиболее популярных мифах, связанных с ним.
что такое боль после операции
Боль после операции – это мучительные или неприятные ощущения у пациента, перенёсшего операцию. Боли ощущаются не только в области шва или смежных с ней, но и в отдаленных областях.
Характер болей зависит от того, по поводу какого заболевания была проведена операция. Чаще всего такие боли развиваются после операций по удалению грыжи межпозвонкового диска, паховой грыжи, желчного пузыря, протезирования суставов, гинекологических операций, а также после кесарева сечения, травм и ожогов.
причины боли после операции
Боли после операции по удалению грыжи межпозвонкового диска имеют особые проявления: боль в пояснице может исчезнуть, но появиться спустя некоторое время; может начать неметь стопа, усиливаться боль в ноге, появиться покалывание всей ноги и ощущение «ползания мурашек», зачастую на ногу больно опираться. Относительное облегчение наступает лишь в постели в определенном положении (на боку, лежа на животе и т.д.).
Боли после других видов операций схожи в своих проявлениях: боль и скованность при движении, мышечные спазмы, ноющая боль в области шва.
Причинами развития боли после операции по удалению грыжи межпозвонкового диска как в ближайшем, так и в отдаленных послеоперационных периодах, являются:
После других операции боли возникают по следующим причинам:
развенчиваем мифы о боли после операции
На сегодняшний день существует ряд заблуждений о лечении боли после операции, порождаемых в основном отсутствием у человека, столкнувшегося с данной проблемой, объективной информации по поводу предлагаемой терапии. Постараемся внести ясность в этом вопросе и развенчать наиболее популярные мифы.
Реабилитация после операции на брюшной полости
В медицинском центре Ейска «Сенситив» в хирургическом отделении проводятся операции на брюшной полости. Любая полостная операция сопровождается травмированием тканей и разрушением защитных барьеров. В связи с этим реабилитация после операции на брюшной полости связана с восстановлением тканей, и требует неукоснительного выполнения врачебных рекомендаций.
Этапы реабилитации после операции на брюшной полости
В медицине реабилитацию после операции на брюшной полости разграничивают на несколько периодов:
В зависимости от вида операции врачами могут также назначаться разные режимы двигательной активности при реабилитации после операций на брюшной полости. Режим может быть строгим постельным, постельным, палатным и свободным.
Общие рекомендации при реабилитации
Ранний период реабилитации после операции на брюшной полости проходит в стационар-отеле под контролем врача медицинского центра Ейска «Сенситив». На протяжении первых нескольких часов в организме проявляется остаточное действие анестезии, к которому добавляется эмоциональный стресс и боль в области операционной раны. Помимо этого у больного прослеживаются симптомы гипокинезии: органы дыхания работают с нарушенной функцией. Чтобы все эти неприятные симптомы исчезли быстрее, врачи рекомендуют следующее:
В первые несколько дней после операции необходимо отслеживать результаты анализа крови и мочи, измерять температуру. Если есть даже малейшие признаки интоксикации (температура, расстройство мышления, нарушение координации), то пациенту требуется срочная помощь врача.
Заживление шва после полостной операции
Реабилитация после операции на брюшной полости во многом связана с тем, насколько быстро и хорошо заживает послеоперационный шов. На скорость заживления влияют следующие факторы:
Также важно в течение всего процесса заживления послеоперационной раны следить за тем, чтобы она не была инфицирована.
Для примера: после операции по удалению аппендикса шов заживает не менее недели. А если проводилась обширная лапаротомическая операция, то на заживление уйдет не менее 2 недель. Быстрее всего заживают раны после лапароскопической операции.
Рекомендации для реабилитации дома:
Университет
Николай Сивец, заведующий хирургическим отделением 6-й ГКБ Минска, доктор мед. наук, профессор кафедры военно-полевой хирургии БГМУ:
— Спаечной болезнью называют патологические состояния, связанные с образованием спаек в брюшной полости при ряде заболеваний, при травматических повреждениях внутренних органов, в т. ч. при операционной травме. Относится к числу еще не решенных проблем абдоминальной хирургии. В большинстве случаев — неизбежный брак именно хирургии, а не хирурга. Врач, спасая больного от одного смертельного заболевания, вынужденно способствует возникновению нового.
Большой вклад в изучение спаечной болезни внес Н. И. Пирогов, первым в России выполнивший операцию под эфирным наркозом по поводу странгуляционной тонкокишечной непроходимости. В 1914 году немецкий хирург Эрвин Пайр опубликовал 157 случаев спаек брюшной полости после различных вмешательств и впервые поставил вопрос о необходимости профилактики развития спаек. Исследования продолжили В. А. Оппель, Ю. М. Дедерер, В. А. Блинов.
С развитием хирургии шире становился диапазон операций. Чаще возникали и болезненные состояния, обозначаемые как спайки, спаечная непроходимость, спаечная болезнь. Изучение процесса спайкообразования показало, что болезненные состояния, сопровождающие образование спаек, дают значительные варианты клинических проявлений, обозначаемых симптомокомплексом спаечной болезни. Установлено: в основе спаечного процесса лежат нарушения функции брюшины, связанные с гипоксией, развивающейся вследствие длительного воспалительного процесса, что приводит к нарушению ее фибринолитической функции (А. Н. Дубяга, 1987; Р. А. Женчевский, 1989; D. M. Scott-Combes, 1995; J. N. Thompson, 1995; S. A. Whawell, 1995).
Наличие спаек приводит к снижению качества жизни, хроническим болям в животе, бесплодию у женщин, угрожает кишечной непроходимостью. По данным ряда авторов, 1% перенесших операции на органах брюшной полости ежегодно лечатся от спаечной болезни. Внутрибрюшные сращения после манипуляций хирурга на органах брюшной полости возникают в 80–90% случаев. Частота развития рецидива острой спаечной непроходимости кишечника — 30–69%, повторные операции усугубляют состояние и приводят к летальным исходам в 13–55% случаев.
Существует множество классификаций спаечной болезни, однако в практической работе чаще всего применяется классификация по Д. П. Чухриенко.
Масштабы спаечного процесса — от тотального до образования отдельных тяжей, фиксированных в двух точках. Как правило, спаечный процесс сильнее выражен в зоне операции. Часто петли кишок припаиваются к послеоперационному рубцу или фиксируются к стенкам послеоперационного грыжевого мешка.
Клинические проявления — от незначительных болей в животе до тяжелых форм острой кишечной непроходимости. Одна из основных жалоб — постоянная боль по всему животу без четкой локализации. Также отмечаются тошнота, нередко рвота, вздутие живота, урчание в кишечнике, затруднение отхождения газов и стула, желудочно-кишечный дискомфорт. Имеют место функциональные расстройства со стороны других органов, вовлеченных в спаечный процесс. При спаечной болезни с преобладанием болевого синдрома характерных изменений показателей периферической крови, функций печени, органов ЖКТ обычно не наблюдается.
Для установления диагноза «спаечная болезнь» необходимо провести рентгенологическое обследование ЖКТ, т. к. наличие лапаротомий в анамнезе еще не говорит о присутствии спаек в брюшной полости. Рентгенодиагностика основывается на обнаружении деформаций, необычной фиксации, сращений с брюшной стенкой в полипозиционном исследовании.
Лапароскопия до недавнего времени была противопоказана из-за высокого риска повреждения внутренних органов. Сейчас ее применяют при спаечной болезни как с диагностической, так и с лечебной целью.
Нередко эффективной в плане диагностики оказывается фиброколоноскопия.
Лабораторные данные не дают ничего патогномоничного.
Лечение трудное: никогда нельзя быть уверенным, что лапаротомия, произведенная при спаечной болезни, ликвидирует причины, вызвавшие спаечный процесс.
Вмешательства чаще выполняются по экстренным показаниям. В плановом порядке оперируются пациенты с хронической обтурационной и рецидивирующей спаечной непроходимостью.
В сложной ситуации оказывается хирург при наличии плотного конгломерата кишечных петель. Рациональным будет наложение выключающего обходного анастомоза; радикальным, оптимальным для больного — резекция всего конгломерата.
Самая серьезная проблема — рецидивирующая спаечная непроходимость кишечника, собственно спаечная болезнь.
Операции различны — в зависимости от характера сращений и вида кишечной непроходимости. Наиболее частая — разделение спаек. Плоскостные спайки, вызывающие перегибы, перетяжки, образование двустволок, рассекают. Соединительнотканные тяжи иссекают у места их прикрепления. Десерозированные поверхности на кишке перитонизируют путем наложения узловых швов на стенку кишки. При рубцовых спайках, деформирующих петли кишок без нарушения питания стенки, обычно накладывают обходные анастомозы между петлями тонких кишок, между тонкой и толстой кишкой, реже — между отделами толстой.
Важен выбор доступа. Многих оперируют не по разу — передняя брюшная стенка у них с рубцами. Поэтому лучшим доступом большинство хирургов считает нижнесрединную лапаротомию, которая при необходимости может быть расширена кверху. Доступ через старый операционный рубец чреват вскрытием просвета кишки.
Разрезы передней брюшной стенки должны быть достаточными. Брюшину не следует грубо захватывать и вытягивать на края раны; салфетки, введенные в брюшную полость, не фиксировать к брюшине. Необходимо избегать обширной эвентрации кишечных петель и высыхания висцеральной брюшины, их покрывающей. Кишечные петли укрывать влажными салфетками, смоченными изотоническим раствором хлорида натрия. Во время операции нужен тщательный гемостаз, а излившаяся кровь должна быть своевременно эвакуирована. Важно предупреждать попадание на париетальную и висцеральную брюшину растворов йода, спирта, масел, мелких инородных тел, сухих антибиотиков.
Случай из практики
Больной К., 55 лет. Врач по специальности. Обратился в хирургическое отделение 6-й ГКБ Минска в плановом порядке для консультации с направительным диагнозом «спаечная болезнь брюшной полости с эпизодами кишечной непроходимости». Жалуется на периодическое вздутие живота, приступы болей последние 3 месяца, тошноту, задержку отхождения газов и стула.
В 1971 году в возрасте 10 лет оперирован по поводу острого деструктивного аппендицита с разлитым перитонитом. Проведена аппендэктомия, брюшная полость дренирована. Через 2 недели повторно оперирован в связи с развившейся ранней послеоперационной спаечной кишечной непроходимостью. Выполнена лапаротомия, спайки разделены.
Спустя 10 лет оперирован в одной из клиник Минска по поводу острой спаечной кишечной непроходимости: лапаротомия, спайки рассечены, кишечная непроходимость ликвидирована. Через год в другой клинике снова оперирован по поводу острой спаечной кишечной непроходимости. Имел место массивный спаечный процесс в брюшной полости. Войти в полость удалось только путем иссечения внутренних листков влагалищ прямых мышц живота в мезогастрии.
При ревизии органов брюшной полости выявлено массивное распространение спаек по петлям тонкого и толстого кишечника с вовлечением в процесс большого сальника, париетальной и висцеральной брюшины. В правой половине брюшной полости обнаружен конгломерат из петель тонкого кишечника, слепой, восходящей и правой половины поперечно-ободочной кишки. Попытка выделить петли кишечника из конгломерата безуспешна. Операция завершена наложением обходного илеотрансверзоанастомоза «бок в бок».
Пациент выписан по выздоровлению. Около 20 лет выраженных симптомов нарушения пассажа по кишечнику не было.
Медленное ухудшение началось приблизительно 3 года назад, в течение последних 6 месяцев — интенсивное. Задержка стула и газов на 2–3 дня стала постоянным явлением. Пациент отказался от твердой и грубой пищи, стал есть мало. За 2 месяца до обращения в 6-ю ГКБ Минска принимал только жидкую пищу — часто, небольшими порциями. Для обеспечения пассажа по кишечнику менял положение тела и массировал переднюю брюшную стенку. Началось похудание, снижение работоспособности. В последние 3 недели рацион включал жидкие супы, детские гомогенизированные смеси и жидкий шоколад.
При первичном осмотре — пациент c пониженным питанием, однако без признаков истощения. Кожа обычной окраски, суховатая. Легкие, сердце — без особенностей. Живот не вздут. Имеются рубцы после аппендэктомии и верхнесреднесрединной лапаротомии. При пальпации живот мягкий, слабо болезненный в мезогастрии. По правому боковому каналу определяется инфильтрат без четких границ. Симптомы раздражения брюшины отрицательные.
Клинический диагноз при поступлении: «спаечная болезнь брюшной полости с хроническим нарушением пассажа по кишечнику».
Общеклинические анализы пациента без существенных отклонений.
На рентгенограмме легочные поля без видимых инфильтративных изменений. Усилен, обогащен легочной рисунок в прикорневых отделах, корни малоструктурные, несколько расширены. Сердце не расширено. Аорта уплотнена, развернута.
Выполнена фиброколоноскопия, к которой пациент во избежание острой спаечной кишечной непроходимости готовился сам в течение 2 дней (отказ от питания и питья; ни фортранс, ни очистительные клизмы не применялись). Проблем для осмотра кишечника при колоноскопии не возникло. Эндоскоп введен в купол слепой кишки. Просвет кишки обычный. В нем до печеночного угла незначительное количество промывных вод. Стенки кишки эластичны. Перистальтика, складки не изменены. Слизистая оболочка блестящая, розовая. Сосудистый рисунок в норме. Баугиниева заслонка хорошо выражена. Интубирован терминальный отдел подвздошной кишки. Просвет обычный, на слизистой уплощенные эрозии под фибрином. В просвете восходящей кишки большое количество сформированных каловых масс. В поперечно-ободочной кишке широкое устье илеотрансверзоанастомоза. Эндоскоп проведен в отводящую кишку на глубину 40–50 см. Просвет обычный. На слизистой множественные плоские эрозии на грани изъязвлений, под фибрином. Биопсия (3 фрагмента). Интубирована приводящая кишка на глубину до 35 см (без особенностей).
Заключение: состояние после наложения илеотрансверзоанастомоза (функционирует). Диффузный эрозивный илеит отводящей кишки (болезнь Крона?).
Рентгенологическое исследование кишечника с пассажем сернокислого бария решено не выполнять, дабы не спровоцировать острую спаечную кишечную непроходимость. Клиническая картина и данные колоноскопии достаточные для принятия обоснованного решения о выполнении хирургического вмешательства в плановом порядке.
Пациент оперирован под эндотрахеальным наркозом. Иссечен старый операционный рубец. Верхнесрединная лапаротомия с обходом пупка слева. Свободная брюшная полость как таковая отсутствует. Массивный спаечный процесс после предыдущих операций. К передней брюшной стенке на всем протяжении операционного рубца «вмурованы» петли тонкого кишечника, поскольку брюшина передней брюшной стенки была удалена на предыдущей операции. С техническими трудностями выполнена мобилизация проксимального отдела тонкой кишки. Кишка имеет ригидную стенку, диаметр около 6 см. Выявлено, что в 150 см от трейцевой связки имеется илеотрансверзоанастомоз. Дальнейшая мобилизация позволила установить в области илеотрансверзоанастомоза конгломерат петель тонкого кишечника. Конгломерат разделен, однако сами петли тонкого кишечника со стороны слепой кишки рубцово изменены и признаны функционально несостоятельными. Пальпаторно определяется стриктура отводящего сегмента илеотрансверзоанастомоза. Прослежен ход тонкой кишки от трейцевой связки до илеотрансверзоанастомоза. Последний наложен антиперистальтически.
По правому боковому каналу имеется конгломерат петель тонкого кишечника, не разделенный на предыдущей операции. Попытка его разделения оказалась безуспешной. В результате тщательной ревизии установлено, что причиной нарушения пассажа по тонкой кишке являются множественные ее спайки и перегибы, конгломерат кишечных петель по правому боковому каналу, а также стриктура илеотрансверзоанастомоза. Спайки, насколько это возможно, разъединены. Петли кишечника расправлены по левой половине брюшной полости. Справа разделить петли тонкого кишечника без их повреждения нереально. Показана правосторонняя гемиколэктомия. Единым блоком мобилизован конгломерат кишечных петель, включающий около 80 см рубцово-измененной, со спайками подвздошной кишки, слепую, восходящую и правую половину поперечно-ободочной кишки с илеотрансверзоанастомозом. Правосторонняя гемиколэктомия выполнена. Сформирован изоперистальтический илеотрансверзоанастомоз «конец в конец» двухрядным швом. Анастомоз проходим, наложен без натяжения. Ушито «окно» в брыжейке кишечника. Частично восстановлена целостность брюшины правого бокового канала. Дренажная трубка по правому боковому каналу и в малый таз, а также по левому боковому каналу. Брюшная полость осушена. Рана передней брюшной стенки послойно ушита с наложением механического кожного шва. Повязка. Длительность операции — 9 часов 15 минут.
Макропрепарат: рубцово-измененные петли тонкого кишечника (около 80 см подвздошной кишки), слепая, восходящая и половина поперечно-ободочной с илеотрансверзоанастомозом общей длиной около 140 см.
Гистологическое заключение: фрагменты тонкой и толстой кишок с десквамацией эпителия в просвете, геморрагиями, очаговыми некробиотическими изменениями слизистого слоя толстой кишки, скудной лимфолейкоцитарной инфильтрацией в слизистом и подслизистом слоях. Со стороны серозы — разрастание фиброзной ткани с неоангиогенезом, лейкоцитарной инфильтрацией. В краях резекции — аналогичные изменения. Брыжейка с полнокровными сосудами, лимфатическими узелками с синусовым гистиоцитозом, участками фиброзной ткани.
Заключительный клинический диагноз: хроническая спаечная болезнь брюшной полости с тотальным спаечным процессом и нарушением пассажа по кишечнику. Рубцовая стриктура илеотрансверзоанастомоза.
Операция: лапаротомия, ликвидация спаечного процесса, правосторонняя гемиколэктомия с резекцией илеотрансверзоанастомоза и формированием нового илеотрансверзоанастомоза «конец в конец».
Послеоперационный период протекал гладко, дренажи удалены на 3-и–4-е сутки, рана зажила первичным натяжением. Пациент выписан с выздоровлением. Стул на день выписки и позже — 3 раза в сутки. Признаков нарушения пассажа по кишечнику в ближайшем послеоперационном периоде не отмечается.
1. Операции при длительно протекающей спаечной болезни органов брюшной полости с хроническим нарушением пассажа по кишечнику предпочтительнее проводить в плановом порядке, в дневное время, подготовленной хирургической бригадой.
2. Во избежание повреждения петель тонкого кишечника лучшим доступом следует считать нижнесрединную лапаротомию, которая при необходимости может быть расширена кверху.
3. Рационально накладывать выключающий обходной анастомоз; радикальный, оптимальный для больного вариант — резекция всего конгломерата.
4. Оперируя пациента со спаечной болезнью, необходимо соблюдать ряд известных мер, предупреждающих рецидив спайкообразования.
Медицинский вестник, 18 июля 2016
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.