что даст если число молекул поделить на число авогадро
Закон Авогадро.
Закон Авогадро состава сформулирован в 1811 г итальянский химик Амедео Авогадро.
Закон Авогадро формулируется так:
В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
Следствие из закона:
1 моль (6,02×10 23 молекул – число Авогадро) любого газа при нормальных условиях занимает объем 22,4 л. Эта величина называется молярный объём.
Нормальными условиями (н.у.) считают температуру 0 о С (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па).
Пример. Определить число молекул, содержащихся в воде количеством 0,5 моль.
Молекулярная масса Mr – отношение массы молекулы к 1/12 части массы атома углерода С.
Молярная масса M – отношение массы вещества m к его количеству ν, выражается в единицах г/моль.
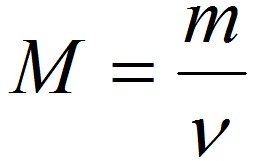
Из закона Авогадро следует, что массы двух газов (m1 и m2), взятых в одинаковых объёмах, должны относится друг к другу, как их как их молекулярные массы или как численно равные их молярные массы (M1 и M2):

Отношение массы одного газа к массе другого газа, взятого при тех же условиях (температуре и давлении), называется относительной плотностью первого газа по второму.
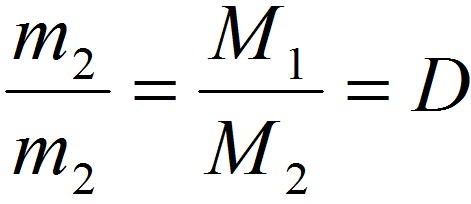
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
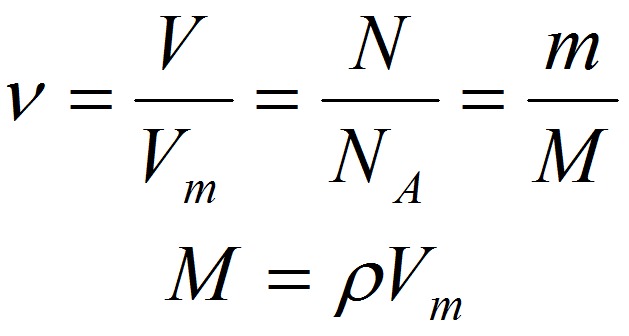
Для приведения объёма газа к нормальным условиям используется уравнение, объединяющее законы Бойля-Мариотта и Гей-Люссака:
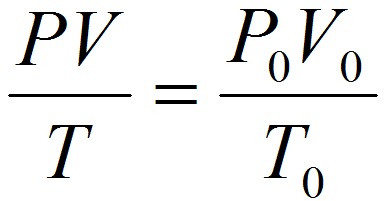
где V – объём газа при давлении Р и температуре Т.
Молярные массы можно вычислить пользуясь уравнением Менделеева-Клапейрона:
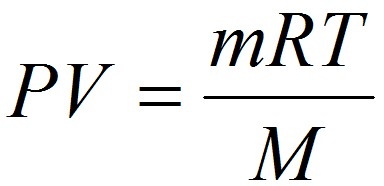
Р – давление газа, Па;
m – масса вещества, г;
М – молярная масса вещества;
Т – абсолютная температура;
R – универсальная газовая постоянная 8,314 Дж/(моль×К).
Пример. Какой объём занимает 0,2 моль N2 при н.у.?
1. Используем формулу
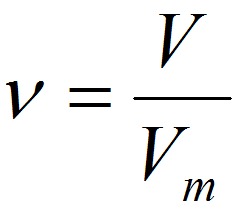
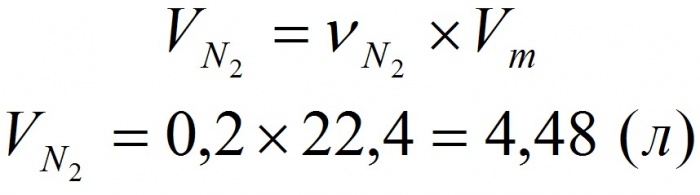
Урок №40. Закон Авогадро. Молярный объем газов
итальянский учёный-химик, первооткрыватель фундаментального физико-химического закона, названного его именем.
Закон Авогадро : в равных объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. (1811 г, итальянский учёный Амедео Авогадро)
Cледствия из закона Авогадро :
1 следствие:
Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объём.
Так, 6,02 ∙ 10 23 молекул (1 моль) любого газа и любой смеси газов при (н.у.) занимает объём равный 22,4 л.
Такой объём называется молярным объёмом и обозначается V m
Молярный объём V m – это постоянная величина для веществ – газов при нормальных условиях (н.у.) V m = 22,4 л/моль
Нормальными условиями (н.у.) для газов считаются:
P 0 = 1 атм. = 101325 Па = 760 мм. рт. ст.
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
ν = V/V m = N/N a = m/M
M = ρ‧V m
Молекулярная физика. Моль. Постоянная Авогадро. Количество вещества.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12 С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NA:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в 1 моле вещества:

Формулировка и определение закона Авогадро
Закон Авогадро в химии — история открытия
Известно, что вещества бывают в твердом, жидком и газообразном состоянии. Частицы жидкости и твердого вещества расположены близко по отношению друг к другу. Это объясняется взаимным притяжением молекул. Можно сделать вывод о существовании сил, удерживающих молекулы жидкости или твердого вещества вместе. Такие силы носят название сил межмолекулярного взаимодействия.
Молекулы газов существенно удалены друг от друга, что отличает подобные вещества от жидкостей и твердых. На таком расстоянии взаимодействие между молекулами почти отсутствует. В связи с этим, для трансформации вещества из жидкого или твердого агрегатного состояния в газообразное требуется преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние реализуется в результате повышения температуры веществ, которые находятся в виде жидкости или твердого:
Исходя из того, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, — это, по существу, объем свободного пространства между хаотично перемещающимися молекулами газа. Величина данного пространства определяется условиями, при которых находится газ:
Такая величина приблизительно одинакова для всех газообразных веществ при одинаковых температуре и давлении. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Отсюда вытекает закон Авогадро.
Согласно закону Авогадро, если объемы различных газов равны и взяты при одинаковых температурах и давлении, то они содержат одинаковое число молекул. Гипотезу выдвинул в 1811 году в Турине профессор физики Амедео Авогадро. Данная закономерность нашла подтверждение в многочисленных экспериментальных исследованиях и в дальнейшем получила название закона Авогадро.
Спустя полвека после открытия, на съезде химиков в Карлсруэ признали значение этого закона и приняли его за количественную основу современной химии (стехиометрии). Закон Авогадро в точности выполняется в случае идеального газа. Точность расчетов повышается с увеличением степени разреженности газообразного вещества.
Впервые количественные исследования взаимодействия газов между собой провел французский ученый Гей-Люссак. Ученому принадлежит авторство законов о тепловом расширении газов и закона объемных отношений. Теоретическое объяснение данных постулатов было представлено в 1811 году итальянским физиком Амедео Авогадро.
Интересным является тот факт, что при жизни открытие Авогадро осталось незамеченным по причине критических отзывов со стороны авторитетных химиков той эпохи — Йенса Якоба Берцелиуса и Джона Дальтона, которые утверждали, что возможность существования двухатомных молекул простых веществ отсутствует. Лишь в 1858 году труды Авогадро были по случайному стечению обстоятельств обнаружены итальянским химиком Станислао Канниццаро и обнародованы в 1860 году на Первом международном химическом конгрессе в Карлсруэ (Германия).
Формулировка закона, основная формула
Закон Авогадро: в равных объемах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул.
В химии можно встретить другую формулировку, которая следует из закона: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,4 л.
Нормальные условия предполагают температурный режим в 273,15 К (0 °C). Давление при этом составляет 1 атм.
В формулировке закона речь идет о равных объемах. При наличии, к примеру, 1 м³ кислорода и 2 м³ азота соотношение Авогадро выполняться не будет. Закон выполняется точно в случае сравнения идеальных газов. Чем сильнее газ отличается от идеального, тем больше отклонение от закона Авогадро.
Идеальными называют газы, частицы которых не взаимодействуют, а их размеры пренебрежимо малы.
Для выполнения закона давление и температура должны быть одинаковы. В противном случае — при разных температурах и давлениях — плотности газов будет отличаться и равенство выполняться не будет.
Пусть температура и давление газа постоянны T=const, p=const, объем не меняется V=const, тогда N — число частиц (молекул) любого идеального газа, является величиной неизменной. Данное утверждение является формулировкой закона Авогадро.
В равных объемах газов V при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул. Предпосылкой к открытию закона стало правило кратных отношений: при одинаковых условиях объемы газов, которые взаимодействуют между собой, находятся в простых соотношениях, к примеру, 1:1, 1:2, 1:3.
Закон объемных отношений: объемы газов, которые участвуют в химической реакции, при одинаковых условиях (температуре и давлении) относятся друг к другу, как простые целые числа.
В качестве примера можно привести следующие реакции:
Реальные газообразные системы в распространенных случаях представляют собой смесь чистых газов, в том числе, кислорода, водорода, азота, гелия и других. К примеру, в состав воздуха входят (в % по объему):
Каждый из перечисленных газов оказывает давление на стенки сосуда, в котором он заключен. Исходя из этого, можно ввести еще одно важное определение.
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
Закон Авогадро, с другой стороны, является следствием основного уравнения молекулярно-кинетической теории:
С учетом концентрации:
Последняя запись позволяет сделать вывод о количестве молекул газа:
Таким образом, можно заключить, что при одинаковых условиях (одинаковых давлении и температуре) в равных объемах различных газов число молекул будет одинаковым.
Первое и второе следствия из закона Авогадро
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
где V μ — является молярным объемом газообразного вещества (размерность л/моль);
V — объем вещества системы;
n — определяет количество вещества системы.
Можно записать следующее справедливое равенство:
V μ газа (н.у.) = 22,4 л/моль.
Второе следствие из закона Авогадро: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов.
Величина, описанная во втором следствии закона Авогадро, то есть отношение масс одинаковых объемов двух газов, является относительной плотностью D.
D = m 1 m 2 = μ 1 μ 2
где μ 1 и μ 2 — молярные массы двух газов.
Параметр D рассчитывается по результатам экспериментальных опытов как отношение масс одинаковых объемов рассматриваемого газообразного вещества m 1 и эталонного газа, молекулярная масса которого известна ( m 2 ). В зависимости от величины D и μ 2 определяют молярную массу исследуемого газа:
Относительную плотность в распространенных случаях определяют по отношению к воздуху или водороду, зная, что молярные массы водорода и воздуха известны и равны, соответственно:
Концентрация молекул идеального газа при нормальных условиях:
Данная величина носит название числа Лошмидта.
Особенности применения, примеры решения задач
При этом учитывается плотность его пара, которая в 5,85 раз превышает плотность воздуха. Таким образом, молекулярная масса рассматриваемого вещества равна:
ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м.
Газообразные вещества, молярная масса которых меньше 29, легче, чем воздух. В том случае, когда молекулярная масса газа больше 29, вещество тяжелее воздуха.
В задачах по химии можно встретить заданные относительные плотности неизвестного газа по азоту, кислороду и другим газам. Тогда, чтобы найти молярную массу неизвестного газообразного вещества, следует умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро нашел широкое применение в расчетах в химии. В связи с тем, что для газов объемы пропорциональны количествам (моль) веществ, коэффициенты в уравнении реакции между газообразными веществами, которые отражают количественное соотношение реагирующих веществ, пропорциональны объемам взаимодействующих газов. Измерения объемов проводят при одинаковых условиях.
Имеется газообразное вещество с относительной плотностью по водороду, равной 8. Нужно найти молярную массу этого газа.
М ( Х ) = М ( Н 2 ) ∙ D = 2 ∙ 8 = 16 г/моль
Газ с соответствующей молярной массой является метаном C H 4
Некий газообразный углеводород обладает относительной плотностью по воздуху, равной 2. Требуется рассчитать молярную массу этого углеводорода.
Средняя молярная масса воздуха составляет 29 г/моль
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль
Необходимо вычислить объем кислорода, который нужен, чтобы сжечь 2 дм³ пропана. Измерения объемов проводились при нормальных условиях.
Следует записать уравнение химической реакции:
С 3 Н 8 + 5 О 2 → 3 С О 2 + 4 Н 2 О
1 дм 3 С 3 Н 8 — 5 дм 3 O 2
2 дм 3 С 3 Н 8 — 10 дм 3 O 2
Ответ: V ( О 2 ) = 10 дм 3
Требуется вычислить объем, занимаемый 0,5 моль C l 2 при нормальных условиях, и объем, который займут 142 гр хлора при нормальных условиях.
По условиям задачи величины представлены в СИ, поэтому можно выполнить расчеты:
Вторая часть задания решается с помощью уравнения для количества вещества:
Определить молярную массу хлора можно по таблице Менделеева:
Путем подстановки первого выражения во второе, получим:
Ответ: Объем 0,5 молей хлора займут объем 11,2 л. Объем 142 гр хлора — 44,8 л.
D = m 1 m 2 = μ x μ H 2 → μ x = 23 · 2 = 46 г м о л ь
Далее необходимо вычислить массу углерода путем составления пропорции:
Аналогичным способом можно определить массу водорода:
Согласно закону сохранения массы, масса кислорода составит:
Далее нужно определить количество молей атомов элементов:
Согласно закону отношений:
После деления чисел из последнего выражения на 0,3, получим:
Таким образом, получается простейшая формула:
μ C 2 H 6 O = 24 + 6 + 16 = 46 г м о л ь
Необходимо вычислить, какой объем занимает 0,2 моль N 2 при нормальных условиях.
ν ( N 2 ) = V ( N 2 ) / V m
V ( N 2 ) = ν ( N 2 ) · V m = 0,2 моль · 22,4 л / моль = 4,48 л
Нужно определить объем, занимаемый 56 г газа СО при н.у.
ν ( C O ) = V ( C O ) / V m
V ( C O ) = ν ( C O ) · V m
Неизвестное количество вещества можно рассчитать по формуле:
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
ν (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO ) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Требуется рассчитать объем, занимаемый 8 г газа O 2 при нормальных условиях.
В первую очередь следует определить количество молей в заданной массе кислорода:
Объем газа составит:
Молярная масса кислорода O 2 :
Таким образом, можно определить:
Газообразное вещество массой 1 г при нормальных условиях занимает объем 1,32 л. Необходимо вычислить, какова относительная плотность этого газа по хлору.
Количество вещества данного газа составляет:
Можно записать другую формулу для расчета количества вещества:
В результате, правые части уравнений допустимо приравнять и определить молярную массу газа:
Относительная плотность газа по хлору:
D = μ μ C l = m V μ μ C l V
Молярная масса хлора:
После перевода единиц в систему СИ получим:
Далее можно рассчитать относительную плотность:
Один моль вещества содержит число Авогадро молекул:
Количество молей углекислого газа:
Объем, который занимает газообразное вещество, составит:
V = ν V μ = N N A V μ
Количество молекул, содержащееся в массе m вещества, можно найти с помощью следующего отношения:
Молярная масса фтористого водорода:
После перевода в СИ, получим, что масса фтористого водорода:
Объем, который занимает газообразный фтор с аналогичным количеством молекул, равен:
V = ν V μ = N N A V μ
Число Авогадро
Современная классическая физика полна архаизмов, одним из которых является «число Авогадро». Вот как оно определяется в современных справочниках по физике:
В 1814 году итальянский учёный Амадео Авогадро (1776 – 1856) опубликовал статью «Очерк об относительных массах молекул простых тел, или предполагаемых плотностях их газа, и о конституции некоторых из их соединений», в которой он сформулировал новый закон:
«…равные объёмы газообразных веществ при одинаковых давлениях и температурах отвечают равному числу молекул, так что плотности различных газов представляют собою меру масс молекул соответствующих газов».
Сам Авогадро ни в этой статье, ни позже, не предпринимал попыток посчитать это самое количество молекул, поэтому в этом смысле он никакого отношения к числу (постоянной) названной его именем не имеет. Вычислять это число стали позже и совсем другие учёные. Поскольку в то время атомная физика только только осваивала открывшиеся горизонты, ни кто и понятие не имел о структуре атома. Но подсчитать открытые Авогадро молекулы очень хотелось.
Первым эту попытку предпринял в 1866 г. Йозеф Лошмидт (1821-1895) и насчитал 1,81*10^(24) молекул в одном куб. метре газа.
Приблизительно в это же время голландский физик Ван дер Ваальс (1837 – 1923) предположил, что молекул в одном моле идеального газа (0,022414 куб. м) должно быть более 4,5*10^(23), что собственно уже представляло собой число Авогадро, но значение, которое ещё было далеко от реального.
В наше время, с иными финансовыми возможностями, «число Авогадро» определили следующим образом.
В 2010 году для этого использовались две сферы, сделанные из кремния-28. Сферы были получены в Институте кристаллографии имени Лейбница и отполированы в австралийском Центре высокоточной оптики настолько гладко, что высоты выступов на их поверхности не превышали 98 нм.
Для их производства был использован высокочистый кремний-28, выделенный в нижегородском Институте химии высокочистых веществ РАН из высокообогащённого по кремнию-28 тетрафторида кремния, полученного в Центральном конструкторском бюро машиностроения в Санкт-Петербурге.
Располагая такими практически идеальными объектами, можно с высокой точностью подсчитать число атомов кремния в шаре и тем самым определить число Авогадро.
Согласно полученным результатам, оно равно 6,02214084(18)*10^(23) моль^(-1). Однако в январе 2011 года были опубликованы результаты новых измерений, считающиеся более точными: N(A) = 6,02214078(18)*10^(23) моль^(-1).
Итак, казалось бы, эпопея с определением «числа Авогадро» подошла к своему финалу. Но не всё так просто.
Для того чтобы понять что же все таки сосчитало это самое «число Авогадро» необходимо разобраться с понятием «моль».
Сегодня под «молем» понимают количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Итак, под «молем» понимается 12 граммов углерода-12. Зная, сколько весит один атом углерода, не сложно определить, сколько таких атомов содержит один «моль».
В соответствии с таблицей Менделеева углерод-12 содержит в своём составе 6 протонов, 6 нейтронов и 6 электронов.
m(p) – 1,6726*10^(-27) кг;
m(n) – 1,6749*10^(-27) кг;
m(э) – 9,109*10*^(-31) кг.
Масса атома углерода-12 в этом случае равна
М(С) = 6m(p) + 6m(n) + 6m(э) = 20,0905^10(-27) кг
N = 0,012 / М(С) = 5,97297*10^(23) моль^(-1)
А теперь посмотрим, сколько максимум может содержать структурных элементов один килограмм идеального вещества состоящего только из одних протонов:
N(max) = 1 / m(p) = 5,978716*10^(26) кг^(-1) = 5,978716*10^(23) г^(-1)
Таким образом, во-первых, современный «моль» в определении «числа Авогадро» соответствует одному грамму, поэтому не совсем понятно кому нужен был этот мыльный пузырь. А, во-вторых, его «абсолютно точное» значение ни имеет никакого отношения к реальности – это чистой воды алхимия.