что дает если умножить постоянную больцмана на число авогадро
Постоянная Больцмана
Для постоянной, связанной с энергией излучения чёрного тела, смотри Постоянная Стефана-Больцмана
Значение постоянной k [1]
1,380 6504(24) • 10 −23
Смотри также Значения в различных единицах ниже.
Постоянная Больцмана ( k или kB ) — физическая постоянная, определяющая связь между температурой вещества и энергией теплового движения частиц этого вещества. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в системе СИ равно
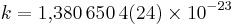
В таблице последние цифры в круглых скобках указывают стандартную погрешность значения постоянной. В принципе, постоянная Больцмана может быть получена из определения абсолютной температуры и других физических постоянных. Однако точное вычисление постоянной Больцмана с помощью основных принципов слишком сложно и невыполнимо при современном уровне знаний.
Экспериментально постоянную Больцмана можно определить с помощью закона теплового излучения Планка, описывающего распределение энергии в спектре равновесного излучения при определённой температуре излучающего тела, а также другими методами.
Существует связь между универсальной газовой постоянной 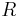
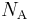
Размерность постоянной Больцмана такая же, как и у энтропии.
Содержание
История
В 1877 г. Больцман впервые связал между собой энтропию и вероятность, однако достаточно точное значение постоянной k как коэффициента связи в формуле для энтропии появилось лишь в трудах М. Планка. При выводе закона излучения чёрного тела Планк в 1900–1901 гг. для постоянной Больцмана нашёл значение 1,346 • 10 −23 Дж/K, почти на 2,5% меньше принятого в настоящее время. [2]
До 1900 г. соотношения, которые сейчас записываются с постоянной Больцмана, писались с помощью газовой постоянной R, а вместо средней энергии на одну молекулу использовалась общая энергия вещества. Лаконичная формула вида S = k log W на бюсте Больцмана стала таковой благодаря Планку. В своей нобелевской лекции в 1920 г. Планк писал: [3]
Эта константа часто называется постоянной Больцмана, хотя, насколько я знаю, сам Больцман никогда не вводил её — странное состояние дел, при том, что в высказываниях Больцмана не было речи о точном измерении этой константы.
Такая ситуация может быть объяснена проведением в то время научных дебатов по выяснению сущности атомного строения вещества. Во второй половине 19 века существовали значительные разногласия в отношении того, являются ли атомы и молекулы реальными, либо они лишь удобный способ описания явлений. Не было единства и в том, являются ли «химические молекулы», различаемые по их атомной массе, теми же самыми молекулами, что и в кинетической теории. Далее в нобелевской лекции Планка можно найти следующее: [3]
«Ничто не может лучше продемонстрировать положительную и ускоряющуюся скорость прогресса, чем искусство эксперимента за последние двадцать лет, когда было открыто сразу множество методов измерения массы молекул практически с той же точностью, что и измерение массы какой-нибудь планеты».
Уравнение состояния идеального газа
Для идеального газа справедлив объединённый газовый закон, связывающий давление P, объём V, количество вещества n в молях, газовую постоянную R и абсолютную температуру T:
В данном равенстве можно сделать замену 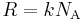
Связь между температурой и энергией
Соотношения газовой термодинамики
Кинетическая теория даёт формулу для среднего давления P идеального газа:
Учитывая, что средняя кинетическая энергия прямолинейного движения равна:
находим уравнение состояния идеального газа:
Это соотношение неплохо выполняется и для молекулярных газов; однако зависимость теплоёмкости изменяется, так как молекулы могут иметь дополнительные внутренние степени свободы по отношению к тем степеням свободы, которые связаны с движением молекул в пространстве. Например, двухатомный газ имеет уже приблизительно пять степеней свободы.
Множитель Больцмана
В общем случае система в равновесии с тепловым резервуаром при температуре T имеет вероятность p занять состояние с энергией E, что может быть записано с помощью соответствующего экспоненциального множителя Больцмана:
В данном выражении фигурирует величина kT с размерностью энергии.
Вычисление вероятности используется не только для расчётов в кинетической теории идеальных газов, но и в других областях, например в химической кинетике в уравнении Аррениуса.
Роль в статистическом определении энтропии
п V знак равно п р Т знак равно м р s п е c я ж я c Т <\ displaystyle PV = nRT = mR _ <\ rm
СОДЕРЖАНИЕ
Габаритные размеры
Из закона идеального газа PV = nRT получаем:
Поскольку давление определяется как сила, приходящаяся на область измерения, уравнение газа также можно записать как:
р знак равно ж о р c е а р е а × v о л ты м е а м о ты п т × т е м п е р а т ты р е <\ displaystyle R = <\ frac <<\ dfrac <\ mathrm
Площадь и объем равны (длина) 2 и (длина) 3 соответственно. Следовательно:
р знак равно ж о р c е ( л е п грамм т час ) 2 × ( л е п грамм т час ) 3 а м о ты п т × т е м п е р а т ты р е знак равно ж о р c е × л е п грамм т час а м о ты п т × т е м п е р а т ты р е <\ displaystyle R = <\ frac <<\ dfrac <\ mathrm
Поскольку сила × длина = работа:
р знак равно ш о р k а м о ты п т × т е м п е р а т ты р е <\ displaystyle R = <\ frac <\ mathrm
В противном случае мы также можем сказать, что:
Следовательно, мы можем записать R как:
Связь с постоянной Больцмана
Измерение и замена на определенное значение
Однако после переопределения базовых единиц СИ в 2019 году R теперь имеет точное значение, определенное в терминах других точно определенных физических констант.
Удельная газовая постоянная
р s п е c я ж я c знак равно р M <\ displaystyle R _ <\ rm
Так же, как постоянная идеального газа может быть связана с постоянной Больцмана, то же самое можно сделать и с постоянной газом путем деления постоянной Больцмана на молекулярную массу газа.
р s п е c я ж я c знак равно k B м <\ displaystyle R _ <\ rm
Еще одно важное соотношение исходит из термодинамики. Соотношение Майера связывает удельную газовую постоянную с удельной теплоемкостью для калорийно совершенного газа и термически совершенного газа.
Стандартная атмосфера США
Обратите внимание на использование киломолей, что дает коэффициент 1000 в константе. USSA1976 признает, что это значение не согласуется с приведенными значениями для постоянной Авогадро и постоянной Больцмана. Это несоответствие не является существенным отклонением от точности, и USSA1976 использует это значение R * для всех расчетов стандартной атмосферы. При использовании значения R по ISO расчетное давление увеличивается всего на 0,62 паскаль на 11 км (эквивалент разницы всего в 17,4 сантиметра или 6,8 дюйма) и на 0,292 Па на 20 км (эквивалент разницы всего в 33,8 см или 13,2 дюйма).
Также обратите внимание, что это было задолго до переопределения SI 2019 года, благодаря которому константе было присвоено точное значение.
 masterok
masterok
Мастерок.жж.рф
Хочу все знать
Иоганн Йозеф Лошмидт – имя, которое, может быть, и не многим знакомо, но все, кто хорошо знает химию, наверняка сталкивались с новаторским вкладом Лошмидта в науку. Он обнаружил точное число элементарных единиц (атомов или молекул), которое содержится в одном моле вещества. Это число, однако, носит имя итальянского учёного, что несправедливо, поскольку даже этот знаменитый итальянский учёный не понимал его ценности.
Речь идёт о числе Авогадро, или константе Авогадро.
Йозеф Лошмидт родился в бедной крестьянской семье в 1821 году в маленькой деревне на территории нынешней Чехии. С помощью деревенского священника и католической церкви Лошмидту удалось получить образование в монастыре, после чего он переехал в Прагу, где стал студентом Карлова университета. Он изучал философию и математику. В возрасте двадцати лет Лошмидт переехал в Вену и поступил в Политехнический институт на физико-химический факультет.
Он окончил университет в 1846 году со степенью бакалавра, но не смог получить академическую должность. Расстроившись, Лошмидт даже задумался о переезде в Соединённые Штаты. Но вместо этого он пошёл работать на бумажную фабрику, а затем основал компанию под Веной по производству нитрата калия, которая в конечном итоге обанкротилась.
В 1856 году Лошмидт стал учителем средней школы в Вене. В свободное время он проводил эксперименты в небольшой лаборатории, которую ему выделила школа. Пять лет спустя он опубликовал свой первый важный трактат по химии — 47-страничную брошюру, описывающую молекулярные структуры более чем 270 органических соединений. Она включал в себя соединения, которые ещё не были выведены, такие как циклопропан, структуру которого он правильно предсказал более чем за два десятилетия до его открытия. Более того, стиль, который Лошмидт использовал для того, чтобы изобразить эти молекулярные структуры, удивительно похож на стиль, используемый современными химиками — двойные линии для двойных связей и тройные линии для тройных связей.
В этой же книге Лошмидт упомянул бензол, соединение, которое озадачило учёных. Хотя учёные знали, сколько атомов углерода и водорода содержится в молекуле бензола, они не могли понять, как они расположены. Лошмидт был первым, кто увидел, что атомы упорядочены в кольцо. К сожалению, он допустил ошибку, которую четыре года спустя исправил немецкий химик Август Кекуле. Кекуле утверждал, что структура явилась ему во сне. Ему достались лавры, в то время как о вкладе Лошмидта почти забыли. По иронии судьбы, Кекуле первоначально отклонил работу Лошмидта, заявив, что нельзя вывести молекулярную структуру органических соединений, исходя исключительно из химических реакций.
Сегодня он считается главным основателем теории химического строения.
Большой загадкой того времени был размер молекул. Многие учёные пытались измерить его? опираясь на другие физические свойства, такие как поверхностное натяжение или прочность жидкости на разрыв, но проблема оставалась нерешённой до 1865 года, когда Лошмидт вывел зависимость между размером молекул газа и расстоянием, которое они преодолевают между столкновениями. Он пришёл к хорошему выводу — один нанометр, что было всего в два раза больше современного принятого значения.
Работая над проблемой размера молекулы, Лошмидт осознал, что можно определить количество молекул в определённом объеме газа при стандартных температуре и давлении. Итальянский учёный Авогадро предположил полвека назад, что если два разных газа при одинаковой температуре и давлении занимают один и тот же объём, то они должны иметь одинаковое количество молекул. Авогадро не знал, сколько это молекул, но у Лошмидта был ответ — примерно 2,686 × 1025 на кубический метр при нулевой температуре и давлении в одну атмосферу. Это число теперь известно как константа Лошмидта. Благодаря работе Лошмидта другие учёные смогли доказать гипотезу Авогадро. Они определили «число Авогадро» как количество молекул, содержащихся в одном моле вещества. Константа Лошмидта почти не используется, но число Авогадро (6,022×1023) находит широкое применение в физике и химии. Единственное тонкое признание, которое Лошмидт получил за свою работу – это символ L, который иногда используется для обозначения константы Авогадро.
Лошмидт также внёс свой вклад в работу Максвелла и Больцмана по термодинамике. Его экспериментальные исследования в области электромагнетизма теперь носят имена людей, которые завершили их — таких как Эдвин Холл, Джон Керр и Генрих Герц. Он как-то в шутку сказал своему давнему другу Больцману, что ему следует основать научный журнал для публикации своих неудачных экспериментов.
Когда Лошмидт умер в 1895 году, Больцман так отозвался о своём хорошем друге: «Его работа образует мощный краеугольный камень, который будет виден, пока существует наука… Чрезмерная скромность Лошмидта не позволяла оценить его работу по достоинству, хотя это было возможно, и он этого действительно заслуживал».
Постоянная Авогадро
Число́ Авога́дро, константа Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA, реже как L [1].
Значение числа Авогадро, рекомендованное 2006 году [2]:
Моль — количество вещества, которое содержит NA структурных элементов (т.е. столько же, сколько атомов содержится в 12 г 12 С), причем структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моля вещества, выраженная в граммах, численно равна его молекулярной массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит примерно 6,02·10 23 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2×18,998) = 78,076 г и содержит 6,02·10 23 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4×35,453) = 153,823 г и т. п.
Закон Авогадро
На заре развития атомной теории (1811) А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й. Лошмидт; было установлено, что в 1 см³ идеального газа при нормальных условиях содержится 2,68675·10 19 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Связь между константами
См. также
Полезное
Смотреть что такое «Постоянная Авогадро» в других словарях:
постоянная Авогадро — Avogadro konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. Avogadro constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро … Penkiakalbis aiškinamasis metrologijos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis fizika atitikmenys: angl. Avogadro’s constant; Avogadro’s number vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. постоянная Авогадро, f; число Авогадро, n pranc. constante d’Avogadro, f; nombre… … Fizikos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis Energetika apibrėžtis Apibrėžtį žr. priede. priedas( ai) MS Word formatas atitikmenys: angl. Avogadro’s constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро, f; постоянная… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
АВОГАДРО ПОСТОЯННАЯ — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022?1023 моль 1. Названа по имени А. Авогадро … Современная энциклопедия
Авогадро постоянная — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022´1023 моль 1. Названа по имени А. Авогадро. … Иллюстрированный энциклопедический словарь
Авогадро Амедео — Авогадро (Avogadro) Амедео (9.8.1776, Турин, ‒ 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения… … Большая советская энциклопедия
Авогадро — (Avogadro) Амедео (9.8.1776, Турин, 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения физико… … Большая советская энциклопедия
АВОГАДРО ПОСТОЯННАЯ — (число Авогадро), число структурных элементов (атомов, молекул, ионов или др. ч ц) в ед. кол ва в ва (в одном моле). Названа в честь А. Авогадро, обозна чается NA. А. п. одна из фундаментальных физических констант, существенная для определения мн … Физическая энциклопедия
ПОСТОЯННАЯ — величина, имеющая неизменное значение в области её использования; (1) П. Авогадро то же, что Авогадро (см.); (2) П. Больцмана универсальная термодинамическая величина, связывающая энергию элементарной частицы с её температурой; обозначается k,… … Большая политехническая энциклопедия
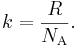
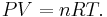
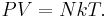
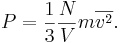
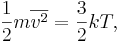
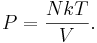
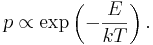

 masterok
masterok




