что дает аргинин при тренировках
Аргинин в бодибилдинге
Употреблять аргинин в бодибилдинге стали раньше комплексных аминокислот. Это свидетельствует о высокой ценности данного вещества для бодибилдеров. Оно улучшает качество питания и способность сокращаться клеток в мышечных тканях. Атлеты, принимающие аргинин, получают возможность значительно повысить производительность и эффективность тренировок. Аргинин, будучи донатором азота, стимулирует процесс вывода из организма продуктов, образуемых при распаде белковых фракций, и принимает активное участие в восстановлении клеток. За открытие вещества была вручена Нобелевская премия.
Как L-аргинин действует на организм?
Вещество принимают либо в качестве самостоятельной добавки перед тренировкой, либо в составе предтренировочного комплекса. Оно демонстрирует следующий положительный эффект на организм спортсмена:
Относительно целесообразности дополнительного приема вещества существует несколько мнений. В некоторых источниках говорится о том, что организм способен синтезировать аргинин. На фоне правильного питания и качественной тренировочной программы принимать вещество нет необходимости. Это особенно актуально для любителей.
Результаты некоторых недавних исследований показали, что анаболические свойства аргинина не слишком ярко выражены. Это не свидетельствует о неэффективности вещества, а лишь говорит о том, что оно оказывает небольшое влияние на эту аминокислоту в крови.
Поэтому, желая добиться хороших результатов от тренировок, сначала необходимо подбирать правильную диету, а уже потом работать над планом приема добавок. Синтез аргинина в организме происходит при употреблении рыбы, молочной продукции, мяса, яиц.
Как принимать аргинин
Главным ориентиром должны быть цели, которые желает достичь бодибилдер. В период набора мышечной массы рекомендуется принимать от 3 и до 9 граммов вещества в чистом виде.
Аргинин принимают:
Прием добавки в вечернее время позволяет улучшить качество сна, может быть совмещен с казеиновым протеином и осуществляется после ужина.
Нередко Л-аргинин комбинируют с другими донаторами азота, имеющими большую эффективность. Такое сочетание позволяет расширить сосуды и обеспечить хороший пампинг.
Побочные эффекты
Если принимать малые дозировки аргинина, как правило, никакого ухудшения самочувствия не наблюдается. Учащение пульса и головокружение вызывает не вещество, а кофеин, который входит с состав предтренировочных комплексов. Передозировка аргинином может привести к расстройству пищеварения и диарее. Некоторые ученые предупреждают, что употребление более 15 граммов вещества способно привести к воспалению поджелудочной железы.
Отзывы об аргинине
Большинство отзывов написаны не о самом веществе, а о комбинированном приеме аминокислоты с креатином и предтренировочными комплексами. Одни спортсмены пишут, что принимают все эти добавки, но не ощущают никаких улучшений. Другие, наоборот, отмечают довольно хороший эффект и результаты. Если тщательно проанализировать то, что пишут атлеты, становится понятно, что добавка работает лишь тогда, когда придерживаются правильной диеты и качественного плана тренировок.
Л-аргинин
Инструкция по применению
Немного фактов
Широко применяется при лечении заболеваний печени, опорно-двигательного аппарата, сердечно-сосудистой системы и почек. Благотворно влияет на функционирование ЦНС и стимулирует продукцию гормона роста. Л-аргинин входит в состав многих иммуномодуляторов, антивирусных средств, гепатопротекторов и кардиопрепаратов.
Форма выпуска
БАД выпускается в виде капсул, заключенных в кишечнорастворимую оболочку. В их состав входит 500.0 мл Л-аргинина, желатин, порошок микрокристаллической целлюлозы и пищевая добавка Е572. Продается препарат в пузырьках из затемненного стекла, в которых содержится 50 капсул.
Фармакологическая активность
Биодобавка содержит в себе алифатическую аминокислоту, которая принимает участие в транспортировке NO. Она оказывает выраженное мембранопротекторное и детоксицирующее действие на гепатоциты (клетки печени). Помимо этого, препарат обладает спектром терапевтических свойств, к которым относятся:
В случае курсового применения БАД оказывает гепатопротекторное и кардиопротекторное действие на кардиомиоциты и гепатоциты. Алифатическая аминокислота снижает вероятность развития оксидантного стресса, а также препятствует преждевременному старению кожи.
Показания к применению
Л-аргинин широко используется в ортопедической, кардиологической, дерматологической и гастроэнтерологической практике. Показаниями к приему биостимулирующих капсул являются:
Очень часто БАД применяется в терапии ортопедических заболеваний, вызванных дегенеративными изменениями в хрящевой ткани. Согласно инструкции по применению, алифатическая аминокислота может назначаться при артритах, артрозах и системном поражении соединительной ткани.
Режим дозирования
Беременность и грудное вскармливание
Беременность является противопоказанием к назначению биодобавки. Содержащиеся в ней аминокислоты повышают тонус гладкой мускулатуры, в том числе и мышц матки. Прием капсул в гестационном периоде чревато выкидышем и преждевременными родами.
Нежелательно использовать БАД во время лактации, т.к. алифатическая аминокислота выделяется с грудным молоком. Переизбыток биоактивных веществ в организме грудного ребенка увеличивает вероятность развития болезни Альцгеймера.
Совместимость с алкоголем
Содержащийся в алкоголе этанол разрушает структуру действующих веществ медпрепарата, в связи с чем снижается его фармакологическая активность.
Взаимодействие с медикаментами
Инструкция не содержит информации о значимом взаимодействии БАД с другими пероральными медикаментами.
Передозировка и побочные эффекты
Незначительное превышение дозировки крайне редко приводит к нарушениям со стороны жизненно важных органов. Согласно результатам новых клинических исследований, прием сверхдоз алифатической аминокислоты на протяжении длительного периода приводит к развитию болезни Альцгеймера.
При применении биодобавки у некоторых пациентов возникают побочные реакции, которые в большинстве случаев связаны с гиперчувствительностью к активным компонентам. К самым выраженным из них можно отнести:
Если во время лечения возникают вышеперечисленные симптомы, следует отказаться от использования БАД. Рекомендуется обратиться к врачу при обострении аллергических реакций, в частности крапивной лихорадки и эритемы.
Противопоказания
Л-аргинин не назначается при индивидуальной непереносимости алифатической аминокислоты. Также следует воздержаться от приема биодобавки при:
С осторожностью принимают капсулы при почечной недостаточности, анурии и нарушении водно-электролитного баланса.
Аналоги
Заменителями Л-аргинина могут стать БАДы и медикаменты, в которых содержится алифатическая аминокислота:
Условия отпуска и хранения
Биодобавка продается в аптеках и специализированных магазинах без письменного назначения врача. Хранятся капсулы при температуре до 30 градусов Цельсия не более 36 месяцев с момента производства.
L-аргинин с точки зрения доказательной медицины
Аминокислота L-аргинин — субстрат для синтеза оксида азота
Аргинин — условно незаменимая аминокислота, впервые выделен в 1886 г. E. Schulze и E. Steiger, а структура его установлена E. Schulze и E. Winterstein в 1897 г. Средний суточный уровень потребления L-аргинина составляет 5,4 г. Физиологическая потребность тканей и органов большинства млекопитающих в аргинине удовлетворяется его эндогенным синтезом и/или поступлением с пищей, однако для молодых особей и взрослых в условии стресса или болезни эта аминокислота становится эссенциальной. Аргинин служит необходимым предшественником для синтеза белков и многих биологически важных молекул, таких как орнитин, пролин, полиамины, креатин и агматин. Однако главная роль аргинина в организме человека — быть субстратом для синтеза оксида азота (NO) (Visek W.J., 1986; Wu G., Morris S.M. Jr., 1998; Böger R.H., 2007).
Поступивший с пищей L-аргинин всасывается в тонком кишечнике и транспортируется в печень, где основное его количество утилизируется в орнитиновом цикле. Часть L-аргинина, не метаболизировавшаяся в печени, используется как субстрат для продукции NO. Основным поставщиком эндогенного аргинина является обмен белка в организме, однако эндогенный синтез аргинина не играет важной роли в регуляции гомеостаза у здоровых взрослых людей (Wu G., Morris S.M. Jr., 1998; Böger R.H., 2007).
В физиологических условиях синтез NO из L-аргинина происходит с помощью ферментов NO-синтаз (NO-synthase — NOS), вторым продуктом реакции является L- цитруллин. NOS — единственный известный на данный момент фермент, использующий в этом процессе одновременно 5 кофакторов/простетических групп (флавинадениндинуклеотид, флавинмононуклеотид, гем, тетрагидробиоптерин и кальций/кальмодулин), являясь таким образом одним из наиболее регулируемых в природе ферментов (Bryan N.S. et al., 2009).
Существует несколько изоформ NOS, названных по типу клеток, где они были впервые выделены — нейрональная (nNOS, NOS I), эндотелиальная (eNOS, NOS III) и макрофагальная (iNOS, NOS II). еNOS и nNOS постоянно присутствуют в соответствующих клетках, то есть являются конститутивно экспрессируемыми. В сердечно- сосудистой системе еNOS в основном образуется в эндотелиоцитах, ее продукция поддерживается биохимическими стимулами, такими как ацетилхолин и брадикинин, а также в ответ на стимуляцию механорецепторов напряжением сдвига [1]. Активность eNOS напрямую коррелирует с концентрацией внутриклеточного кальция. еNOS отводится ведущая роль в обеспечении постоянного базисного уровня NO, который ассоциируют с реализацией механизмов локальной эндотелиальной цитопротекции и поддержанием сосудистого гомеостаза, физиологической регуляцией артериального давления (АД). Кроме того, еNOS выявлена и в других клетках и тканях, например в кардиомиоцитах, эритроцитах, мегакариоцитах, тромбоцитах (Гуревич М.А., Стуров Н.В., 2006; Böger R.H., 2007; Gkaliagkousi E. et al., 2007).
іNOS в сосудистой сети присутствует не только в макрофагах, но и в лимфоцитах, эндотелиальных клетках, клетках гладких мышц или фибробластах, активируясь под воздействием бактериальных эндотоксинов и воспалительных цитокинов (таких как фактор некроза опухоли- α и интерлейкины). Активация іNOS не зависит от кальция, вызывая синтез NO в высоких концентрациях (до 1000 раз выше по сравнению с еNOS). В свою очередь, nNOS синтезирует NO в физиологических количествах преимущественно в качестве трансмиттера в головном мозге и периферической нервной системе, например в неадренергических нехолинергических автономных нервных волокнах. В настоящее время также представлены доказательства конститутивной экспрессии іNOS в некоторых тканях наряду с существованием индуцибельных форм еNOS и nNOS (Böger R.H., 2007; Bryan N.S. et al., 2009; Lubos E. et al., 2009).
Физиологическая роль оксида азота
NO играет важную роль в физиологии млекопитающих, обладая широким спектром биорегуляторного действия. Молекула NO является одной из наиболее мелких известных молекул — биологических мессенджеров. Благодаря химической простоте, эффекты NO могут регулироваться исключительно его концентрацией и стабильностью. NO легко проникает сквозь мембраны клеток, не нуждаясь в каналах или рецепторах. Инициированный NO сигнальный период достаточно короткий, поскольку NO быстро окисляется с переходом в нитриты и нитраты. Вот почему биологические эффекты NO ограничены местом его образования. Мишенью для NO в большинстве случаев является гемовая часть растворимой гуанилатциклазы. NO катализирует образование циклического гуанозинмонофосфата (цГМФ), который и обусловливает большинство физиологических эффектов NO. Однако на сегодня известны и другие физиологические эффекты NO, независимые от активации гуанилатциклазы или даже NOS, включая посттрансляционную модификацию белков, липидов и других биомолекул. Другими возможными мишенями для NO являются растворимый аденозиндифосфат (АДФ)-рибозилирующий фермент и факторы транскрипции, через которые NO может непосредственно влиять на транскрипцию генов и трансляцию иРНК (Buhimschi I.A. et al., 1998; Марков Х.М., 2000; Bryan N.S. et al., 2009).
Мишени воздействия NO зависят от окружающих условий и количества производимого NO. Местный уровень NO детерминирован балансом между интенсивностью его синтеза или экзогенного образования и интенсивностью инактивации. Физиологическое действие NO варьирует от модуляции сосудистой системы до регуляции иммунных процессов (клеточно-опосредованный иммунитет, воздействие нейтрофильных гранулоцитов на патогенные микроорганизмы, неспецифическая иммунная защита) и контроля нейрональных функций (передача сигнала в неадренергических нехолинергических нейронах, синаптическая пластичность в центральной нервной системе, осцилляторная активность нейрональной сети, нейропротекция) (Степанов Ю.М. и соавт., 2004; Böger R.H., 2007; Lubos E. et al., 2009) (таблица).
Таблица. Роль NO в функционировании различных систем организма
(Степанов Ю.М. и соавт., 2004)
Функциональные системы организма
Физиологические реакции
Релаксация кровеносных сосудов мозга, сетчатки глаза, сердца, легких, почек, кишечника, кавернозной ткани, мышцы сердца
Дыхательная система, пищеварительный и урогенитальный тракты
Релаксация гладкомышечной ткани трахеи, желудка, кишечника, мочевого пузыря, матки
Центральная и периферическая нервные системы
Нейромодулирующая активность, определяющая долговременное потенцирование, формирование памяти, восприятие боли, зрительный анализ
Регуляция синтеза и секреции гормонов: инсулина, пролактина, тиреоидного гормона, паратиреоидного гормона, гормонов надпочечников, гормонов репродуктивного цикла
Регуляция взаимодействия лейкоцитов со стенками сосудов. Регуляция активности тромбоцитов
Антипатогенные реакции, неспецифическая цитотоксичность, противоопухолевая защита, патогенез токсемий, отторжение трансплантата
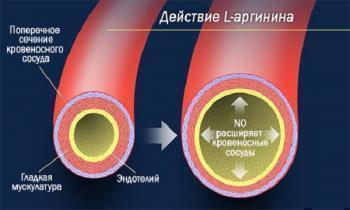
Роль NO в поддержании сосудистого гомеостаза сводится к регуляции сосудистого тонуса, пролиферации и апоптоза, а также регуляции оксидантных процессов. Кроме того, NO присущи ангиопротекторные свойства (Гуревич М.А., Стуров Н.В., 2006; Ельский В.Н. и соавт., 2008). NO также ответственен за противовоспалительные эффекты, такие как ингибирование экспрессии молекул клеточной адгезии ICAM-1 (intercellular adhesion molecules 1 — молекулы межклеточной адгезии 1-го типа), VCAM-1 (vascular cellular adhesion molecules 1 — молекулы адгезии сосудистого эндотелия 1-го типа) и тканевого фактора; ингибирование высвобождения хемокинов, таких как МСР-1 (monocyte chemoattractant protein-1 — моноцитарный хемотаксический фактор-1). Вдобавок, NO блокирует агрегацию тромбоцитов и оказывает фибринолитический эффект (Chatterjee A., Catravas J.D., 2008).
Оксид азота — мощный периферический вазодилататор
За открытие роли NO как сигнальной молекулы в сердечно-сосудистой системе R. Furchgott, L. Ignarro и F. Murad в 1998 г. была присуждена Нобелевская премия в области медицины и физиологии (Bryan N.S. et al., 2009).
Хотя внутриклеточная концентрация L- аргинина значительно выше по сравнению с плазмой крови или внеклеточной жидкостью, доказано, что внеклеточный L- аргинин может быстро захватываться эндотелиальными клетками для синтеза NO (Böger R.H., 2007). При низких концентрациях в плазме крови L-аргинин избирательно улучшает эндотелиальную функцию; при среднем уровне концентрации может оказывать прямую вазодилатацию вследствие стимуляции секреции инсулина и гормона роста; высокие уровни L- аргинина вызывают неспецифическую вазодилатацию (Yi J. et al., 2009)
Дефицит оксида азота как ключевое звено эндотелиальной дисфункции
По современным представлениям, эндотелий — не просто полупроницаемая мембрана, выстилающая внутреннюю поверхность сердца и сосудов, а диффузно рассеянный по всем тканям активный эндокринный орган, самый большой в организме (в теле человека средней массы тела содержится около одного триллиона эндотелиоцитов — 1,8 кг), способный к непрерывной продукции биологически активных веществ. Одной из основных функций эндотелия является сбалансированное выделение регуляторных субстанций, определяющих целостную работу системы кровообращения. Эти вещества играют важную роль в организме, отвечая за регуляцию тонуса сосудов (секреция вазоактивных медиаторов), поддержание их анатомического строения (синтез и ингибирование факторов пролиферации), сохранение гемостаза (синтез и ингибирование факторов фибринолиза и агрегации тромбоцитов); участвуют в процессах местного воспаления (выработка про- и противовоспалительных факторов). Основными факторами, активизирующими эндотелиальные клетки, являются механическое воздействие протекающей крови и напряжение сосудистой стенки; тромбоцитарные факторы (серотонин, АДФ, тромбин); циркулирующие и/или «внутристеночные» нейрогормоны (катехоламины, вазопрессин, ацетилхолин, эндотелин, брадикинин, ангиотензин II, аденозин, гистамин); гипоксия. В норме в ответ на стимуляцию эндотелий реагирует усилением синтеза веществ, вызывающих расслабление гладкомышечных клеток сосудистой стенки. Для нормально функционирующего эндотелия характерно сбалансированное образование сосудосуживающих (эндотелин-1, тромбоксан А2, простагландин Н2) и сосудорасширяющих (NO, эндотелиальный фактор гиперполяризации, простациклин, натрийуретический пептид С-типа и др.) субстанций (Белоусов Ю.Б., Намсараев Ж.Н., 2004; Gornik H.L., Creager M.A., 2004; Головченко Ю.И., Трещинская М.А., 2008; Ельский В.Н. и соавт., 2008).
Наиболее выраженной сосудорасширяющей способностью обладает NO. NO как эндотелиальный фактор расслабления был открыт в 1980 г. — R.F. Furchgott и J.V. Zavadzki показали, что действие большинства веществ, влияющих на тонус сосудов, опосредуется выделением NO из эндотелия. NO присутствует во всех эндотелиальных клетках независимо от размера и функции сосудов. В нормально функционирующем эндотелии низкие уровни NO постоянно высвобождаются для поддержания кровеносных сосудов в состоянии дилатации и обеспечения неадгезивности эндотелия по отношению к форменным элементам крови. При воздействии различных повреждающих факторов (механических, инфекционных, обменных, иммуннокомплексных и т.п.) способность эндотелиальных клеток освобождать релаксирующие факторы уменьшается, тогда как образование сосудосуживающих факторов сохраняется или увеличивается, то есть формируется состояние, определяемое как эндотелиальная дисфункция (ЭД) (Белоусов Ю.Б., Намсараев Ж.Н., 2004; Gornik H.L., Creager M.A., 2004; Головченко Ю.И., Трещинская М.А., 2008; Ельский В.Н. и соавт., 2008).
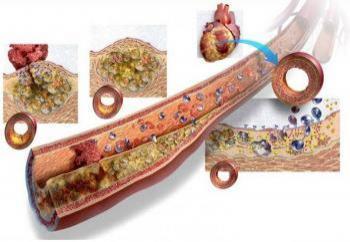
В развитии и прогрессировании заболеваний сосудов ключевым моментом является регуляция NOS и биодоступность субстратов или кофакторов (Chatterjee A., Catravas J.D., 2008). Местная доступность L- аргинина в качестве субстрата для NOS может быть снижена вследствие активности аргиназы, утилизирущей L- аргинин для производства мочевины и орнитина и таким образом конкурирующей с NOS за доступность субстрата. Различные исследования свидетельствуют, что индукция или активация аргиназы І или аргиназы ІІ ведет к нарушению продукции NO и, как следствие, к ЭД. Аккумуляция при различных патологических состояниях эндогенного ингибитора NOS асимметричного диметиларгинина (asymmetric dimethylarginine — ADMA) также нарушает образование NO. Установлена связь между повышенным уровнем ADMA и сердечно- сосудистыми заболеваниями (ССЗ). Повышенный уровень ADMA наблюдается у пациентов с гиперхолестеринемией, гипертриглицеридемией; резистентностью к инсулину, сахарным диабетом (СД) 2-го типа, почечной недостаточностью и кардиальным синдромом Х (Gornik H.L., Creager M.A., 2004; Böger R.H., 2007).
Патогенетическая роль дефицита оксида азота
Нарушение синтеза или функционирования NO в сосудистой системе — важный патогенетический фактор таких заболеваний, как артериальная гипертензия (АГ), атеросклероз и диабетическая ангиопатия (Böger R.H., 2007). Осложнениями, связанными с дефицитом этого соединения, также являются острый инфаркт миокарда (ИМ), нестабильная стенокардия, атеротромбоз, тромботическая микроангиопатия, тромбоэмболические цереброваскулярные заболевания, преэклампсия (Гуревич М.А., Стуров Н.В., 2006).
ЭД рассматривается в настоящее время в качестве основного механизма формирования АГ. У больных с АГ нарушение NO-зависимого расслабления артерий может быть обусловлено несколькими механизмами: снижением продукции NO, ускоренной его деградацией и изменением цитоархитектоники сосудов. Наибольшее значение в снижении ЭЗВД придают внутриклеточному оксидативному стрессу — свободнорадикальное окисление резко снижает продукцию NO эндотелиоцитами. Высокий риск возникновения церебральных осложнений у больных с АГ связывают именно с формированием ЭД, препятствующей адекватной регуляции мозгового кровотока. Нарушение ауторегуляции церебральной перфузии является предиктором развития энцефалопатии и транзиторных ишемических атак (ТИА) (Визир. В.А., Березин А.Е., 2000). У больных в острый период церебрального ишемического инсульта (ЦИИ) происходит снижение уровня NO2 — стабильного метаболита NO, что свидетельствует об участии эндотелийзависимых механизмов в патогенезе ЦИИ. Нарушение сосудодвигательной функции эндотелия прогрессирует при повышении клинической тяжести состояния больных ЦИИ (Малахов В.А., Завгородняя А.Н., 2007).
У пациентов с ишемической болезнью сердца (ИБС) одной из главных причин уменьшения ЭЗВД является гиперхолестеринемия, поскольку ускоряет апоптоз эндотелиоцитов и снижает синтез NO в эндотелии (Мовчан Е.А., 2008).
NO контролирует разнообразные легочные функции, такие как активность макрофагов, бронхоконстрикцию и дилатацию легочных артерий. У пациентов с легочной гипертензией (ЛГ) наблюдается снижение уровня NO в легких. Одна из причин этого состояния — нарушение метаболизма L-аргинина. Так, у пациентов с артериальной ЛГ отмечают ассоциацию снижения уровня L-аргинина с повышением активности аргиназы. Также нарушенный метаболизм ADMA в легких может инициировать, стимулировать или поддерживать течение хронических заболеваний легких, в том числе артериальной ЛГ. Повышенный уровень ADMA отмечается у пациентов с идиопатической артериальной ЛГ, хронической тромбоэмболической ЛГ, а также артериальной ЛГ, ассоциированной с серповидноклеточной анемией или системным склерозом (Maarsingh Н. et al., 2008; Zakrzewicz D., Eickelberg O., 2009).
В связи с наличием огромного пула эндотелиальных клеток в капиллярах клубочков от функционального состояния эндотелия существенно зависит регуляция сосудистого тонуса в почках. Роль эндотелия в регуляции сосудистого тонуса и почечной гемодинамики опосредована взаимодействием продуцируемых им мощных вазоактивных факторов. Перераспределение равновесия вазоактивных факторов в пользу вазоконстрикторов не только инициирует развитие нефросклероза, снижение скорости клубочковой фильтрации и почечного кровотока, но и провоцирует развитие АГ (Мовчан Е.А., 2008).
В клинической патофизиологии почек NO имеет особое значение. Имеются данные о постоянном синтезе NO в эндотелиальных и гладкомышечных клетках почечных сосудов, мезангиальных и эпителиальных канальцевых клетках, благодаря чему он играет важную роль в регуляции почечного кровотока, экскреторной функции почек, тубулогломерулярного баланса. Эти эффекты частично осуществляются путем взаимодействия NO с ренин-ангиотензиновой системой и другими биорегуляторами функций почек. Снижение продукции и функции NO, в частности в сосудистом эндотелии, тесно связано с патогенезом уменьшения почечной ткани вследствие поражения почек. Механизмы возникновения дефицита различны, включая уменьшение синтеза NO вследствие снижения концентрации или активности почечной кортикальной nNOSα, а также снижения уровня активных димеров еNOS вследствие деградации кофактора еNOS тетрагидробиоптерина; повышение циркулирующего количества ADMA (уровень ADMA в плазме крови коррелирует с тяжестью хронической болезни почек); ограничение доступности субстрата (L-аргинина) вследствие снижения его синтеза в почках или нарушения транспорта в клетку; нарушения почечной тубулярной регенерации аргинина; утилизация аргинина аргиназой; инактивация NO активными формами кислорода (reactive oxygen species — ROS). Кроме того, накопление конечных продуктов гликозилирования при прогрессировании болезней почек снижает доступ NO к его мишеням (Марков Х.М., 2000; Baylis C., 2008; Ohkita М. et al., 2009).
Физиологическая сосудистая адаптация к беременности (увеличение объема крови, минутного объема сердца и снижение сосудистой резистентности) сопровождается увеличением эндогенной продукции NO и повышением чувствительности к NO гладкомышечных клеток сосудов. Экспериментальные исследования показали роль усиления оксидативного стресса и снижения биодоступности таких вазодилататоров как NO в патогенезе сердечно-сосудистой дисфункции в период беременности; при преэклампсии в исследованиях in vitro установлено нарушение ЭЗВД изолированных пупочных артерий. При преэклампсии также отмечается повышенная концентрация в крови гемоглобина, который рассматривается как акцептор NO (Buhimschi I.A. et al., 1998; Gilbert J.S. et al., 2008).
Современные исследования эффективности аргинина как донатора оксида азота