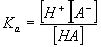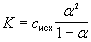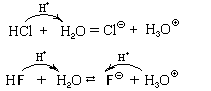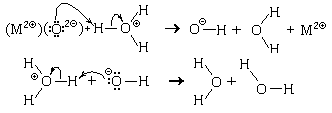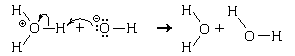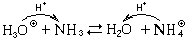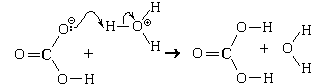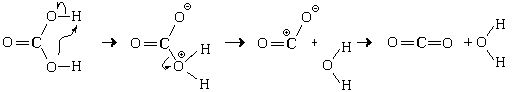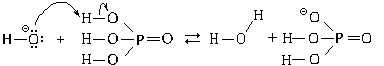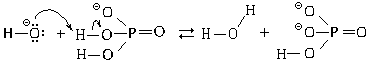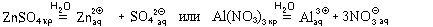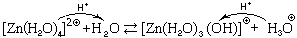чем слабее сопряженное основание тем сильнее кислота
Чем слабее сопряженное основание тем сильнее кислота
Теоретические представления в органической химии
Кислоты и основания
Йоханес Бренстед и Томас Лоури (1923) сформулировали общую протолитическую теорию кислот и оснований. Они сформулировали определения:
Кислота есть молекула или ион, способные отдавать протон.
Основание есть молекула или ион, способные присоединять протон. Основание – акцептор протонов.
Кислота, отдавая протон, превращается в сопряженное основание. Основание, присоединяя протон, превращается в сопряженную кислоту. Эти пары частиц называют сопряженными кислотно-основными парами. Чем сильнее кислота, тем слабее сопряженное основание и наоборот.
Существуют амфолиты – молекулы или ионы, способные как отдавать, так и присоединять протон, и, следовательно, проявляют свойства кислот и оснований (вода, аминокислоты).
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон между основаниями взаимодействующих сопряженных кислотно-основных пар. Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты.
Протолитическое равновесие наблюдается при ионизации слабых электролитов в воде. Анион слабой кислоты и вода, как слабое основание, конкурируют за протон. Это – обратимый процесс и он характеризуется константой равновесия Ка :
Константу кислотности Ка часто заменяют показателем кислотности рКа , равным отрицательному десятичному логарифму константы кислотности. Значение рКа равно значению рН водного раствора.
Чем меньше рКа, тем больше кислотность соединения.
Кислотность органических соединений колеблется в очень широких пределах рКа: от 40 для углеводородов, до 0,2 трифторуксусной кислоты (как у сильных минеральных кислот).
Самыми сильными органическими основаниями являются алифатические амины, имеющие рКа для сопряженной кислоты (RNH3 + ), равным »10.
Более общее определение кислот и оснований предложено Гилбертом Ньютоном Льюисом. Кислота – это акцептор электронных пар для дополнения своей электронной оболочки. Основания Льюиса – доноры электронных пар (анионы или нейтральные молекулы). Свойства кислот Льюиса проявляют различные частицы: протон, ионы соли металлов (Al, Fe, Zn, Sn,…), имеющих вакантные d-орбитали низкой энергии и др.
Кислотность некоторых органических соединений в воде.
Чем слабее сопряженное основание тем сильнее кислота
При смешении серной и уксусной кислот последняя играет роль основания. Образующаяся протонированная уксусная кислота и бисульфат-анион соответственно являются сопряженными кислотой и основанием:
то есть, по Бренстеду-Лоури, кислотно-основное взаимодействие рассматривается как процесс передачи протона. Приведенные примеры показывают, что не может быть абсолютного деления веществ на кислоты и основания. Такое деление носит относительный характер. Вещества, потенциально способные быть кислотами, становятся таковыми только в присутствии основания, и наоборот.
При растворении в воде оснований В вода выполняет роль кислоты. В результате переноса протона от воды к основанию образуются сопряженная кислота HB+ и сопряженное основание OH- :
В рассмотренных примерах кислотно-основных взаимодействий образуются сопряженные кислотно-основные пары. Между силой кислоты и сопряженного с ней основания существует следующая зависимость: чем слабее кислота, тем больше сила сопряженного с ней основания, и наоборот. Так, вода как слабая кислота и слабое основание, теряя или присоединяя протон, превращается в сопряженное сильное основание (ОН-) или сопряженную сильную кислоту (Н3О+). Кислотно-основные равновесия смещены в направлении образования более слабой кислоты и более слабого основания. Поэтому в схеме автопротолиза воды равновесие практически полностью смещено в сторону неионизированной формы. Если расположить кислоты в порядке уменьшения их силы, то сила соответствующих (сопряженных) оснований будет изменяться в обратном порядке:
сила кислот: H2SO4 > H3O+> > H2O,
Рассмотрим несколько примеров, как структура (природа радикала у кислотного центра) влияет на кислотность органических соединений. Известно, что в ряду ОН-кислот кислотные свойства убывают в следующем порядке: карбоновые кислоты > фенолы > спирты. В этом ряду радикалами у кислотных центров соответственно являются ацил с ярко выраженным акцепторным характером, арил, относящийся к акцепторным заместителям, но уступающий ацилам, и алкил, характеризующийся хотя и слабым, но электронодонорным эффектом. Указанные радикалы до разрыва связи О-Н будут различным образом влиять на ее поляризацию: чем выше акцепторность радикала, тем выше полярность связи (статический фактор). Однако более существенное влияние заместителей будет проявляться после разрыва О-Н-связи: чем выше степень делокализации заряда аниона, тем выше его устойчивость (динамический фактор). А чем стабильнее частица (в нашем случае кислородцентрированный анион), тем ниже энергетические барьеры на пути ее образования. В рассматриваемых примерах устойчивость анионов будет уменьшаться в следующем порядке: ацилат-анион > феноксид-анион > алкоксид-анион:
В первом случае делокализация заряда достигается за счет его распределения между двумя эквивалентными атомами кислорода. В феноксид-анионе делокализация заряда достигается за счет сопряжения электронных пар атома кислорода с p-системой ароматического ядра, в результате чего часть электронной плотности с атома кислорода переносится на ароматическое ядро (отрицательный заряд на атоме кислорода снижается). Высокая степень локализации заряда на атоме кислорода в алкоксид-анионе делает его наименее стабильным и соответственно наиболее трудно образующимся.
Легко понять, что введение в радикал у кислотного центра электроноакцепторных заместителей будет способствовать повышению кислотности всех типов кислот. Особенно резкое повышение кислотности СН-кислот наступает в случае, если введение такого заместителя придает соединению возможность существовать в нескольких таутомерных формах. Сравните кислотность двух СН-кислот: хлороформа и нитрометана (см. табл. 1). Из таблицы видно, что кислотность последнего почти на пять порядков выше. Столь значительная разница в кислотности двух указанных соединений обусловлена тем, что нитрометан может существовать в двух таутомерных формах с общим мезомерным анионом.
Аналогичный подход можно использовать для объяснения подвижности a-водородных атомов в карбонильных соединениях.
Чем слабее сопряженное основание тем сильнее кислота
5. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время для оценки кислотности и основности соединений, в том числе и органических, применяют две теории: теория Бренстеда и теория Льюиса. Теория Бренстеда (1923 г.) является протолитической или протонной теорией кислот и оснований, а теория Льюиса (1925 г.) – апротонной или электронной теорией кислот и оснований.
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Согласно теории Бренстеда, кислотой называют соединение, способное отдавать протон, т. е. кислота – донор протона, а основание – соединение, способное присоединять протон, т. е. основание является акцептором протона.
Теория Бренстеда называется протонной или протолитической теорией кислот и оснований, так как определения кислота и основание взаимосвязаны между собой процессом присоединения и отщепления протона.
Кислотно-основный процесс, согласно теории Бренстеда, может быть представлен следующей схемой:
Кислота А–Н, теряя протон, превращается при этом в основание АӨ, которое называется сопряженным основанием данной кислоты. Основание же В, присоединяя протон за счет неподеленной пары электронов, превращается в кислоту ВН+, которая является сопряженной данному основанию.
Таким образом, кислота А–Н и сопряженное основание АӨ, основание В и сопряженная кислота ВН+ образуют две сопряженные кислотно-основные пары.
Кислотность и основность соединений – понятия относительные. Эти два свойства неразрывно связаны между собой и проявляются одновременно, т. е. если одно соединение в данной реакции выступает в роли кислоты, то другое обязательно – в роли основания. Определенное соединение может быть кислотой по отношению к одному веществу и основанием по отношению к другому. Относительность этих понятии становится очевидной при рассмотрении конкретного примера.
Уксусная кислота, которая в воде проявляет кислотные свойства, в безводной серной кислоте ведет себя как основание.
Количественно силу кислот и оснований можно выразить с помощью константы равновесия данной реакции. Величину константы равновесия чаше всего определяют в водной среде. Для реакции:
Учитывая то, что вода в данной реакции выступает в роли растворителя, т. е. концентрация ее практически не изменяется (55,6 моль·л-1), концентрацией воды можно пренебречь. В данном случае константу равновесия называют константой кислотности или константой диссоциации К и выражают формулой:
Любая протолитическая реакция обратима и характеризуется константой диссоциации.
Большинство органических соединений, проявляющих кислотные свойства, в водной среде являются слабыми кислотами, константы которых выражаются малыми величинами. Например, Кa уксусной кислоты при 25°С равна 1,76·10-5. Оперировать такими малыми величинами в практической работе не удобно, поэтому используют значения рКa – показатель константы – отрицательный логарифм константы диссоциации: рКa = – lgKa (например: рКa для СН3СООН равняется 4,75).
Рассматривая зависимость между значениями величин Кa, рКa и силой кислоты, следует отметить одну закономерность: чем больше величина Кa (константа кислотности), тем сильнее кислота, чем больше величина рКa, тем кислота слабее.
Подобно кислотам силу оснований иногда выражают величиной Кb (константа основности), характеризующей легкость, с которой основание отрывает протон от воды:
Для удобства пользуются величиной рКb
При этом, чем меньше рКb, тем сильнее соответствующее основание. Однако намного удобнее выражать степень ионизации кислот и оснований в одной шкале (в шкале рКb) подобно тому, как значение рН одинаково хорошо характеризует и кислотность, и основность. Для основания величина рКa обычно означает кислотность сопряженной кислоты – протонной формы основания рК+вн. Сопряженная кислота в виде R–NH3 отдавая протон, превращается в основание R–NH4+.
Типы органических кислот
В зависимости от природы элемента, который связан с атомом водорода, кислоты разделяют на четыре основные группы:
Наряду с указанными типами кислот известны кислоты: Si-H, Р–Н, As–H, т. е. кислотой может быть любое соединение, содержащее связь А–Н и способное к отщеплению протона. Теория Бренстеда применима к любым типам кислот, способным к диссоциации с разрывом связи элемент–водород.
Кислотность соединений в основном определяется устойчивостью образующегося аниона, которая обусловлена делокализацией (распределением) отрицательного заряда.
Чем устойчивее сопряженное основание, тем сильнее кислота. Устойчивость аниона определяется следующими факторами: природой атома, связанного с атомом водорода (реакционный и кислотный центр); электронодонорными или электроноакцепторными свойствами заместителя, связанного с реакционным центром, и природой растворителя.
При равных других факторах устойчивость анионов, а следовательно, и кислотность возрастают с увеличением электроотрицательности и поляризуемости атомов кислотного центра. С увеличением электроотрицательности увеличивается сила, с которой атом может удержать пару электронов после отщепления водорода. Поскольку в пределах периода периодической системы электроотрицательность атомов возрастает слева направо (поляризуемость не меняется), то ОН-кислоты сильнее соответствующих NH-кислот, а те, в свою очередь, сильнее СН-кислот, например:
В пределах группы периодической системы электроотрицательность атомов уменьшается сверху вниз, но увеличивается их объем, а следовательно, возрастает поляризуемость, т. е. возможность делокализации внешнего электронного облака. Это способствует повышению стабильности аниона и приводит к возрастанию кислотности. Поэтому SH-кислоты обладают большей кислотностью, чем ОН-кислоты, например:
Наряду с природой кислотного центра и строением радикала, значительное влияние на проявление кислотных свойств оказывает растворитель. Наиболее эффективным растворителем является вода, она имеет высокую диэлектрическую постоянную и способна связывать катионы и анионы за счет сольватации. Эффект сольватации приводит к устойчивости образовавшегося аниона, а следовательно, кислотность соединений возрастает.
Типы органических оснований
Согласно теории Бренстеда, любое соединение, способное присоединять протон, может выступать в роли основания; это могут быть как нейтральные молекулы, так и заряженные частицы. В нейтральных молекулах для проявления основных свойств необходимо наличие атома с неподеленной парой электронов или наличие кратной связи. Основаниями могут быть анионы: алкоксид-ион ROӨ; алкилмеркаптид-ион RSӨ, карбанион R3CӨ (триалкилметанид-ион) и другие.
В n-основаниях центром основности, или центром протонирования (местом присоединения протона), чаше всего выступают такие элементы, как азот, кислород, сера. В зависимости от центра основности ониевые основания делятся на три основные группы:
Основность органических соединений в основном определяется устойчивостью образовавшегося катиона, которая обусловлена делокализацией положительного заряда.
На основность значительное влияние оказывает электроотрицательность и поляризуемость элементов, составляющих центр основности, электронодонорное или электроноакцепторное влияние радикала, связанного с центром основности, и природа растворителя.
Большая электроотрицательность атомов основного центра способствует более прочному удержанию им неподеленнои электронной пары, что характеризует меньшую основность соединения, иначе говоря. чем больше электроотрицательность атома, тем меньше основность. Таким образом, аммониевые основания проявляют более сильные основные свойства по сравнению с оксониевыми. Увеличение же поляризуемости атома приводит к уменьшению основности сопряженного основания и увеличению кислотности сопряженной кислоты. Поэтому сульфониевые основания слабее оксониевых.
Существенную роль в проявлении основных свойств играет растворитель. Эффект сольватации способствует устойчивости образовавшегося катиона, а следовательно, приводит к повышению основности.
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
Теория кислот и оснований Льюиса, в отличие от теории Бренстеда, является более обшей. Согласно этой теории основанием считается любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислотой – любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота – акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг соединений.
Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса, например, являются такие соединения, как BF4, AlC13, FeCl3, SbCl3, ZnCl2, HgCl3 и др.
Кислотно-основный процесс по Льюису состоит в образовании ковалентнои связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так, основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса n-комплексы:
Легкость протекания кислотно-основного взаимодействия по Льюису определяется силой кислоты и основания.
Чем слабее сопряженное основание тем сильнее кислота
12.4. Сила кислот и оснований
Направление смещения кислотно-основного равновесия определятся следующим правилом:
Кислотно-основные равновесия смещены в сторону более слабой кислоты и более слабого основания.
Кислота тем сильнее, чем легче она отдает протон, а основание тем сильнее, чем легче оно принимает протон и прочнее его удерживает. Молекула (или ион) слабой кислоты не склонна отдавать протон, а молекула (или ион) слабого основания не склонна его принимать, этим и объясняется смещение равновесия в их сторону. Силу кислот, а также силу оснований можно сравнивать только в одном и том же растворителе
Так как кислоты могут реагировать с разными основаниями, то соответствующие равновесия будут смещены в ту или иную сторону в разной степени. Поэтому для сравнения силы разных кислот определяют, насколько легко эти кислоты отдают протоны молекулам растворителя. Аналогично определяется и сила оснований.
Сила кислоты – характеристика кислоты, показывающая, насколько легко кислота отдает протоны молекулам данного растворителя.
Сила основания – характеристика основания, показывающая, насколько прочно основание связывает протоны, оторванные от молекул данного растворителя.
Вы уже знаете, что молекула воды (растворителя) может и принимать, и отдавать протон, то есть проявляет и свойства кислоты, и свойства основания. Поэтому и кислоты, и основания можно сравнивать между собой по силе в водных растворах. В одном и том же растворителе сила кислоты в значительной степени зависит от энергии рвущейся связи А—Н, а сила основания – от энергии образующейся связи В—Н.
Для количественной характеристики силы кислоты в водных растворах можно использовать константу кислотно-основного равновесия обратимой реакции данной кислоты с водой:
HА + Н2О 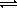


Для характеристики силы кислоты в разбавленных растворах, в которых концентрация воды практически постоянна, пользуются константой кислотности:
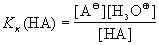
Совершенно аналогично для количественной характеристики силы основания можно использовать константу кислотно-основного равновесия обратимой реакции данного основания с водой:
А 
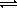

а в разбавленных растворах – константу основности
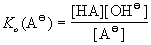
Практически для оценки силы основания используют константу кислотности кислоты, получающейся из данного основания (так называемой » сопряженной « кислоты), так как эти константы связаны простым соотношением
Ко(А 
Иными словами, основание тем сильнее, чем слабее сопряженная кислота. И наоборот, кислота тем сильнее, чем слабее сопряженное основание.
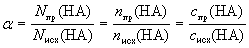
Здесь величина с индексом » пр» (в числителе) характеризует прореагировавшую часть молекул кислоты НА, а величина с индексом » исх» (в знаменателе) – исходную порцию кислоты.
В соответствии с уравнением реакции
nпр(HA) = n(H3O 

cпр(HA) = c(H3O


[H3O 

[HA] = (1 – a ) · сисх(НА).
Подставив эти выражения в уравнение константы кислотности, получим
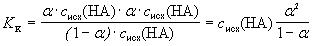
Таким образом, зная константу кислотности и общую концентрацию кислоты, можно определить степень протолиза этой кислоты в данном растворе. Аналогично через степень протолиза можно выразить и константу основности основания, поэтому в общем виде
Это уравнение представляет собой математическое выражение закона разбавления Оствальда. Если растворы разбавленные, то есть исходная концентрация не превышает 0,01 моль/л, то можно использовать приближенное соотношение
Для грубой оценки степени протолиза это уравнение можно использовать и при концентрациях до 0,1 моль/л.
Кислотно-основные реакции – процессы обратимые, но не всегда. Рассмотрим поведение в воде молекул хлороводорода и фтороводорода:
Сильная кислота – кислота, реагирующая с избытком воды необратимо.
Слабая кислота – кислота, реагирующая с избытком воды обратимо и, как правило, незначительно.
Сильные кислоты: HCl, HBr, HI, HClO4, HClO3, H2SO4, H2SeO4, HNO3 и некоторые другие.
Теперь обратим внимание на правые части уравнений реакций с водой хлороводорода и фтороводорода. Фторид-ион может принимать протон (отрывая его у иона оксония) и превращаться в молекулу фтороводорода, а хлорид-ион не может. Следовательно, фторид-ион проявляет свойства основания, а хлорид-ион таких свойств не проявляет (но только в разбавленных растворах).
Как и кислоты, существуют сильные и слабые основания.
Сильное основание – основание, реагирующее с избытком воды необратимо.
Слабое основание – основание, реагирующее с избытком воды обратимо и, как правило, незначительно.
К сильным веществам-основаниям относятся все хорошо растворимые ионные гидроксиды (их называют еще » щелочами « ), так как при их растворении в воде гидроксид-ионы полностью переходят в раствор.
К слабым основаниям относится NH3 (КО = 1,74· 10 –5 ) и некоторые другие вещества. К ним же относятся и практически нерастворимые гидроксиды элементов, образующих металлы, (» гидроксиды металлов» ) потому, что при взаимодействии этих веществ с водой в раствор переходит лишь ничтожное количество гидроксид-ионов.
Слабые основания-частицы (их еще называют » анионные основания» ): F 





Не обладают основными свойствами анионы Cl 




Не обладают кислотными свойствами катионы Li 




Кроме частиц-кислот и частиц-оснований, существуют еще частицы, проявляющие и кислотные, и основные свойства. Такие свойства молекулы воды вам уже известны. Кроме воды, это гидросульфит-ион, гидросульфид-ион и другие аналогичные ионы. Например, HSO3 
HSO3 


HSO3 

Подобные частицы называются амфолитами.
Амфолит – частица, способная как отдавать протон молекуле растворителя, так и принимать протон от молекулы растворителя.
Кислые соли – соли, в состав которых входят анионы, способные отдавать протон.
Примеры кислых солей и их названий:
KHS – гидросульфид калия,
NaHSO4 – гидросульфат натрия,
LiHSO3 – гидросульфит лития,
Ca(HCO3)2 – гидрокарбонат кальция,
KH2PO4 – дигидрофосфат калия,
Na2HPO4 – гидрофосфат натрия.
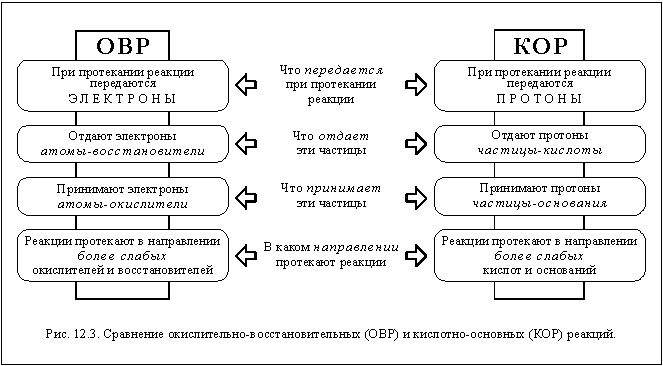
Как вы уже, наверное, заметили, у кислотно-основных и окислительно-восстановительных реакций есть много общего. Проследить общие черты и найти отличия этих типов реакций вам поможет схема, изображенная на рисунке 12.3.


2.Сравните энергию атомизации молекул HF и HCl. Согласуются ли эти данные с силой плавиковой и соляной кислот?
3.Какая частица является более сильной кислотой: а) молекула угольной кислоты или гидрокарбонат-ион, б) молекула фосфорной кислоты, дигидрофосфат-ион или гидрофосфат-ион, в) молекула сероводорода или гидросульфид-ион?
4.Почему в приложении 13 вы не найдете константы кислотности серной, соляной, азотной и некоторых других кислот?
5.Докажите справедливость соотношения, связывающего константу основности и константу кислотности сопряженных кислоты и основания.
6.Запишите уравнения реакций с водой а) бромоводорода и азотистой кислоты, б) серной и сернистой кислот, в) азотной кислоты и сероводорода. В чем отличия этих процессов?
7.Для следующих амфолитов: HS 




8.Какие процессы могут происходить при растворении в воде фосфорной кислоты? 
а) Реакции ионов оксония с оксид-ионами
В этих реакциях оксид-ион не успевает перейти в раствор, а сразу реагирует с ионом оксония. Следовательно, реакция протекает на поверхности оксида. Такие реакции идут до конца, так как из сильной кислоты и сильного основания образуется очень слабый амфолит (вода).
Пример. Реакция азотной кислоты с оксидом магния:
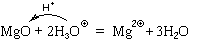
MgO + 2HNO3p = Mg(NO3)2p + H2O.
б) Реакции ионов оксония с гидроксид-ионами
Из всех частиц-оснований, существующих в водных растворах, гидроксид-ион является самым сильным основанием. Его константа основности (55,5) во много раз превышает константы основности остальных частиц-оснований. Гидроксид-ионы входят в состав щелочей и при их растворении переходят в раствор. Механизм реакции ионов оксония с гидроксид-ионами:
.
Пример 1. Реакция соляной кислоты с раствором гидроксида натрия:
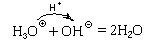
HClp + NaOHp = NaClp + H2O.
Но если в воду добавить вещество-кислоту или вещество-основание, то в растворе появится избыток одного из этих ионов. Раствор станет кислым или щелочным.
Гидроксид-ионы входят в состав не только щелочей, но и практически нерастворимых оснований, а также амфотерных гидроксидов (амфотерные гидроксиды в этом отношении можно рассматривать как ионные соединения). Со всеми этими веществами ионы оксония также реагируют, причем, как и в случае основных оксидов, реакция протекает на поверхности твердого вещества. Механизм реакции для гидроксида состава M(OH)2:
.
Cu(OH)2 + 2H3O 

Cu(OH)2 + H2SO4р = CuSO4 + 2H2O.
в) Реакции ионов оксония со слабыми основаниями
Как и в растворах щелочей, в растворах слабых оснований также присутствуют гидроксид-ионы, но их концентрация во много раз меньше, чем концентрация самих частиц-оснований (это отношение равно степени протолиза основания). Поэтому скорость реакции нейтрализации гидроксид-ионов во много раз меньше, чем скорость реакции нейтрализации самих частиц-оснований. Следовательно, преобладающей будет реакция между ионами оксония и частицами-основаниями.
Пример 1. Реакция нейтрализации соляной кислоты раствором аммиака:
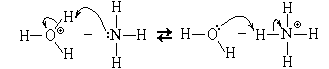
Но равновесие в ней очень сильно сдвинуто вправо (в сторону продуктов реакции), настолько сильно, что обратимостью часто пренебрегают, записывая молекулярное уравнение этой реакции со знаком равенства:
Пример 2. Реакция бромоводородной кислоты с раствором гидрокарбоната натрия. Будучи амфолитом, гидрокарбонат-ион в присутствии ионов оксония ведет себя как слабое основание:
Образующаяся угольная кислота может содержаться в водных растворах лишь в очень небольших концентрациях. При увеличении концентрации она разлагается. Механизм разложения можно представить себе следующим образом:
Суммарные химические уравнения:
H3O 

HBrр + NaHCO3р = NaBrр + CO2 + H2O.
Пример 3. Реакции, протекающие при сливании растворов хлорной кислоты и карбоната калия. Карбонат-ион тоже слабое основание, хотя и более сильное, чем гидрокарбонат-ион. Реакции между этими ионами и ионом оксония полностью аналогичны. В зависимости от условий проведения, реакция может остановиться на стадии образования гидрокарбонат-иона, а может привести и к образованию углекислого газа:
а) H3O 


HClO4р + K2CO3р = KClO4р + KHCO3р;
б) 2H3O 

2HClO4р + K2CO3р = 2KClO4р + CO2 + H2O.
Аналогичные реакции протекают даже в том случае, когда соли, содержащие частицы-основания, нерастворимы в воде. Как и в случае основных оксидов или нерастворимых оснований, в этом случае реакция тоже протекает на поверхности нерастворимой соли.
Пример 4. Реакция между соляной кислотой и карбонатом кальция:
CaCO3 + 2H3O 

CaCO3р + 2HClр = CaCl2р + CO2 + H2O.
Препятствием к проведению таких реакций может послужить образование нерастворимой соли, слой которой будет затруднять проникновение ионов оксония к поверхности реагента (например, в случае взаимодействия карбоната кальция с серной кислотой).




2.С какими из следующих оксидов будут реагировать ионы оксония: CaO, CO, ZnO, SO2, B2O3, La2O3? Составьте ионные уравнения этих реакций.
3.С какими из следующих гидроксидов будут реагировать ионы оксония: Mg(OH)2, B(OH)3, Te(OH)6, Al(OH)3? Составьте ионные уравнения этих реакций.
4.Составьте ионные и молекулярные уравнения реакций бромоводородной кислоты с растворами следующих веществ: Na2CO3, K2SO3, Na2SiO3, KHCO3.
5.Составьте ионные и молекулярные уравнения реакций раствора азотной кислоты со следующими веществами: Cr(OH)3, MgCO3, PbO.

В отличии от растворов сильных кислот в растворах слабых кислот в качестве частиц-кислот присутствуют не только ионы оксония, но и молекулы самой кислоты, причем молекул кислоты во много раз больше, чем ионов оксония. Поэтому в этих растворах преобладающей реакцией будет реакция самих частиц-кислот с частицами-основаниями, а не реакции ионов оксония. Скорость реакций с участием слабых кислот всегда меньше скорости аналогичных реакций с участием сильных кислот. Часть этих реакций обратима, и тем больше, чем слабее участвующая в реакции кислота.
а) Реакции слабых кислот с оксид-ионами
Это единственная группа реакций слабых кислот, которые протекают необратимо. Скорость реакции зависит от силы кислоты. Некоторые слабые кислоты (сероводородная, угольная и др.) в реакции с малоактивными основными и амфотерными оксидами (CuO, FeO, Fe2O3, Al3O3, ZnO, Cr2O3 и др.) не вступают.
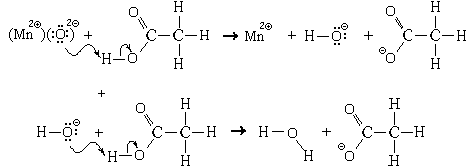
Пример. Реакция, протекающая между оксидом марганца(II) и раствором уксусной кислоты. Механизм этой реакции:
Уравнения реакции:
MnO + 2CH3COOH = Mn 2 
+ H2O
MnO + 2CH3COOHр = Mn(CH3COO)2р + H2O.(Соли уксусной кислоты называются ацетатами)
б) Реакции слабых кислот с гидроксид-ионами
В качестве примера рассмотрим, как реагируют с гидроксид-ионами молекулы фосфорной (ортофосфорной) кислоты:
В результате реакции получаются молекулы воды и дигидрофосфат-ионы.
Если после завершения этой реакции в растворе остаются гидроксид-ионы, то дигидрофосфат-ионы, являясь амфолитами, будут с ними реагировать:
Образуются гидрофосфат-ионы, которые, также являясь амфолитами, могут реагировать с избытком гидроксид-ионов:
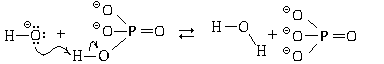
Ионные уравнения этих реакций
H3PO4 + OH 

H2PO4 


HPO4 


Равновесия этих обратимых реакций смещены вправо. В избытке раствора щелочи (например, NaOH) все эти реакции протекают практически необратимо, поэтому их молекулярные уравнения обычно записывают так:
Если целевым продуктом этих реакций является фосфат натрия, то можно записать и суммарное уравнение:
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
Соответствующая характеристика основания называется кислотностью.
в) Реакции слабых кислот со слабыми основаниями
Практически все эти реакции обратимы. В соответствии с общим правилом равновесия в таких обратимых реакциях смещены в сторону более слабых кислот и более слабых оснований.


2.С какими из перечисленных веществ будет реагировать в растворе сернистая кислота: LiOH, K2CO3, Na2SO4, KCl? Составьте ионные и молекулярные уравнения реакций.
3.Раствор какого вещества получится в результате сливания раствора, содержащего 29,4 г фосфорной кислоты, с раствором, содержащим 8 г гидроксида натрия? Определите массу соли, которая может быть выделена из этого раствора при выходе, равном 98 %.

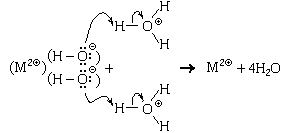
Среди частиц, проявляющих кислотные свойства, особое место занимают гидратированные катионы некоторых элементов, образующих металлы. Эти ионы появляются в растворе, например, при растворении соответствующей соли:
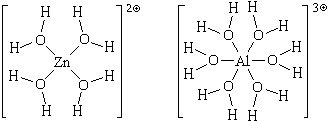
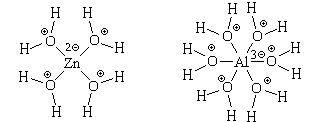
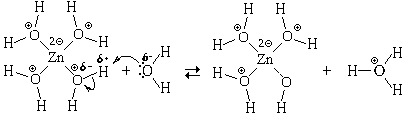
Образовавшиеся гидратированные катионы представляют собой сложные частицы состава [Zn(H2O)4] 2 (ион тетрааквацинка) и [Al(H2O)6] 3
(ион гексаакваалюминия), в которых атомы цинка или алюминия связаны с атомами кислорода химическими связями, образовавшимися по донорно-акцепторному механизму. Структурные формулы этих частиц можно изобразить двумя способами:
Причина кислотных свойств таких ионов в том, что на атомах водорода, входящих в их состав, образуется большой положительный частичный заряд, значительно больший, чем на атомах водорода в свободных молекулах воды. Поэтому эти ионы могут отдавать протон частицам-основаниям, а также частицам-амфолитам, в том числе и молекулам воды. В качестве примера рассмотрим реакцию с водой иона тетрааквацинка:
Znaq 2 


Так как катионные кислоты представляют собой слабые кислоты, равновесие этих обратимых реакции смещено в сторону исходных веществ.
Кроме таких гидратированных катионов, существуют гидратированные катионы и другого типа, например: [K(H2O)n] 













а) Na2SO4, MgSO4, NaHSO4;
б) AlCl3, FeCl2, CaCl2;
в) Ca(HCO3)2, NaHCO3, Na2CO3?
3.Используя общее правило, объясните направление смещения равновесия обратимой реакции Mg 2 


4.В каком направлении сместится равновесие в этом растворе а) при его разбавлении водой, б) при добавлении в него раствора сильной кислоты?


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору