чем регулируется сокращение саркомера
Модель сокращения саркомера
Таким образом, особенность строения саркомеров позволяет им укорачиваться при соответствующем нервном импульсе. Процесс сократительного акта в саркомере можно упрощенно сравнить с движениями гребцов в академической лодке.
Реагируя на нервный сигнал и последующую химическую реакцию, отростки миозина временно пристыковываются к филаментам актина (в виде мостиков соединения, а затем отводятся в «позицию под углом 45о» (рис. 37).
Рис. 37. Модель сокращения саркомера миофибриллы
За счет этих движений, которые можно сравнить с опусканием в воду весел (захват воды) и последущим гребком, филаменты актина перемещаются между филаментами миозина.
После выполнения «гребка» отростки миозина примерно так же, как весла, поднимаются из воды, отрываются от актина и возвращаются в исходное положение. За один такой «гребок» саркомер укорачивается всего лишь примерно на 1% своей длины. Следовательно, для достижения телескопического соединения филаментов, вызывающего эффективное напряжение, требуется большое число «гребков». Нервная система, выступая в роли «рулевого», может в зависимости от структуры мышечного волокна и требуемой величины напряжения, подавать сигналы с частотой от 7 до более чем 50 «гребков» в секунду.
После выполнения «гребка» отростки миозина примерно так же, как весла, поднимаются из воды, отрываются от актина и возвращаются в исходное положение. За один такой «гребок» саркомер укорачивается всего лишь примерно на 1% своей длины. Следовательно, для достижения телескопического соединения филаментов, вызывающего эффективное напряжение, требуется большое число «гребков». Нервная система, выступая в роли «рулевого», может в зависимости от структуры мышечного волокна и требуемой величины напряжения, подавать сигналы с частотой от 7 до более чем 50 «гребков» в секунду.
В связи с тем, что огромное количество саркомеров, расположенных по ходу миофибриллы, включается последовательно, их единичные минимальные сокращения суммируются, и миофибрилла сокращается на 25-30%. Так как большое количество миофибрилл расположено рядом, их относительно небольшие сократительные силы складываются в суммарную силу мышечного волокна и в итоге в мышцы.
Наиболее благоприятная для образования мостиков длина саркомера 0,0019-0,0022 мм. При этой длине в состоянии покоя филаменты актина и миозина контактируют настолько удачно, что за единицу времени может образоваться особенно много мостиковых соединений и тем самым создаются предпосылки для значительных напряжений в мышце.
При сильном и предельном удлинении мышцы (длина саркомера 0,0024-0,0035 мм) количество контактирующих мостиков уменьшается все больше, пока отростки миозина перестанут контактировать с филаментами актина. В результате напряжение в мышце постоянно уменьшается (рис. 38, а).
Рис. 38. Телескопическая модель сокращения саркомера
При сильном и предельном укорачивании мышцы (длина саркомера 0,0016-0,0013 мм) концы филаментов актина все глубже проникают между филаментами миозина и их тяга постоянно уменьшается, образовывать новые мостики становится все сложней. Напряжение мышцы постоянно спадает (рис. 38, в).
Это явление наблюдается в различных случаях максимального приложения сил независимо от длины мышцы: и при большой, и при малой длине. К филаментам актина можно «привязать» лишь относительно небольшое количество филаментов миозина, поэтому и в начальной, и в конечной фазе движения большую силу развить нельзя. В средних фазах, в которых можно навести значительно большее количество мостиков, силовые возможности увеличиваются.
При незначительной скорости движения мышца имеет возможность создать гораздо большее количество мостиковых соединений, чем при высокой скорости движения.
При высокой скорости движения, т.е. при высокой скорости сокращения мышцы, просто-напросто не хватает времени для «стыковки» филаментов актина и миозина, для одновременного наведения и поддерживания большого количества мостиков. Поэтому при небольшой скорости мышца способна на более высокое напряжение и «высвобождает» больше силы.
Чем регулируется сокращение саркомера
• Миозин II представляет собой мотор, обеспечивающий сокращение мышц
• Актин и миозин II являются основными компонентами саркомера, основной единицей сокращения поперечнополосатых мышц
Мышцы представляют собой ткань, способную к сокращению, которая обеспечивает движение тела и подвижность органов. В соответствии с внешним видом сократительных волокон, мышцы можно подразделить на две основных группы: поперечнополосатые и гладкие. Волокна поперечнополосатых мышц называются так потому, что при большом увеличении можно видеть их характерную исчерченность. К этой группе относятся скелетные и сердечная мышцы.
Скелетные мышцы обеспечивают подвижность скелета, а сердечная сокращение сердца. Волокна гладких мышц не исчерченные и имеют веретенообразную форму. Эти мышцы образуют стенки органов, например мочевого пузыря, кровеносных сосудов и желудочно-кишечного тракта.
Белковый мотор, который обеспечивает сокращение мышц, относится к семейству миозина II. Этот миозин принадлежит к числу наиболее распространенных белков позвоночных, он легко выделяется и поэтому является одним из хорошо изученных белков.
На рисунке ниже представлено строение молекулы миозина II, состоящей из шести полипептидных цепей: двух тяжелых и двух наборов, каждый из которых состоит из двух легких цепей.
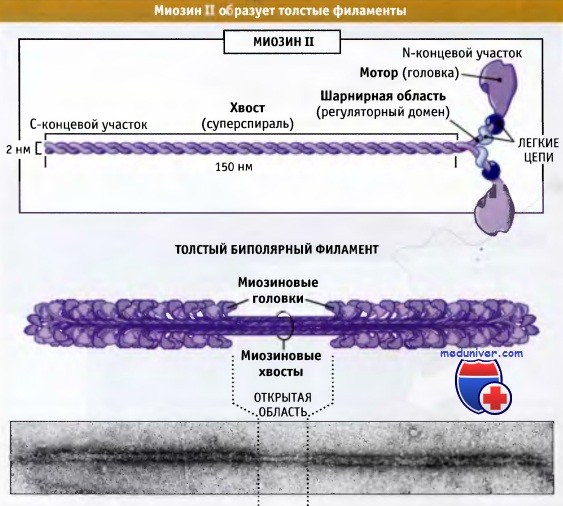
состоящий из двух тяжелых цепей и двух пар различных легких цепей.
Эти комплексы собираются в биполярные толстые филаменты.
Дистальный участок хвоста мышечного миозина II связан с другими молекулами миозина II, образуя волокна, состоящие примерно из 300 молекул миозина. Эти волокна биполярны, и моторные домены всех миозинов направлены от центральной зоны. Эти волокна называются толстые биполярные филаменты. В настоящем разделе мы обсудим организацию и роль миозина II в сокращении поперечнополосатых мышц. Эти вопросы хорошо изучены.
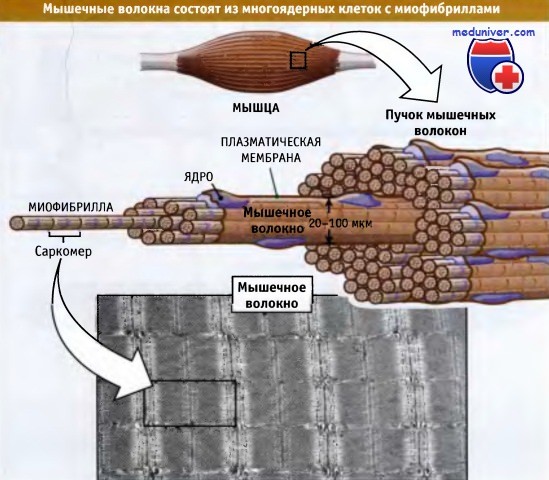
Поперечнополосатые мышцы состоят из пучков мышечных волокон. Последние представляют собой крупные многоядерные клетки, длина которых варьирует от нескольких миллиметров до нескольких сантиметров, а диаметр составляет 20-100 мкм. Рисунок ниже показывает, что каждое мышечное волокно состоит более чем из 1000 миофибрилл, которые представляют собой палочковидные органеллы, способные к сокращению. Миофибриллы состоят из повторяющихся единиц, которые называются саркомеры. Саркомеры расположены друг за другом и обусловливают характерную исчерченность мышц.
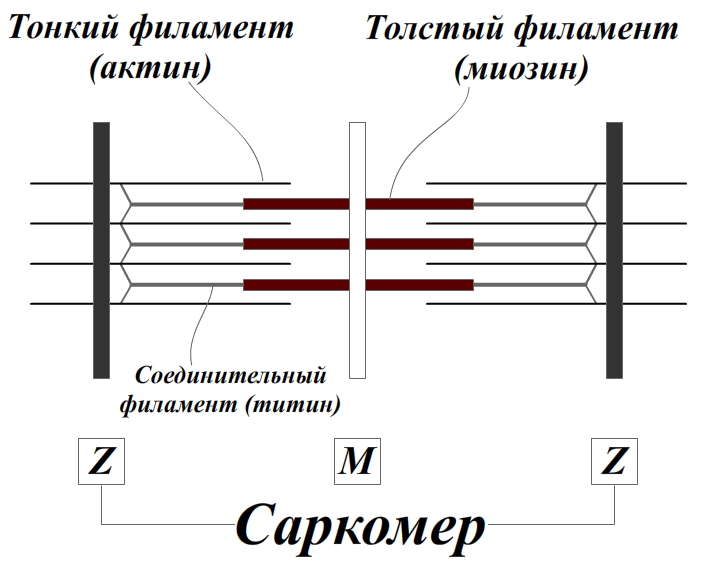
Саркомеры представляют собой основные сокращающиеся единицы поперечнополосатых мышц; при сокращении и расслаблении мышцы их длина изменяется. Как показано на рисунке ниже, саркомеры содержат толстые филаменты, состоящие, главным образом, из биполярных филаментов миозина II, и тонких филаментов, которые содержат актиновые нити и регуляторные белки. Оперенные концы актиновых филаментов с одной стороны прикреплены к структуре саркомера, которая носит название Z-диск. При этом все актиновые филаменты с одной стороны Z-диска имеют одинаковую полярность.
Актиновые филаменты прикрепляются к Z-диску и копируются за счет связывания с копирующим белком (CapZ), что предотвращает деполимеризацию актиновых филаментов. Заостренные концы актиновых филаментов ориентированы к центру саркомера и копированы тропомодулином. С актиновыми филаментами также взаимодействует белок небулин; он может регулировать сборку волокон и длину тонких филаментов.
Толстые филаменты находятся в центре, на М-линии, между Z-дисками. М-линия представляет собой структуру, состоящую из гибко связанных биполярных толстых филаментов; эти связи скрепляют толстые филаменты, гексагонально расположенные внутри. Наряду с М-линией, белок филаментов, который называется титаном, образует эластичные связи между Z-дисками и миозиновыми волокнами. Титин обеспечивает центровку толстых филаментов в саркомере и действует как пружина, которая не допускает растягиваться саркомеру.
Тонкие и толстые филаменты переплетаются, образуя трехмерную решетчатую структуру. Поскольку саркомер биполярен, в обеих половинах миозиновые моторы по отношению к актину ориентированы одинаково. При сокращении моторные домены миозина толстых филаментов взаимодействуют с актином тонких филаментов. При сокращении саркомер укорачивается за счет скольжения тонких и толстых филаментов относительно друг друга, что сближает соседние Z-диски к центру саркомера. По мере продвижения головок миозина к зазубренным концам актиновых филаментов, длина толстых и тонких филаментов остается постянной.
Ширина саркомера в расслабленной мышце позвоночных составляет около 3 мкм, а при сокращении она становится около 2,4 мкм.
В мышечном волокне укорачиваются группы, состоящие из тысяч саркомеров, что приводит к укорачиванию всей мышцы. Общая длина укороченного мышечного волокна определяется двумя факторами: длиной, на которую укорачивается каждый саркомер, и количеством саркомеров в группе. Процентная величина, на которую происходит укорачивание мышечных волокон, одна и та же, независимо от их длины.
Величина усилия, генерируемого саркомером, пропорционально числу акто-миозиновых взаимодействий в половине саркомера, а величина усилия, которое развивает мышчное волокно, пропорционально числу параллельно расположенных саркомеров. Таким образом, штангисты увеличивают свою силу за счет увеличения площади поперечного сечения мышц, а не за счет их длины.
Как показано на рисунке ниже, сокращение поперечнополосатых мышц регулируется с участием тропонин-тропомиозинового комплекса, который связан с актином в тонких филаментах. Молекулы тропомиозина представляют собой суперспирализованные полипептиды длиной 40 нм. Она располагаются друг за другом вдоль актиновых спиралей. Тропонин представляете собой комплекс из трех различных белков: тропонина С, тропонина I и тропонина Т. Один комплекс связывается с тропомиозином так, что они располагаются вдоль тонких филаментов через 40 нм интервалы.
При низких концентрациях ионов кальция тропомиозин находится в таком состоянии, что пространственно блокирует сайт связывания миозина на актине, так что мышца расслабляется и гидролиз АТФ под действием миозина происходит очень медленно. За счет взаимодействия актина с миозином релаксированные саркомеры способны к пассивному растяжению, оказывая небольшое сопротивление.
Нервные импульсы вызывают выход кальция в цитозоль из саркоплазматического ретикулума. Последний представляет собой органеллу, которая депонирует кальций в мышце. Повышение уровня кальция в цитозоле приводит к его связыванию с тропонином-С и к конформационным изменениям в молекуле белка. В результате этих изменений тропомиозин отходит от миозин-связывающего сайта в актине, и миозин получает возможность взаимодействовать с актином и генернировать усилия за счет механохимического цикла.
Миофибриллы способны к сокращению и содержат повторяющиеся структурные единицы, называемые саркомерами. 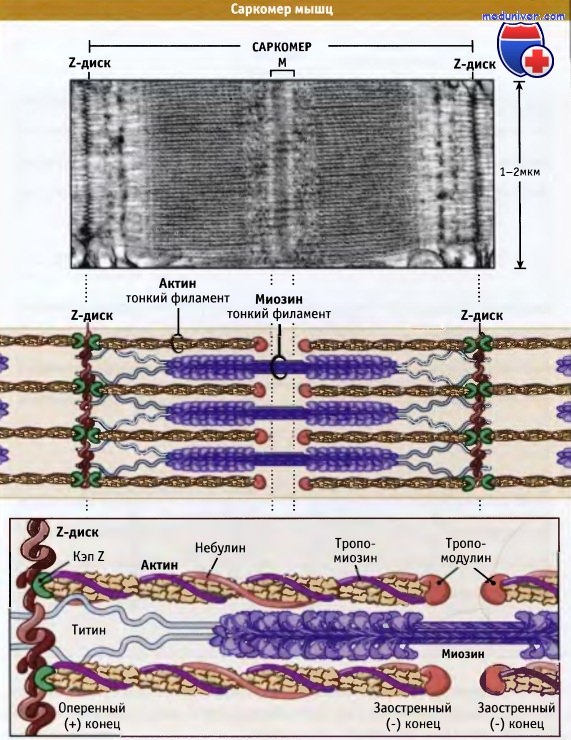
Толстые миозиновые филаменты соединяются с Z-диском через белок титин и вплетаются между актиновыми филментами.
Небулин проходит от Z-диска к тропомодулину. Однако как он связывает актин, пока неизвестно. 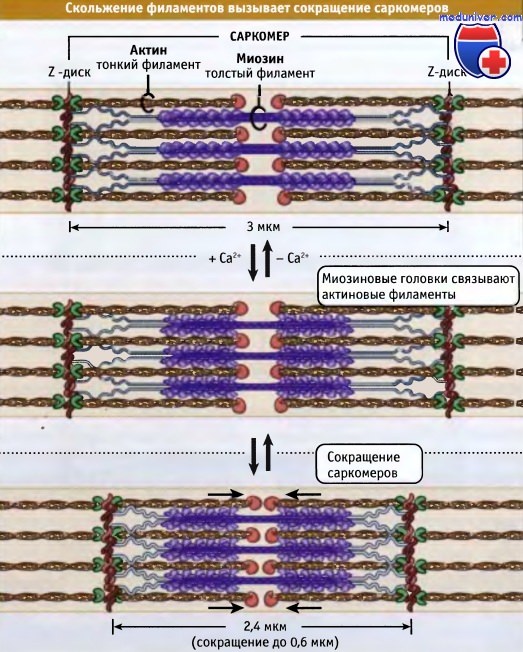
что Z-диски сдвигаются относительно друг друга. При этом длина саркомера уменьшается. 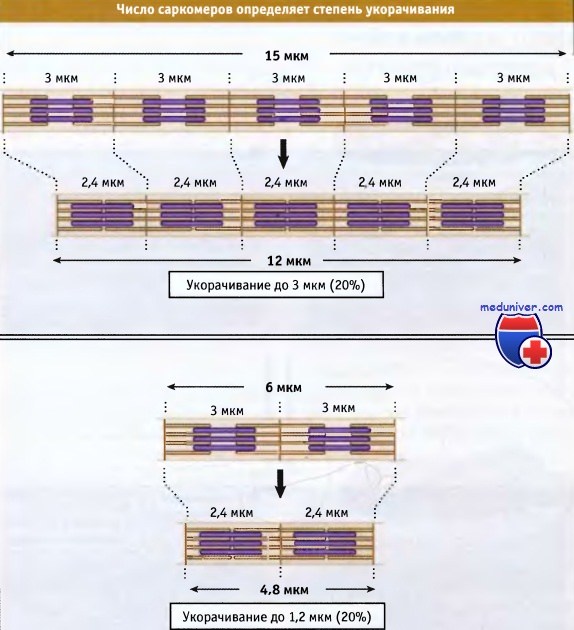
Однако в процентном отношении величина укорачивания не зависит от числа саркомеров. 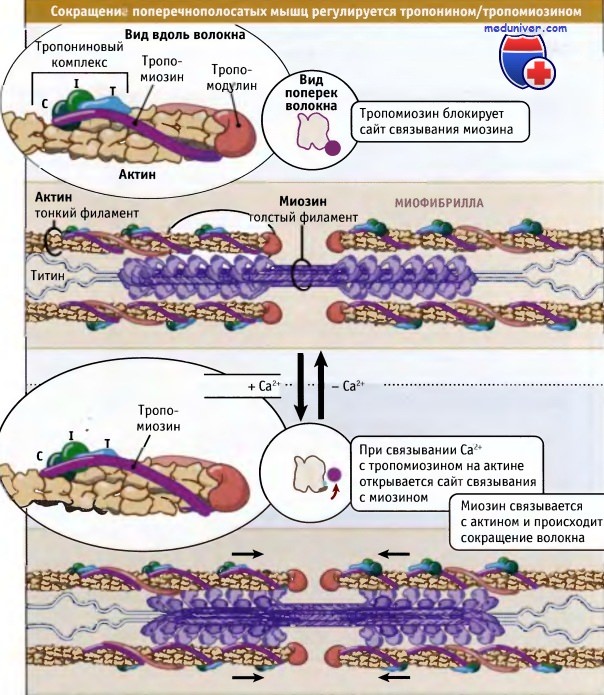
который определяет положение комплекса тропонин/тропомиозин относительно миозина и актина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Состав и структура саркомера
Описаны состав и структура саркомеров — структурных единиц миофибрилл. Показано, что саркомер состоит из большого количества (более 1000) структурных элементов — сот. Описано строение структурного элемента саркомера — сота.
Состав и структура саркомера
После того, как мы ознакомились из чего состоят скелетные мышцы, мышечные волокна и миофибриллы, давайте разберемся из чего состоит саркомер и каково его строение.
Характеристика саркомера
Саркомер – это структурная единица миофибриллы, главная функция которого – превращение химической энергии в мышечное сокращение.
Установлено, что каждая миофибрилла состоит из структурных элементов – саркомеров. Это очень маленькие элементы. Они похожи на микроцилиндры, которые расположены вдоль миофибриллы. Однако это, конечно, не металлические цилиндры. Саркомеры состоят из белковых элементов, которые принимают активное участие в сокращении скелетной мышцы. Друг от друга эти микроцилиндры разделяют Z-диски, основу которых составляют белки: α-актинин, десмин, дистофин и другие.
Еще миофибриллу можно сравнить со стеблем бамбука. При этом саркомеры похожи на длинные секции, а Z-диски – это диски, разделяющие эти секции. Длина саркомеров лежит в пределах 2-3 мкм (напоминаю, что 1 мкм – это одна миллионная метра). Поэтому в миофибрилле, длина которой составляет 5 см содержится около 20000 саркомеров.
Состав саркомера
Чаще всего при описании состава саркомера указывается, что саркомер состоит из толстых и тонких филаментов, и приводится следующий рисунок (рис.1).
Однако этот рисунок не дает полное представление как о составе, так и о структуре саркомера. Не будем забывать, что саркомер – это объемный объект, маленький цилиндр.
Рис.1. Схема строения саркомера (G.H. Pollak, 1990) Длина саркомера ограничена Z-дисками. В середине саркомера располагается М-диск, который представляет собой «сцепление хвостов миозиновых молекул».
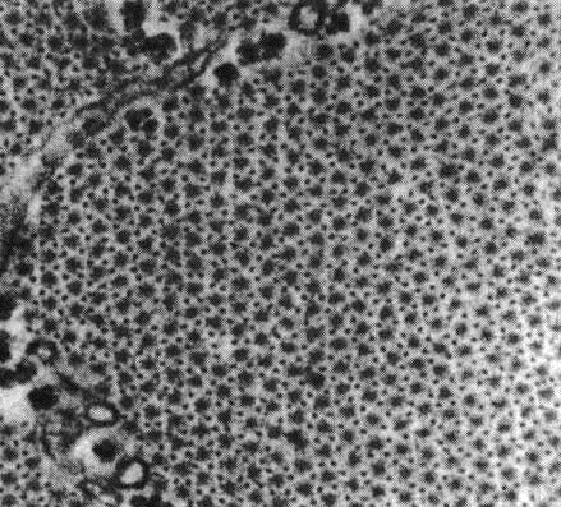
Если мысленно разрезать саркомер поперек, то в месте, где пересекаются толстые и тонкие филаменты, мы увидим следующую картину (рис.2).
Рис. 2. Решетчатая структура филаментов актина и миозина (H.E. Huxley, 1972)
Отчетливо видно, что каждый толстый филамент окружен шестью тонкими филаментами, то есть видно большое количество структурных элементов. Еще в 1972 году известный гистолог А.Н. Студитский выделил эти структурные элементы в составе саркомера. Для их описания он использовал следующее образное сравнение: «На поперечных срезах в миофибриллах открывается картина взаимного расположения филамент, гексогональная упаковка, напоминающая связку карандашей, повернутую концами к зрителю». Из этого образного сравнения следует, что А.Н. Студитский сравнивает эти структурные элементы с карандашами, а саркомер, в свою очередь, представляет связку таких «карандашей».
В нашей статье (А.В. Самсонова, Г.А. Самсонов, 2016) мы предложили называть такие элементы, из которых состоят саркомеры – сотами по аналогии с пчелиными сотами.
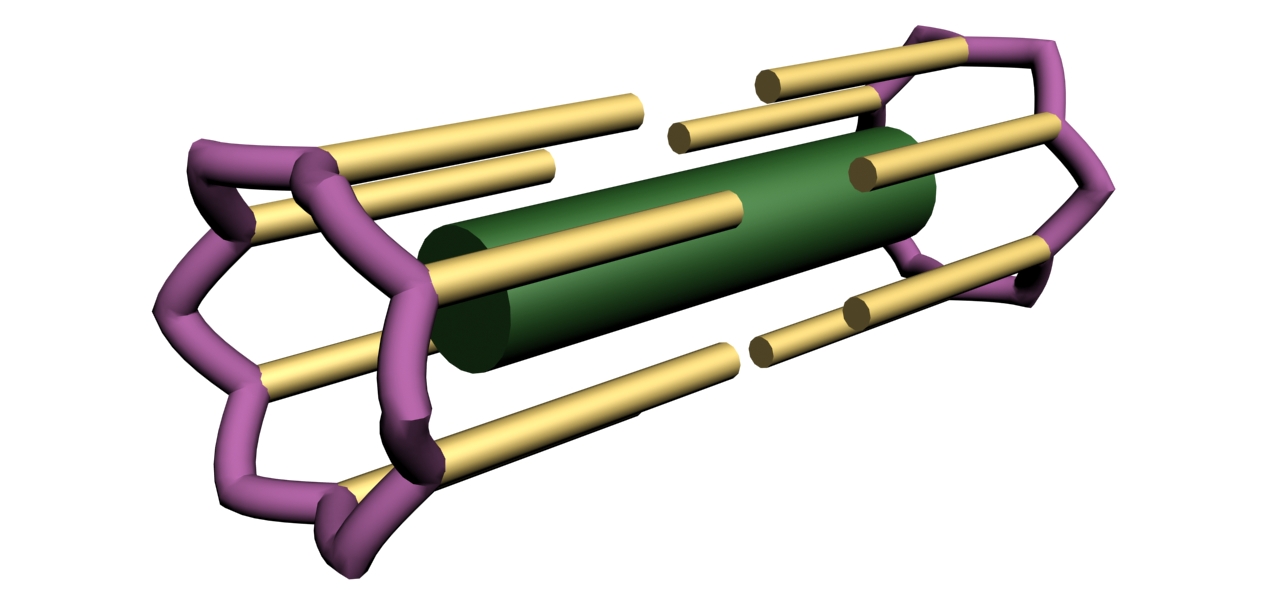
Сот – структурная единица саркомера, в состав которой входит один толстый и 12 тонких филаментов, шесть из которых прикреплены к Z-диску с одной стороны от толстого филамента, а другие шесть – с другой стороны от толстого филамента (рис. 3).
Длина сота равна длине саркомера, так как длина сота ограничена с двух сторон Z-дисками. На рис. 3 представлены основные элементы, входящие в состав сота: один толстый филамент и шесть тонких филаментов, расположенных справа и слева от толстого филамента, а также часть Z – диска, к которому прикреплены тонкие филаменты. Следует отметить, что состав и строение этого элемента значительно сложнее. Например, на рисунке не указано, что белок титин (тайтин) соединяет каждый толстый филамент с Z-дисками. Данная схема предназначена для того, чтобы выделить этот структурный элемент в составе саркомера.
Рис. 3. Схема строения сота. Толстый филамент, подобно грифелю карандаша расположен в середине, на ребрах карандаша расположены тонкие филаменты. Шесть тонких филаментов прикреплены к Z-диску с одной стороны от толстого филамента, а другие шесть – с другой стороны. Часть Z- диска показана схематично. Не показано прикрепление толстого филамента к Z- диску при помощи белка титина (А.В. Самсонова, 2011)
В 2000 году математик Томас Хелс доказал, что шестиугольники, лежащие в основе пчелиных сот, лучше других геометрических фигур подходят для максимального использования пространства, при этом используется минимум строительного материала (воска). По-видимому, это свойство гексагональной структуры сотов также используется и при «строительстве» саркомеров.
A-диск саркомера, I-диск саркомера и М-диск саркомера
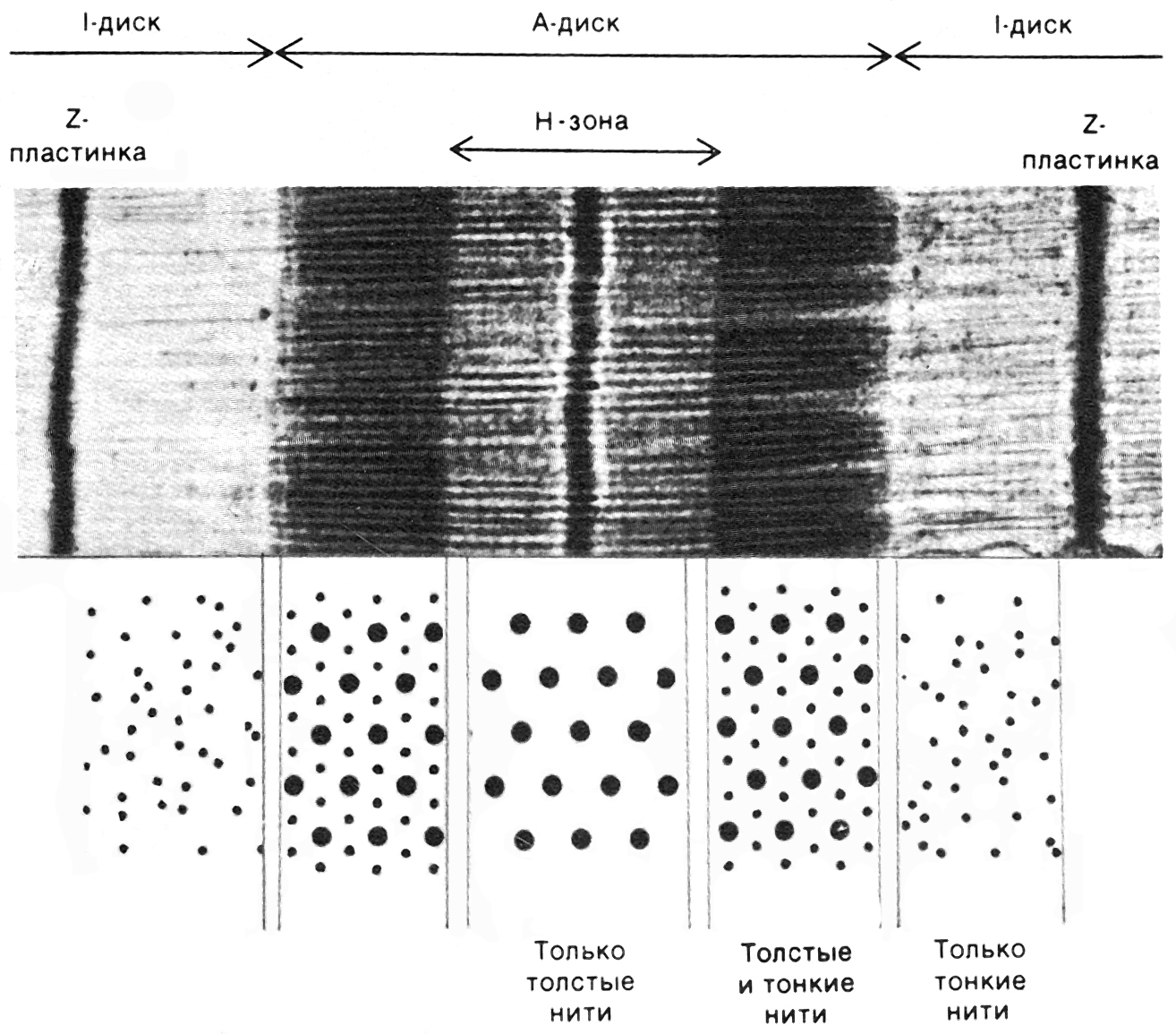
Достаточно часто читателей интересует, что такое А-диск саркомера или что такое I-диск саркомера. Честно говоря, когда я сама разбиралась со структурой саркомера, я долго не могла запомнить, что это за диски. Появление названий этих дисков связано с тем, что раньше электронные микроскопы были достаточно слабыми. Поэтому исследователи не видели структуру саркомера, а видели только чередующиеся светлые и темные участки, которые они назвали дисками. Чтобы понять, что это за диски, посмотрим на рис. 4.
Рис.4. Вверху. Микрофотография продольного среза саркомера. Внизу — поперечный срез саркомера в его различных участках (H.E. Huxley, 1972)
А-диск саркомера
Итак, А-диск (анизотропный диск) – это темный диск на рис. 4. Этот «диск» образован перекрытием толстых и тонких филаментов.
А-диски (анизотропные, темные диски) вызваны двойным лучепреломлением обычного света. Двойное лучепреломление в свою очередь связано с различными свойствами среды. Это называется анизотропией. По-видимому, анизотропность среды связана с тем, что в этих местах пересекаются толстые и тонкие филаменты.
I-диск саркомера
I-диски (изотропные диски) – это светлые «диски» справа и слева от А-диска (рис. 4). Эти «диски» соответствуют тому участку саркомера, где располагаются только тонкие филаменты.
I-дискам (изотропные, светлые диски) не свойственно двойное лучепреломление. Среда изотропна (одинакова во всех направлениях). Изотропность среды связана с тем, что в этих местах саркомера имеются только тонкие филаменты.
М-диск саркомера
В центре саркомера имеется светлая полоса – Н-зона. Эта зона соответствует тому участку саркомера, где располагаются только толстые филаменты. В середине Н-зоны имеется участок, который называется М-зоной или М-диском (от немецкого слова mittelscheibe – центральный диск). Этот участок образован толстыми филаментами и структурами, которые соединяют их поперечно между собой.
Влияние тренировки на изменение площади саркомера
Установлено, что тренировка не влияет на расстояние между толстым и тонкими филаментами. Это означает, что площадь сота не меняется. Однако силовая тренировка значительно изменяет площадь поперечного сечения саркомера. Доказано, что толстые и тонкие филаменты при увеличении площади саркомера добавляются на его наружной поверхности. Увеличение площади поперечного сечения саркомеров (миофибрилл) приводит к гипертрофии скелетных мышц (увеличению их объема).
Структура и части саркомера, функции и гистология
Сказать, что саркомер является функциональной единицей, означает, что все компоненты, необходимые для сокращения, содержатся в каждом саркомере. Фактически, поперечно-полосатая мышца состоит из миллионов маленьких саркомеров, которые сокращаются индивидуально с каждым сокращением мышц..
Здесь кроется основная цель саркомера. Саркомеры могут инициировать большие движения, заключая контракты в унисон. Его уникальная структура позволяет этим маленьким единицам координировать сокращения мышц.
Фактически, сократительные свойства мышц являются определяющей характеристикой животных, поскольку движение животных является удивительно плавным и сложным. Локомоция требует изменения длины мышц при их сгибании, что требует молекулярной структуры, которая позволяет сокращать мышцы.
Структура и части
Если скелетные мышечные ткани внимательно изучаются, наблюдается полосатый вид, который называется полосатым. Эти «полосы» представляют собой узор чередующихся полос, светлых и темных, соответствующих различным белковым нитям. То есть эти полоски образованы переплетенными белковыми волокнами, которые составляют каждый саркомер.
миофибриллы
Мышечные волокна состоят из сотен и тысяч сократительных органелл, называемых миофибриллами; Эти миофибриллы располагаются параллельно для формирования мышечной ткани. Однако сами миофибриллы по существу являются полимерами, то есть повторяющимися звеньями саркомеров..
Миофибриллы имеют волокнистую и длинную структуру и состоят из двух типов белковых нитей, которые уложены друг на друга.
Миозин и актин
Миозин представляет собой толстое волокно с шаровидной головкой, а актин представляет собой более тонкую нить, которая взаимодействует с миозином в процессе сокращения мышц.
Данная миофибрилла содержит приблизительно 10000 саркомеров, каждый из которых имеет длину приблизительно 3 микрометра. В то время как каждый саркомер маленький, несколько совокупных саркомеров охватывают длину мышечного волокна.
миофиламентов
Каждый саркомер состоит из толстых тонких пучков белков, упомянутых выше, которые вместе называются миофиламентами.
Расширяя часть миофиламентов, вы можете идентифицировать молекулы, из которых они состоят. Толстые нити сделаны из миозина, в то время как тонкие нити сделаны из актина.
Актин и миозин являются сократительными белками, которые вызывают сокращение мышц, когда они взаимодействуют друг с другом. Кроме того, тонкие нити содержат другие белки с регуляторной функцией, называемые тропонином и тропомиозином, которые регулируют взаимодействие между сократительными белками..
функции
Толстые и тонкие нити не укорачиваются, а скользят друг вокруг друга, что приводит к укорочению саркомера, в то время как нити сохраняют одинаковую длину. Этот процесс известен как модель скользящих нитей мышечного сокращения.
Скольжение нити вызывает мышечное напряжение, что, несомненно, является основным вкладом саркомера. Это действие дает мышцам их физическую силу.
Вовлечение миозина
К счастью, недавние исследования дают хорошее представление о том, как работает это проскальзывание. Теория скользящей нити была изменена, чтобы включить, как миозин способен вытягивать актин, чтобы сократить длину саркомера.
В этой теории глобулярная головка миозина расположена рядом с актином в области, называемой областью S1. Этот регион богат сегментами с петлями, которые можно согнуть и тем самым облегчить сокращение.
Сгибание S1 может быть ключом к пониманию того, как миозин способен «ходить» вдоль нитей актина. Это достигается за счет циклов связывания фрагмента миозина S1, его сокращения и его окончательного высвобождения.
Союз миозина и актиба
Когда миозин и актин объединяются, они образуют расширения, называемые «скрещенные мосты». Эти перекрещенные мосты могут образовываться и разрушаться при наличии (или отсутствии) АТФ, молекулы энергии, которая делает возможным сокращение.
Когда АТФ связывается с актиновым филаментом, он перемещает его в положение, которое обнажает его сайт связывания миозина. Это позволяет шаровую головку миозина прикрепить к этому месту, чтобы сформировать поперечный мостик.
Этот союз заставляет диссоциировать фосфатную группу АТФ, и, таким образом, миозин начинает свою функцию. Затем миозин входит в состояние с меньшей энергией, где саркомер может быть сокращен.
Чтобы разорвать перекрестный мостик и снова позволить связать миозин с актином в следующем цикле, необходимо связать другую молекулу АТФ с миозином. То есть молекула АТФ необходима как для сокращения, так и для релаксации..
гистология
Гистологические срезы мышцы показывают анатомические характеристики саркомеров. Толстые нити, состоящие из миозина, видны и представлены как полоса А саркомера.
Тонкие нити, состоящие из актина, связываются с белком на Z-диске (или Z-линией), называемым альфа-актинином, и присутствуют по всей длине полосы I и части полосы A.
Область, где толстые и тонкие нити перекрываются, имеет плотный вид, поскольку между нитями мало места. Эта область, где тонкие и толстые нити перекрываются, очень важна для сокращения мышц, поскольку именно здесь начинается движение филамента..
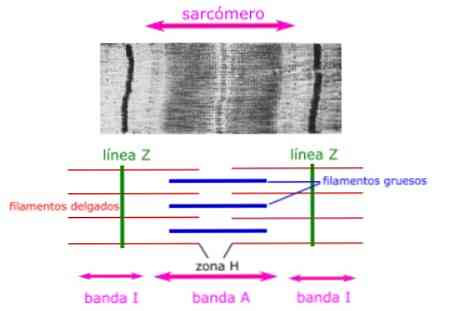
Тонкие нити не полностью проходят в полосах А, оставляя центральную область полосы А, которая содержит только толстые нити. Эта центральная область полосы A кажется немного светлее, чем остальная часть полосы A, и называется зоной H.
Центр зоны H имеет вертикальную линию, называемую линией М, где вспомогательные белки скрепляют толстые нити.
Основные компоненты гистологии саркомера приведены ниже:
Группа А
Толстая филаментная зона, состоящая из миозиновых белков.
Зона Н
Центральная зона полосы А, без актиновых белков, наложенных, когда мышцы расслаблены.
Группа I
Зона тонких нитей, состоящая из актиновых белков (без миозина).
Z диски
Являются ли границы между соседними саркомерами, образованными актин-связывающими белками, перпендикулярно саркомеру.
Линия М
Центральная зона образована вспомогательными белками. Они расположены в центре толстой нити миозина, перпендикулярно саркомеру.
Как упомянуто выше, усадка происходит, когда толстые нити скользят вдоль тонких нитей в быстрой последовательности, чтобы укорачивать миофибриллы. Однако важно помнить, что сами миофиламенты не сжимаются; именно скользящее действие дает им силу укорачивать или удлинять.