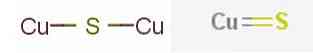чем растворить сульфид меди
Готовые домашние задания, готовые задачи по химии и биологии
Свойства и получение сульфидов
Задача 851.
Почему сульфид цинка растворяется в соляной кислоте, а сульфид меди нет? В какой кислоте можно растворить сульфид меди?
Решение:
Взаимодействие сульфида цинка с соляной кислотой выражается уравнением:
ZnS(к) + 2HCl ↔ ZnCl2 + H2S(г)
ZnS + 2H + ↔ Zn 2+ + H2S
S 2- + Zn 2+ ↔ ZnS(к);
S 2- + 2Н + ↔ Н 2 S(г).
S 2- +Cu 2+ ↔ CuS(к);
S 2- + 2Н + ↔ Н2S(г).
Задача 852.
Каковы продукты реакции взаимодействия хлорида железа (III): а) с сероводородом; б) с сульфидом аммония?
Решение:
а) Хлорид железа (III) и сероводород реагируют с образованием хлорида железа (II), серы и хлороводорода:
Данная реакция протекает по окислительно-восстановительному механизму, где роль окислителя играет FeCl3, а восстановителя – H2S.
б) Между хлоридом железа (III) и сульфидом аммония протекает реакция по обменному механизму с образованием сульфида железа (III) и хлорида аммония:
Задача 853.
Объяснить, почему ZnS и РbS можно получить обменной реакцией в водном растворе, а Al2S3 и Cr2S3 нельзя. Указать способ получения Al2S3 и Cr2S3.
Решение:
Малорастворимые сульфиды металлов можно осадить из растворов солей действием сероводорода или сульфида аммония:
Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих элементы в высоких степенях окисления Al2S3 и Cr2S3 и др.), часто идет до конца, он необратим. Поэтому Al2S3 и Cr2S3 нельзя получить обменной реакцией в водном растворе. Обычно для их получения используют сплавление метала с серой в отсутствие кислорода и влаги:
2Al + 3S 
2Cr + 3S 
Сульфид хрома поучают:
Сплавление оксида хрома(III) с сероводородом:
2Cr2O3 + 9S 
Пропускание сероводорода через нагретый оксид хрома(III):
Cr2O3 + 3H2S 
Задача 854.
Какова реакция среды в растворах: а) Na2S; 6) (NH4)2S; в) NaНS?
Решение:
а) Na2S – соль сильного основания и слабой кислоты, гидролизующаяся по аниону:
Na2S ↔ 2Na + + S 2- ;
S 2- + H2O ↔ HS — + OH — (ионно-молекулярная форма);
Na2S + H2O ↔ NaHS + NaOH (молекулярная форма).
б) (NH4)2S – соль слабого однокислотного основания и слабой двухосновной кислоты, гидролизуется как по катиону, так и по аниону:
(NH4)2S ↔ 2NH4 + + S 2- ;
NH4 + + H2O ↔ NH4OH + H + (ионно-молекулярная форма);
S 2- + H2O ↔ HS — + NH4OH (ионно-молекулярная форма).
Н + + ОН — ↔ Н2О
в) NaНS – кислая соль слабой кислоты и сильного основания, которая будет гидролизоваться по аниону:
NaHS ↔ Na + + HS — ;
HS — + H2O ↔ H2S + OH — (ионно-молекулярная форма);
NaHS + H2O ↔ H2S + NaOH (молекулярная форма).
Сульфид меди свойства, риски и использование
сульфиды меди описать семейство химических соединений и минералов с формулой CuхSи. Эти соединения включают в себя экономически важные минералы и синтетические материалы.
Наиболее известные минералы сульфида меди включают сульфид меди (I) или сульфид меди химической формулы.2S содержится в минерале калькозин и сульфид меди (II) или сульфид меди формулы CuS, обнаруженной в минерале ковелита.
Калькозин добывался веками и является одной из самых прибыльных медных руд. Причины этого обусловлены его высоким содержанием меди (атомное соотношение 67% и почти 80% по массе) и легкостью, с которой медь можно отделить от серы.
Тем не менее, это не основной минерал меди из-за его дефицита. Хотя самые богатые залежи кальцизина были добыты, он, вероятно, все еще разрабатывается и, несомненно, будет добываться в будущем (МИНЕРАЛЬНЫЙ ХАЛКОЦИТ, 2014).
Ковелит не является распределенным минералом, но его радужные чары могут очаровывать восхищение любого, кто видит синие кристаллы индиго. Хотя хорошие кристаллы редки, именно блеск и цвет этого минерала делают его замечательным (THE MINERAL COVELLITE, 2014).
В горнодобывающей промышленности минералы борнита или халькопирита, которые состоят из смешанных сульфидов меди и железа, часто называют «сульфидами меди»..
Физико-химические свойства сульфидов меди
Сульфид меди (I) и (II) имеют одинаковый внешний вид, оба являются кристаллами темного, серого или черного цвета..
Эти соединения могут быть дифференцированы по их кристаллической структуре. Сульфид меди (I) имеет моноклинную структуру, а сульфид меди (II) имеет гексагональную структуру (Национальный центр биотехнологической информации, S.F.).
Они имеют молекулярную массу 159,16 г / моль и 95 611 г / моль и плотность 5,6 г / мл и 4,76 г / мл для случая сульфида меди (I) и (II) соответственно (Национальный центр Биотехнология Информация, SF).
Сульфид меди (I) имеет температуру плавления 1100 ° C и нерастворим в воде и уксусной кислоте, частично растворим в гидроксиде аммония (Royal Society of Chemistry, 2015).
Сульфид меди (II) имеет температуру плавления 220 ° C, где он разлагается, нерастворим в воде, соляной и серной кислотах и растворим в азотной кислоте, гидроксиде аммония и цианиде калия (Royal Society of Chemistry, 2015 ).
Перекись водорода активно реагирует с сульфидом меди (II) и взрывается при контакте с концентрированным раствором хлористой кислоты или хлоратов кадмия, магния или цинка.
Реактивность и опасности
Сульфиды меди (I) и (II) не классифицируются как опасные, однако они могут быть токсичными при попадании в организм вследствие образования сероводорода. Симптомы включают в себя рвоту, желудочную боль и головокружение, могут вызвать раздражение кожи и глаз, а вдыхание может вызвать раздражение дыхательных путей (ПАСПОРТ БЕЗОПАСНОСТИ МАТЕРИАЛА Copper Sulfide, 1995).
В случае воздействия тепла он может выделять токсичные пары серы или оксида меди, которые могут быть вредными для здоровья..
В случае попадания в глаза их следует немедленно промыть достаточным количеством воды в течение 15 минут, периодически поднимая нижнее и верхнее веко..
В случае попадания на кожу немедленно промыть большим количеством воды в течение 15 минут, снимая загрязненную одежду..
В случае проглатывания следует немедленно вызвать токсикологический центр. Прополоскать рот холодной водой и дать пострадавшему 1-2 стакана воды или молока для питья. Рвота должна быть вызвана немедленно.
В случае вдыхания пострадавшего следует доставить в прохладное место. Если не дышите, сделайте искусственное дыхание (Copper (II) Sulfide, 2009).
приложений
Сульфид меди (I) используется в качестве полупроводника и в фотографических целях (americanelements, 1998-2017). Его применение также включает использование в солнечных элементах, светящихся красках, электродах и некоторых разновидностях твердых смазочных материалов (Britannica, 2013)..
С другой стороны, сульфид меди (II) находит применение в солнечных элементах, суперионных проводниках, фотоприемниках, электропроводящих электродах, фототермических преобразовательных устройствах, микроволновых защитных покрытиях, активных поглотителях радиоволн, газовых сенсорах и поляризаторах излучения. инфракрасный (азом, 2013).
Также сульфид меди (II) (ковелит) используется при исследовании наночастиц:
В работе Geng Ku (2012) было продемонстрировано использование полупроводниковых наночастиц сульфида меди (НЧ CuS) для визуализации фотоакустических томографий на Nd: YAG-лазере на длине волны 1064 нм..
CuS NP позволил визуализировать мозг мыши после внутричерепной инъекции, лимфатические узлы крысы на 12 мм ниже кожи после интерстициальной инъекции и агарозный гель, содержащий CuS NP, внедренный в мышцу куриной грудки. на глубине
5 см. Этот подход к изображениям имеет большой потенциал для получения молекулярного изображения рака молочной железы.
Сульфид меди (I)
| Сульфид меди (I) | |
|---|---|
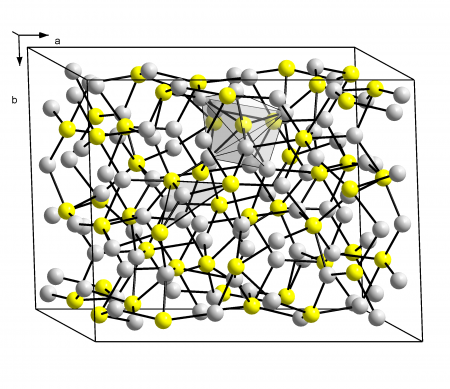 Кристаллическая структура халькозина | |
| Систематическое название | Моносульфид димеди |
| Другие названия | Сульфид меди (I) |
| Химическая формула | Cu2S |
| Эмпирическая формула | Cu2−XS, x = 0÷0,10 |
| Внешний вид | твердое вещество темно-серого цвета |
| Молярная масса | 159,16 г/моль |
| Температура плавления | 1129 °C (1402,15 К) |
| Температура разложения | 700 °C (в вакууме) |
| Фазовые переходы | 103 °C (ромб. → гекс.) 437 °C (гекс. → куб.) |
| Плотность | 5,81 г/см³ |
| Твёрдость по Моосу | 2,5÷3,0 |
| Растворимость в воде | 1,3⋅10 −15 г/100 мл |
| Произведение растворимости | 2,3⋅10 −48 |
| ПДК | в воздухе 4 мг/м 3 |
| Кристаллическая решётка | Орторомбическая |
| Стандартная энтальпия образования | −79 кДж/моль |
| Энтальпия плавления | +23,01 кДж/моль |
| Стандартная молярная энтропия | +121 Дж/(моль·К) |
| Стандартная энергия образования Гиббса | −86 кДж/моль |
| Регистрационный номер CAS | 22205-45-4 |
| Регистрационный номер EC | 244-842-9 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Содержание
Нахождение в природе
Сульфид меди(I) в природе встречается в виде минерала халькозина (устаревшие названия: халькоцит, редрутит, медный блеск). Также, по составу данному соединению близок минерал джюрлеит, иногда называют джарлеит (подробнее см. Сульфиды меди). Основные свойства представлены в таблице.
| Халькозин | Джюрлеит | |
|---|---|---|
| Состав | Cu2S | Cu1,94S |
| Цвет | темно-серый | чёрный |
| Сингония | ромбическая | моноклинная |
| Плотность, г/см³ | 5,5—5,8 | 5,5—5,7 |
| Твердость | 2,5—3,0 | 2,2—2,4 |
Физические свойства
Сульфид меди (I) — твердое вещество темно-серого цвета, нерастворимое в воде и этаноле.
Cu2S существует в трёх кристаллических модификациях:
Температуры фазовых переходов: α → β 103 °C, β → γ 437 °C.
Сульфид меди (I) склонен к образованию нестехиометрических соединений, свойства которых могут сильно отличаться от стехиометрических.
Химические свойства
Реакции при высоких температурах
При атмосферном давлении в инертной атмосфере:
Cu2S + Cl2 → 300−400∘C 2CuCl + S
С сульфидом железа(II) и серой:
Cu2S + 2FeS + S → 800−1000∘C 2(Fe III Cu I )S2 2(Fe III Cu I )S2 + 5O2 + 2SiO2 → 1000∘C 2Cu + 2FeSiO3 + 4SO2
Реакции в растворах
Сульфид меди (I) не реагирует с соляной кислотой.
Растворяется в горячей концентрированной азотной кислоте, концентрированном растворе цианида калия:
Медленно растворяется в холодной концентрированной азотной кислоте, горячей концентрированной серной кислоте, концентрированном растворе аммиака:
Восстанавливает Fe 3+ до Fe 2+ (в растворе):
Получение
Сульфид меди (I) может быть получен одним из следующих способов.
Нагреванием металлической меди с серой в вакууме:
2Cu + S → 300−400∘C Cu2S
Нагреванием металлической меди в токе диоксида серы:
4Cu + SO2 → 600−800∘C Cu2S + 2CuO
Термическим разложением сульфида меди (II):
2CuS → 200−450∘C Cu2S + S
Нагреванием сульфида меди (II) в токе водорода:
Нагреванием оксида меди(I) с серой:
Монокристаллы сульфида меди (I) получают при помощи зонной плавки.
Применение
Руды, содержащие сульфид меди (I) — один из видов сырья для производства меди, медного купороса. Сульфид меди (I) — компонент медного штейна при пирометаллургическом получении меди. Также используется как полупроводник, компонент полупроводниковых сплавов.
Влияние на здоровье
Пыль сульфида меди (I) токсична, ПДК в воздухе 4 мг/м³.
Сульфид меди(I)
| Сульфид меди(I) | |
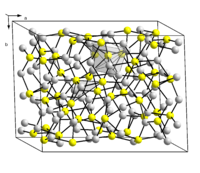 Кристалличесая структура халькозина | |
| Систематическое название | |
|---|---|
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Сульфид меди(I) — неорганическое вещество с формулой 
Содержание
Нахождение в природе
Сульфид меди(I) в природе встречается в виде минерала халькозина (устаревшие названия: халькоцит, редрутит, медный блеск). Также, по составу данному соединению близок минерал джюрлеит, иногда называют джарлеит [1] (подробнее см. Сульфиды меди). Основные свойства представлены в таблице.
| Халькозин [2] | Джюрлеит [3] | |
|---|---|---|
| Состав | Cu2S | Cu1,94S |
| Цвет | темно-серый | чёрный |
| Сингония | ромбическая | моноклинная |
| Плотность, г/см³ | 5,5—5,8 | 5,5—5,7 |
| Твердость | 2,5—3,0 | 2,2—2,4 |
Физические свойства
Cu2S существует в трёх кристаллических модификациях [5] :
Температуры фазовых переходов: α→β 103 °C, β→γ 437 °C.
Химические свойства
Реакции при высоких температурах
При атмосферном давлении в инертной атмосфере:





Реакции в растворах
Сульфид меди(I) не реагирует с соляной кислотой.
Растворяется в горячей концентрированной азотной кислоте, концентрированном растворе цианида калия:

Медленно растворяется в холодной концентрированной азотной кислоте, горячей концентрированной серной кислоте, концентрированном растворе аммиака:


Восстанавливает Fe 3+ до Fe 2+ (в растворе):

Получение
Нагреванием металлической меди с серой в вакууме:
Нагреванием металлической меди в токе диоксида серы:
Нагреванием сульфида меди(II) в токе водорода:
Нагреванием оксида меди(I) с серой:

Применение
Влияние на здоровье
Пыль сульфата меди(I) токсична, ПДК в воздухе 4 мг/м³. [5]
См. также
Примечания
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Сульфид меди(I)» в других словарях:
Сульфид меди(II) — Сульфид меди(II) … Википедия
Сульфид кальция — Общие … Википедия
Сульфид иттрия — Общие Систематическое наименование Сульфид иттрия Традиционные названия Сесквисульфид иттрия, сернистый иттрия Химическая формула Y2S3 Физические свойства … Википедия
Сульфид ртути(II) — У этого термина существуют и другие значения, см. Сульфиды ртути. Киноварь … Википедия
Сульфид цинка — Элементарная кристаллическая ячейка сульфида цинка типа сфалерита Сульфид цинка, сернистый цинк, ZnS ци … Википедия
меди(I) сульфид — vario(I) sulfidas statusas T sritis chemija formulė Cu₂S atitikmenys: angl. copper(I) sulfide rus. меди(I) сульфид; медь полусернистая; медь сернистая закисная ryšiai: sinonimas – divario sulfidas … Chemijos terminų aiškinamasis žodynas
меди(II) сульфид — vario(II) sulfidas statusas T sritis chemija formulė CuS atitikmenys: angl. copper(II) sulfide rus. меди(II) сульфид; медь сернистая … Chemijos terminų aiškinamasis žodynas
Гексафторосиликат меди(I) — Общие Систематическое наименование Гексафторосиликат меди(I) Химическая формула Cu2[SiF6] Физические свойства Состояние (ст. усл.) красн … Википедия
Гексафторосиликат меди(II) — Общие Систематическое наименование Гексафторосиликат меди(II) Химическая формула Cu[SiF6] Физические свойства Молярная масса 205,62 г/моль … Википедия