чем рассасывать фиброз после пневмонии
Фиброз после коронавируса
Специалисты реабилитационного центра “Лаборатория Движения” помогут в восстановлении после перенесенной коронавирусной инфекции (COVID-19)
У четверти пациентов с COVID-19 развивается отягощенное пневмонией течение болезни. Многоочаговое поражение лёгких влечет вероятность появления тяжелых осложнении, таких как фиброз после коронавируса. Последствия воспалительного процесса, в ходе которых происходит замещение легочной ткани соединительной. Простыми словами, фиброз — это возникновение рубцов и шрамов. Если поражения малого размера, то рубцевание не влияет на легочную функцию. Если обширные, то снижается газообмен, возникают необратимые изменения легочной функции и дыхательная недостаточность.
Рассказывает специалист РЦ «Лаборатория движения»
Дата публикации: 29 Октября 2021 года
Дата проверки: 30 Ноября 2021 года
Содержание статьи
Фиброз легких – что это, причины
Фиброз легких или пневмофиброз после ковида — это замена ткани легких соединительным рубцом, происходящая под влиянием воспалительного процесса. При выраженном воспалении в легком образуются области по типу «матового стекла». Под воздействием терапии области сжимаются, уплотняются, на их месте остается шрам или фиброзное изменение.
В отличие от альвеол, соединительная ткань не обладает эластичностью и воздухопроницаемостью, снижается объем легких и потребляемого кислорода. Ковидная пневмония отличается от внебольничной, риск необратимого поражения легочной ткани минимален при своевременной терапии в начале заболевания и дальнейшей реабилитации пациента в постковидном периоде.
На формирование пневмофиброза или пневмосклероза легких после коронавируса уходит не меньше трех месяцев. Сформировавшийся фиброз необратим, но на стадии развития процесса фиброзные изменения благоприятно минимизируются медикаментозным и физиотерапевтическим лечением.
Симптомы
Фиброз легких после коронавируса — симптомы выражены следующими признаками:
Для подтверждения диагноза назначают КТ легких, на котором рентгенолог увидит все произошедшие изменения. Фиброз легких, симптомы после ковида на снимках компьютерной томографии выражены:
По совокупности признаков врачи определяют объем медикаментозного лечения и дальнейшей реабилитации.
Вероятность развития фиброза после коронавируса
На склонность к фиброобразованию влияет
Также в группе риска пациенты с тяжелым течением SARS-CoV-2, находившиеся на искусственной вентиляции легких.
Как долго сохраняются аномальные изменения в органах дыхательной системы
Постковидные патологические изменения сохраняются в легких сроком от трех до шести-восьми месяцев. Продолжительность индивидуальна в каждом клиническом случае и зависит от состояния иммунной системы, наличия сопутствующих заболеваний, раннего или поздно начатого лечения.
При появлении даже незначительного проявления симптомов, указывающих на образование пневмофиброза, необходимо посетить врача и пройти рекомендуемое обследование. Чем раньше начато лечение и пульмонологическое восстановление, тем меньше риск осложнений.
Лечение фиброза легких после пневмонии
Ведение пациентов с перенесенной ковидной пневмонией предусматривает комплексную диагностику и лечение. Перед назначением врач учитывает результаты обследования, подбирает тактику индивидуального курса терапии.
Наряду с медикаментозным лечением используют физиотерапевтические процедуры, специальные комплексы дыхательной гимнастики, лечебной физкультуры.
Как избежать осложнений
Чем опасен фиброз легких после коронавируса — при большой площади фиброзных разрастаний страдают не только легкие. Появление очагов кальцинатов в легких после коронавируса снижает объем вдыхаемого и выдыхаемого воздуха. Возникают осложнения в работе сердечно-сосудистой системы — сердце, чтобы насытить органы кислородом, начинает быстрее перекачивать кровь. Появляется деформация сосудов, наблюдается повышение давления, образуются тромбы.
Последствия со стороны нервной системы выражены проявлениями кислородного голодания мозга: снижением когнитивных функций, работоспособности, проблемами с памятью, быстрой утомляемостью, развитием стойкого депрессивного состояния.
Своевременное лечение фиброза легких после коронавируса дают благоприятный прогноз. Дальнейшая реабилитация направлена на устранение патологического состояния и минимизации риска осложнений.
Как лечить фиброз легких
Фиброз легких — это заболевание, которое сопровождается замещением легких фиброзной (рубцовой) тканью. Постепенно она полностью замещает альвеолярную ткань структуры. Фиброз отличается пошаговым прогрессивным ухудшением дыхания больного, вплоть до дыхательной недостаточности. Поэтому очень важно не затягивать с лечением и доверять только высококвалифицированным специалистам. Для этого рекомендуем обратиться к врачам клиники МЕДИКОМ. Наши специалисты знают, как лечить фиброз легких с получением стойкого результата.
Причины появления
Многие не знают, что такое фиброз легких до того момента, пока не столкнутся с ним лицом к лицу. Это — довольно сложное заболевание, которое требует высокого уровня квалификации врачей, конкретных знаний и оборудования для диагностики.
Перед тем, как назначать лечение фиброза легких, врач должен установить причину его развития. Чаще всего фиброз возникает вследствие болезней, поражающих легкие человека.
Главные причины фиброза легких:
Бывают случаи, когда нельзя установить точные причины появления фиброза легких. Тогда специалисты начинают говорить об одном из его подвидов — идиопатическом легочном фиброзе. Для этого больного могут направить на сдачу дополнительных анализов.
Признаки фиброза легких
На первых порах определить, что в организме начался процесс замены легочной ткани на рубцовую, как правило, нельзя. Так как на этом этапе симптомы легочного фиброза полностью отсутствуют. До некоторого момента человек совершенно не чувствует никакого дискомфорта. Первые признаки проявляются, когда фиброз охватывает значительную часть легочной ткани. Тогда человек может отметить снижение качества дыхательной функции. Это выражается в появлении следующих признаков фиброза легких:
Последствия фиброза легких необратимы. Чем дольше будет отсутствовать лечение, тем сильнее будет прогрессировать заболевание.
Вышеперечисленные симптомы могут указывать и на другие, не менее серьезные, заболевания. Поэтому при выявлении первых симптомов рекомендовано пройти обследования, проконсультироваться со специалистами.
Обратите внимание, что фиброз легких нельзя определить на глаз. Потребуются соответствующие исследования.
Диагностика фиброза легких
Чтобы диагностировать фиброз легких, врач-пульмонолог направляет пациента на:
Чтобы быстро определить болезнь, врач направляет пациента на рентгенографию. Если подозрения подтверждаются, специалист выдает направление на иные исследования. Только точная и высококвалифицированная диагностика фиброза легких позволяет увидеть картину заболевания в целом.
Фиброз легких: сколько живут с таким заболеванием
Продолжительность жизни людей, страдающих фиброзом легких, сильно варьируется. До появления препаратов, замедляющих образование рубцов, около половины больных после постановки диагноза «легочный фиброз» жили менее 3-х лет, примерно каждый пятый жил дольше 5 лет.
Почему не стоит медлить с лечением
Легочный фиброз — сложное заболевание легочной системы. Без необходимого лечения оно может привести к инвалидизации, вторичной сердечной недостаточности и даже к остановке сердца. Фиброз может спровоцировать изменения в легочной системе, которые исправить невозможно. Как будет протекать фиброз легких у конкретного человека, сказать практически невозможно. Чем позднее человек обратиться за лечением, тем хуже будет состояние легких. А это усложняет процесс выздоровления.
Легочная ткань довольно эластичная и растяжимая по своей природе. При легочном фиброзе эта способность теряется. Появившиеся уплотнения препятствуют газообмену. Кислород и углекислый газ не могут свободно проникать сквозь стенки альвеол.
Общее протекание фиброза легких напрямую зависит от локализации образования участков, причин их развития.
Виды и формы заболевания
Различают два типа фиброза легких:
Фиброз легких может быть:
Также выделяют стадийность процесса:
Легочный фиброз различного вида опасен для здоровья человека. Поэтому при малейших опасениях рекомендовано проконсультироваться со специалистами.
Особенности лечения
На сегодня нет единого метода, который бы был эффективным на 100 % при лечении фиброза легких. Поэтому главная задача врачей — установление причин развития болезни и прекращение их воздействия.
Современные специалисты достигли неких успехов в этой сфере. Это позволило остановить увеличение и распространение фиброзной ткани. Особенно, если заболевание развивается из-за воспаления или аутоиммунных процессов.
Лечение фиброза легких состоит из нескольких этапов:
Очаговые изменения без прогрессии рубцевания в терапии не нуждаются.
Если легкие повреждены у человека молодого возраста, возможна их пересадка. Допускается также удаление ограниченного участка рубцевания с рисками инфицирования хирургическим путем.
При фиброзе легких не нужно составлять особого меню. Рацион человека, страдающего этим заболеванием, обязательно должен быть полноценным, включать овощи, фрукты, белки, молочную продукцию. Врачи рекомендуют только пополнить свою пищу продуктами, в состав которых входит белок.
Кроме того, специалисты советуют делить пищу на день на равные дозы.
Стоит отказаться от курения. Даже самое безобидное пассивное курение способно стать причиной фиброза легких.
Желательно исключить из своей жизни различные стрессы, регулярно работать над собственным дыханием. Если не предпринимать никаких действий, последствия фиброза легких будут печальными.
Профилактика фиброза легких
Если вы хотите, чтобы ваши легкие были здоровыми, стоит придерживаться нескольких простых правил. Главными из них считаются:
Вышеперечисленные правила позволят вам защититься от пневмофиброза легких и других видов этой болезни.
Можно ли использовать народные средства для лечения
Много людей не доверяет традиционной медицине. Именно поэтому при выявлении заболевания они сначала прибегают к народным средствам. Правда, в большинстве случаев это только усугубляет проблему.
Народные рецепты могут быть лишь дополнительными средствами в лечении фиброза легких но только при условии предварительной консультации со специалистами.
Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких
Фиброзирующие варианты поражения легких, приводящие к развитию дыхательной недостаточности, относятся к числу наиболее тяжелых интерстициальных заболеваний легких. Помимо идиопатического легочного фиброза, они включают в себя хронический гиперсенситивный пневмонит, неспецифическую интерстициальную пневмонию, поражение легких в рамках системных заболеваний соединительной ткани, неблагоприятные варианты течения легочного саркоидоза и некоторые другие. Применяющаяся для лечения этих заболеваний иммуносупрессивная терапия у части пациентов оказывается неэффективной и сопряжена с высоким риском тяжелых нежелательных явлений. Изучение новых лекарственных препаратов с антифиброзным действием, в частности нинтеданиба, открывает новые возможности для лечения этой непростой группы больных.
С.В. Моисеев. Среди хронических интерстициальных заболеваний легких (ИЗЛ) наиболее тяжелыми являются варианты поражения легких, протекающие с формированием выраженного фиброза и, следовательно, дыхательной недостаточности. Хотя механизмы образования соединительной ткани при этих заболеваниях были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других нежелательных явлений [1].
М.Ю. Бровко. В начале XXI века для лечения идиопатического легочного фиброза, характеризующегося рентгенологической и гистологической картиной обычной интерстициальной пневмонии, были зарегистрированы два препарата с доказанным антифиброзным действием – нинтеданиб и пирфенидон [2,3]. Общность механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Нинтеданиб является низкомолекулярным ингибитором тирозинкиназ, блокирующим важнейшие сигнальные пути фиброгенеза в легочной ткани, в которых участвуют фактор роста тромбоцитов (PDGF), фактор роста эндотелия сосудов (VEGF) и фактор роста фибробластов (FGF) [5]. Первоначально этот препарат изучали при онкологических заболеваниях и применяли для лечения немелкоклеточного рака легкого, однако в 2014 году были завершены 52-недельные двойные слепые плацебоконтролируемые исследования INPULSIS-1 и INPULSIS-2, которые доказали способность препарата замедлять прогрессирование идиопатического легочного фиброза [2]. В целом в эти исследования были включены 1066 пациентов с идиопатическим легочным фиброзом, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день или плацебо. Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p 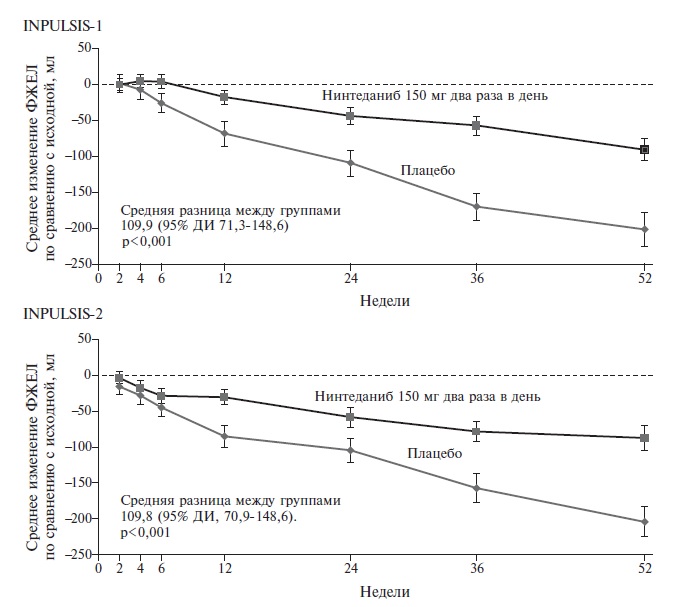
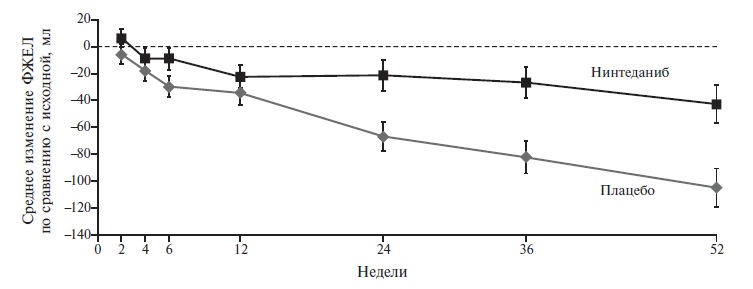
В 2018 г. после завершения двойного слепого, плацебо-контролируемого исследования SENCSIS была подтверждена эффективность назначения нинтеданиба при прогрессирующем поражении легких в рамках системной склеродермии (ССД) [6]. В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
П.И. Новиков. ССД – это аутоиммунное заболевание, в основе которого лежат генерализованная микроангиопатия и активация процессов фиброгенеза. На ранних стадиях заболевание проявляется кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением общего состояния или признаками поражения внутренних органов (в том числе одышкой), поэтому пациенты зачастую не сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых «внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
Лечение ИЗЛ в рамках ССД обычно начинают с иммуносупрессивных препаратов, в частности циклофосфамида [12]. В многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании лечение цифлофосфамидом внутривенно в течение 6 мес с последующей заменой на азатиоприн привело к увеличению ФЖЕЛ на 4,2% по сравнению с контролем [13], что указывало на способность препарата замедлять прогрессирование поражения легких при этом заболевании. Тем не менее, через 2 года после начала 12-месячной иммуносупрессивной терапии было выявлено ухудшение ФЖЕЛ и рентгенологической картины [14].
В рандомизированном, двойном слепом 24-месячном исследовании микофенолат мофетил в дозе 3000 мг/сут у больных ССД с поражением легких не отличался от циклофосфамида в дозе 2 мг/кг/сут внутрь по эффективности, но имел преимущества по переносимости [15]. Результаты небольших неконтролируемых исследований свидетельствуют о том, что ритуксимаб может улучшить течение ИЗЛ у больных ССД [16]. Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575 подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода (DLCO).
В целом приведенные данные свидетельствуют о том, что иммуносупрессивные препараты, в том числе циклофосфамид, микофенолат мофетил и ритуксимаб, позволяют стабилизировать течение ИЗЛ у части, но далеко не у всех больных ССД, что определяет необходимость применения других подходов к лечению, прежде всего с использованием препаратов, обладающих антифиброзной активностью.
С.В. Моисеев. Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
Л.А. Акулкина. Пациентка А., 50 лет. С 35 лет отмечает онемение и посинение пальцев рук на холоде. Диагностирован синдром Рейно. В 2010 г. в возрасте 40 лет появились малопродуктивный кашель и одышка при физической нагрузке. По месту жительства респираторная симптоматика трактовалась как проявление инфекционного процесса, в связи с чем периодически проводились антибактериальная терапия, инфузии эуфиллина без существенного эффекта. В 2014 г. при мультиспиральной компьютерной томография органов грудной клетки (МСКТ) выявлены признаки интерстициальной пневмонии, однако какая-либо терапия назначена не была, а дыхательная недостаточность постепенно нарастала. При контрольной МСКТ через полтора года в обоих легких, преимущественно в нижних долях, определялись участки фиброза и «сотового легкого» на фоне значительных интерстициальных изменений по типу «матового стекла» с утолщением и уплотнением легочного интерстиция и междольковых перегородок (более выражено в периферических отделах), а также внутригрудная лимфаденопатия верхней паравазальной, ретрокавальной, трахеобронхиальных и бифуркационной групп до 13 мм. Обратилась к фтизиатру, который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им. Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре 1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст. Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция, участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих легких) и серологических маркеров позволило диагностировать ССД с поражением легких. Начата комбинированная иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил, а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности синдрома Рейно, повышения толерантности к физическим нагрузкам. В мае 2017 г. лабораторные признаки активности заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+ B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г. рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+ В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет, однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и DLCO. В настоящее время обсуждается возможность назначения нинтеданиба.
М.Ю. Бровко. История заболевания пациентки де монстрирует недостаточную эффективность применявшихся иммуносупрессивных лекарственных препаратов – несмотря на лечение в течение 3 лет отмечено снижение показателей легочной вентиляции, в том числе ФЖЕЛ на 10% и DLCO на 12%. В этом случае оправдано применение антифибротической терапии, так как в исследовании SENCSIS лечение нинтеданибом у таких больных позволило замедлить нарастание респираторного дефицита у пациентов с ССД практически вдвое [6].
В.И. Шоломова. Опубликованные в 2019 г. результаты 52-недельного двойного слепого, плацебо-контролируемого исследования INBUILD подтвердили эффективность терапии нинтеданибом при практически полном спектре фиброзирующих ИЗЛ, не относящихся к ИЛФ. В исследовании приняли участие 663 пациента из 15 стран, включая Российскую Федерацию. Критериями включения были признаки интерстициального фиброза с вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ, усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких, ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
А.Ш. Янакаева. Больная К., 65 лет. В 2014 г. в возрасте 60 лет появился постоянный сухой кашель, однако к врачу не обращалась. В январе 2016 г. при диспансеризации впервые выявлены патологические признаки на рентгенограммах легких. При МСКТ обнаружены изменения по типу «матового стекла» в базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось. При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония. Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в дозе 15 мг/сут.
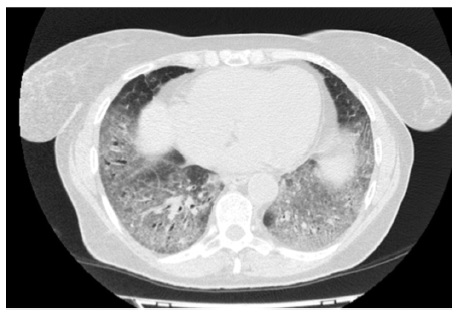
В апреле 2017 г. госпитализирована в Клинику им. Е.М. Тареева с жалобами на мучительный сухой кашель, слабость, умеренную одышку. В базальных отделах обоих легких выслушивалась крепитация. ФЖЕЛ – 91%, DLСО – 67%. Рентгенологически определялась картина неспецифической интерстициальной пневмонии. По сравнению с предыдущим исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла» существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320, слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками [18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000 мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г. начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне 2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре 2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи с чем терапию антифиброзным препаратом решено продолжить.
С.В. Моисеев. Представленные истории болезни демонстрируют варианты неблагоприятного фиброзирующего течения ИЗЛ, отличных от идиопатического легочного фиброза. Обеим пациенткам показана длительная терапия антифиброзным лекарственным препаратом – нинтеданибом в дозе 150 мг два раза в сутки. Результаты плацебо-контролируемых клинических исследований свидетельствуют о том, что лечение этим препаратом оказывает благоприятное влияние на различные фиброзирующие заболевания легких. Очевидно, что лучших результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется поражением легких и прогрессирующей дыхательной недостаточности.
Необходимость лечения нинтеданибом должна быть подтверждена в лечебном учреждении, занимающемся изучением ИЗЛ и имеющем опыт ведения таких пациентов. Нинтеданиб переносится удовлетворительно и обычно не вызывает тяжелые нежелательные реакции, поэтому препарат может применяться под наблюдением врача поликлиники. Био химические показатели целесообразно контролировать ежемесячно в течение первых трех месяцев после начала лечения, а затем ежеквартально.



