чем понижают билирубин при жильбере
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, врача общей практики со стажем в 14 лет.
Определение болезни. Причины заболевания
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
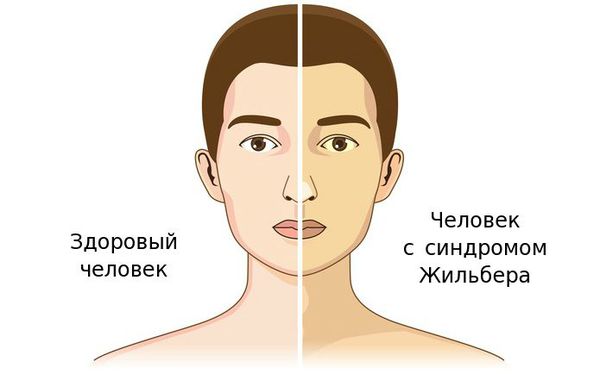
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
К провоцирующим факторам проявления синдрома можно отнести:
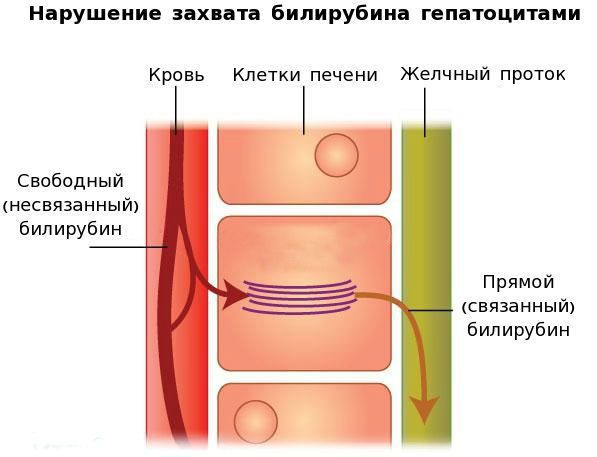
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
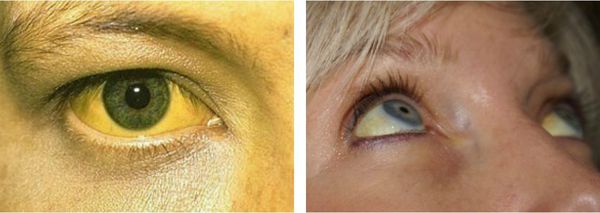
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
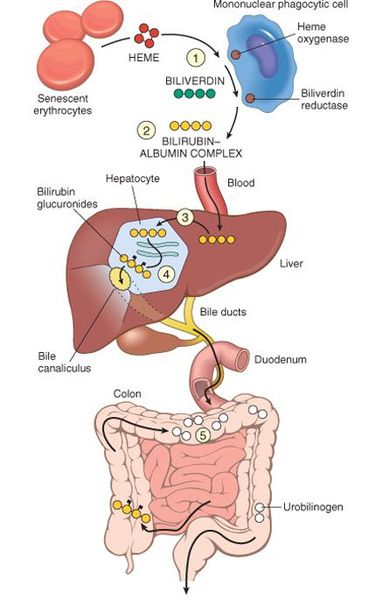
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами («жирами») клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Пациенты с синдромом Жильбера: новая тактика ведения

В 1900 г. Николя Огюст Жильбер описал врожденную доброкачественную желтуху, названную впоследствии его именем – болезнь или синдром Жильбера (СЖ). Это один из наиболее часто встречающихся вариантов функциональных (негемолитических) гипербилирубинемий. СЖ сопровождает человека всю его жизнь, попадая в поле зрения врачей самых разных специальностей. Тактика ведения таких больных обычно вызывает много вопросов. Раньше предполагалось, что СЖ не имеет неблагоприятных последствий для здоровья и не нуждается в лечении. Однако за последние годы в представлениях о заболевании появилось много нового. Нам хотелось бы рассмотреть это на примерах клинического разбора пациентов.
Итак, у всех пациентов имеются проявления желтухи за счет увеличения содержания в крови непрямой фракции билирубина. Каждому больному были проведены лабораторные исследования для исключения сифилиса, ВИЧ, вирусных, в том числе острого гепатита в 1-м случае, первично холестатических и наследственных (болезнь Вильсона-Коновалова, гемохроматоз) заболеваний печени. При этом были получены отрицательные результаты по всем маркерам в первых 3 случаях и характерные изменения для болезни Вильсона-Коновалова в 4-м – церулоплазмин крови 146 мг/л (норма 281-334 мг/л), суточная экскреция меди с мочой 382 мкг/сут (норма менее 50 мкг/сут). Исследования, касающиеся гемолитической анемии, подтвердили этот диагноз в 3-м случае.
Таким образом, в 1-м клиническом случае желтуха возникла впервые и требует уточнения. У остальных пациентов диагнозы установлены. Однако по пациенту с СЖ возникает вопрос о возможном присоединении сопутствующей гастроэнтерологической патологии. В двух последних клинических случаях следует проанализировать, почему лечение, назначенное по поводу основной патологии, не позволяет полностью купировать проявления желтухи. Возможно ли наличие СЖ у этих пациентов?
СЖ имеет высокую распространенность
До появления генетического диагноза полагали, что СЖ является редким заболеванием. В настоящее время по оценкам эпидемиологических исследований СЖ встречается от 5 до 10% в мировой популяции. Это каждый десятый житель Земного шара. По некоторым данным, количество гетерозиготных носителей может достигать 40%. Установлена высокая частота обнаружения СЖ среди населения стран Африки (до 36%), Германии (11%), Шотландии (10-13%), Испании (9%), низкая – среди азиатов (около 3%).
Среди больных СЖ преобладают мужчины (10:1).
Типичные клинические проявления и изменения лабораторно-инструментальных показателей у пациентов с СЖ
В большинстве случаев СЖ выявляется у пациентов в возрасте 12-30 лет в виде постоянной или периодически появляющейся желтушности склер и кожных покровов. В этой связи при подозрении на СЖ рекомендуется проводить осмотр больного при дневном освещении. Желтушность кожного покрова и видимых слизистых оболочек становится хорошо заметной, когда уровень билирубина в сыворотке крови достигает 43-50 мкмоль/л и выше. Как правило, интенсивность желтухи при СЖ небольшая. Максимум – иктеричность склер, слизистой оболочки рта и субиктеричность кожи. Особое внимание следует уделить выявлению окрашивания стоп, ладоней, носогубного треугольника, подмышечных впадин.
Появление или усиление желтухи провоцируется физическим или психоэмоциональным перенапряжением, голоданием, пищевыми погрешностями, интеркуррентными заболеваниями, приемом некоторых медикаментов (сульфамидов, салицилатов и др.), гиперинсоляциями. Эти эпизоды сопровождаются слабостью, повышенной утомляемостью, эмоциональной лабильностью, диспепсией (дискомфорт и невыраженные боли в области правого подреберья, подложечной области). Возможно также отсутствие вообще каких-либо жалоб и/или визуальных проявлений болезни.
Размеры печени чаще всего остаются в пределах нормы либо увеличены незначительно. В лабораторных тестах повышение билирубина в 2-5 раз (редко более) со значительным преобладанием непрямой фракции, остальные биохимические показатели крови и печеночные пробы не изменены.
При СЖ в 30% случаев повышен гемоглобин более 160 г/л, у 15% пациентов выявляется легкий ретикулоцитоз, у 12% – снижение осмотической стойкости эритроцитов. Увеличение содержания гемоглобина в крови связывают с его избыточным синтезом при повышенном уровне билирубина в крови и тканях. Вопрос о наличии скрытого гемолиза при СЖ (ретикулоцитоз, снижение осмотической стойкости эритроцитов) является темой многолетнего обсуждения.
Для диагностики СЖ применяется большое количество функциональных тестов (гипокалорийный, рифампициновый, с никотиновой кислотой и фенобарбиталом). Как пример приведем гипокалорийный тест. Ограничение пищевого рациона до 400 ккал в течение 72 ч вызывает увеличение уровня билирубина у всех людей. В случае отсутствия дефекта гена уровень билирубина редко повышается более чем на 9,6 мкмоль/л у мужчин и 4,1 мкмоль/л у женщин. Данный эффект более выражен у лиц с СЖ, при этом тест обладает большей чувствительностью у мужчин, чем у женщин.
Современные представления о патогенезе СЖ
В течение суток в организме человека образуется от 200 до 450 мг билирубина. В крови билирубин присутствует в двух фракциях – непрямой билирубин (образуется при распаде гемоглобина и ферментных систем с участием гема, не растворим в воде, но хорошо растворим в жирах, токсичен) и прямой (растворим в воде, менее токсичен, выводится из организма с желчью). Прямой билирубин образуется в печени после связывания с глюкуроновой кислотой, поэтому его также называют связанным или конъюгированным. Ключевым в этом процессе является фермент уридиндифосфатглюкуронилтрансфераза (УДФГТ). В условиях недостатка УДФГТ непрямой билирубин не может быть связан в печени, что приводит к его повышению в крови и развитию желтухи.
Недостаток УДФГТ является отличительным признаком СЖ и связан с мутациями находящегося на 2-й паре хромосом (2q37) гена UGT1A1, кодирующего фермент. У пациентов с СЖ последовательность тимидин-аденин (ТА) повторов, которая служит сайтом присоединения ДНК-зависимой РНК-полимеразы, содержит один лишний повтор ТА (7 вместо 6). В результате – экспрессия гена понижена. В гомозиготном состоянии это приводит к снижению функциональной активности фермента примерно на 30%, у гетерозиготных носителей – на 14%.
СЖ может развиваться при трансплантации печени реципиенту от донора с генетическим дефектом. У этих больных после операции выявляется изолированное повышение билирубина за счет непрямой фракции, что свидетельствует о доминирующей роли печеночной УДФГТ в метаболизме билирубина.
Генетический анализ при СЖ
В настоящее время ученые имеют возможность объективного генетического анализа, который подтверждает или не подтверждает диагноз СЖ. Материал для исследования – плазма крови. Обнаружение мутантного гена проводится путем прямой ДНК-диагностики посредством анализа промоторной области гена UGT1A1 на количество ТА-повторов. В норме (ТА)6/(ТА)6 – 6 ТА-повторов, соответствует нормальному генотипу; (ТА)6/(ТА)7 – динуклеотидная вставка (7 ТА-повторов) в гетерозиготной форме; (ТА)7/(ТА)7 – динуклеотидная вставка (7 ТА-повторов) в гомозиготной форме. 7 ТА-повторов в промоторной области гена UGT1A1 свидетельствует о снижении функциональной активности фермента УДФГТ и указывает на наличие СЖ.
Данное заболевание наследуется по аутосомно-рецессивному типу. Ниже приведены некоторые варианты передачи СЖ потомству. Если оба родителя страдают СЖ, то все их дети будут больны. Если один из родителей является носителем аномального гена, а другой болен, то вероятность заболевания у ребенка будет равняться 50%. Если один из родителей – носитель, а другой здоров, то 50% детей будут являться носителями, а 50% будут здоровы. Если оба родителя являются носителями этого синдрома, то вероятность рождения больных детей будет составлять 25%, носителями будут 50%, а остальные 25% окажутся здоровыми.
СЖ в аспекте фармакогенетики
В целом группа ферментов УДФГТ участвует в метаболизме большого количества веществ: гормонов (стероидные гормоны, гормоны щитовидной железы), катехоламинов, эндогенных метаболитов (желчные кислоты, билирубин), лекарств и их метаболитов, а также токсинов, включая канцерогены. В этой связи у лиц с наличием инсерции в промоторе гена UGT1A1 при приеме многих лекарственных препаратов, так называемых аглюконов, возможна манифестация СЖ. Для выведения из организма они должны, как и билирубин, соединиться с глюкуроновой кислотой, нагружая тот же самый фермент – УДФГТ, и, соответственно, вытесняя билирубин. В результате этого появляется желтуха. К слову, ингибированием процессов глюкуронизации собственными стероидными гормонами объясняют и высокую частоту распространенности СЖ среди мужчин с манифестацией заболевания в период полового созревания.
Что касается клинических исследований препаратов, для фармакологов важно различать истинную гепатотоксичность препарата и реакцию отдельных пациентов с СЖ. Так, при испытании тоцилизумаба, перспективного препарата для лечения ревматоидного артрита, у 2 из 1187 участников был высокий подъем уровня билирубина. Впоследствии оказалось, что оба пациента страдали СЖ (Lee J.S., Wang G., Martin N. et al., 2011). Это вывело препарат из под подозрения в истинной гепатотоксичности. Другой пример – противовирусная терапия хронического гепатита С интерферонами с рибавирином. В процессе лечения подъем уровня билирубина в 17 раз был отмечен у 2 пациентов с СЖ. Отмена рибавирина привела к нормализации показателей билирубина (Deterling K. et al., 2009).
Сочетание СЖ с заболеваниями желудочно-кишечного тракта
Наиболее часто при СЖ выявляются заболевания пищевода, желудка, двенадцатиперстной кишки и желчевыводящих путей. Это обусловлено эмбриогенетическим сродством и функциональной связью между печенью, билиарным трактом и верхними отделами пищеварительного тракта, нарушением состава и реологических свойств желчи, характерных для СЖ, а также снижением детоксикационной функции печени. Установлено, что СЖ вносит существенный вклад в развитие желчнокаменной болезни (ЖКБ). В частности, исследование 2009 г., в ходе которого 198 пациентов с ЖКБ и 152 человека без таковой были обследованы генетически на СЖ с разделением (ТА)6/(ТА)6 – гомозиготы без патологии; (ТА)6/(ТА)7 – гетерозиготы по СЖ; (ТА)7/(ТА)7 – гомозиготы по СЖ. В первой группе оказалось (ТА)6/(ТА)6 – 30,0%, (ТА)6/(ТА)7 – 46,5%, (ТА)7/(ТА)7 – 23,3%, во второй (ТА)6/(ТА)6 – 48,5%, (ТА)6/(ТА)7 – 33,5%, (ТА)7/(ТА)7 – 17,8%. Таким образом, среди тех, кто имеет СЖ, с высокой достоверностью (р=0,01) чаще встречается ЖКБ (Tsezou A., Tzetis M., Giannatou E., 2009). В 2010 г. был опубликован метаанализ, в который были включены 2816 пациентов с ЖКБ и 1617 человек без нее (Buch S., Schafmayer C., Volzke H. et al., 2010). Выяснилось, что больные с СЖ имеют высокий риск ЖКБ (р=0,018). При этом риск ЖКБ у мужчин увеличивается на 21,2% (р=0,046).
Нарушения со стороны нижних отделов пищеварительного тракта при СЖ чаще имеют функциональный характер. В литературе появились публикации о более редкой встречаемости среди пациентов с СЖ колоректального рака и болезни Крона.
Результаты диагностического поиска в приведенных клинических случаях
Наши пациенты относятся к представителям европейской популяции, следовательно, имеют высокий риск возникновения СЖ. Все участники – пациенты молодого возраста с невысокой интенсивностью желтухи за счет непрямой фракции билирубина. В каждом случае понятен фактор, провоцирующий появление или усиление желтухи с явлениями общей астенизации. В 1-м и 4-м случаях прослеживается наследственный анамнез.
Клинический случай № 1
После появления у женщины желтухи противопростудное средство, содержащее парацетамол, было отменено. Проводилась дезинтоксикационная терапия. При контрольном исследовании печеночного комплекса через 2 нед после выздоровления от ОРВИ показатели билирубина и АЛТ соответствовали норме. УЗИ органов брюшной полости отклонений не выявило.
Учитывая наследственный анамнез, женщина прошла генетическое обследование, которое подтвердило наличие СЖ – (ТА)7/(ТА)7.
Вывод: СЖ манифестировал на фоне ОРВИ и применения высокой дозы парацетамола, одним из основных путей метаболизма которого является конъюгация с глюкуронидами в печени.
Клинический случай № 2
Пациенту проведены дополнительные исследования. УЗИ органов брюшной полости. Размеры желчного пузыря 81×28 мм, стенка утолщена до 3 мм, содержимое – густая желчь, множественные камни, максимальный диаметр 6 мм. Заключение: ЖКБ, признаки хронического холецистита.
Вывод: у молодого мужчины с СЖ сформировалась ЖКБ, которая привела к усилению болевых и диспепсических проявлений.
Клинический случай № 3
Прием пациентом фенобарбитала в течение 5 дней позволил достичь снижения уровня непрямого билирубина в крови. Это может быть расценено как позитивный результат, подтверждающий наличие СЖ. Действие фенобарбитала основано на ферментативной индукции и активации фермента УДФГТ. К манифестации СЖ, вероятно, привел сильный стресс, который испытал больной.
Вывод: наличие у пациентов гемолитической анемии не исключает СЖ, а лишь утяжеляет его течение.
Клинический случай № 4
Учитывая сложность диагностического процесса и наследственный анамнез, мужчина прошел генетическое обследование, которое подтвердило наличие и болезни Вильсона-Коновалова, и СЖ – (ТА)7/(ТА)7. В данном случае имеет место постоянно повышенный уровень билирубина за счет непрямой фракции с повышением содержания их в крови и усилением желтухи в ответ на типичные провоцирующие факторы при СЖ.
Вывод: СЖ может сочетаться с другими наследственными заболеваниями. Так, описаны сочетания СЖ с синдромами Марфана, Элерса-Данло.
Особенности тактики ведения пациентов с СЖ
Таким образом, СЖ – это наследственное нарушение обмена билирубина, своевременное распознавание и коррекция которого имеет существенное значение для пациента. В случаях, представленных нами, для постановки диагноза были использованы известные клинические и лабораторные критерии. Современный этап развития медицины, сделавший возможным объективное подтверждение диагноза СЖ генетическими методами, ставит его диагностику на новую ступень. Из приведенных выше примеров видно, что даже у фенотипически (внешне) здоровых родителей может родиться ребенок с СЖ. Поэтому, если в родословной человека имеются случаи данного заболевания, рекомендуется пройти генетическое обследование на предмет мутации генов, отвечающих за развитие СЖ. По результатам анализов врач-генетик может определить, является ли человек носителем и как будет проходить наследование синдрома.
Учитывая высокую частоту СЖ в популяции, проведение генетического анализа рекомендуется также перед началом лечения с использованием лекарственных препаратов, обладающих гепатотоксическими эффектами. В частности, это позволяет прогнозировать риск осложнений при терапии иринотеканом у пациентов с онкологическими заболеваниями.
Немедикаментозное лечение и профилактика осложнений СЖ включают устранение факторов риска: ведение правильного образа жизни (отказ от вредных привычек, правильное питание и т.п.), борьбу со стрессами (аутогенные тренировки), повышение иммунитета. Очень важной для пациента является минимизация лекарственных воздействий. В первую очередь это касается приема анаболических стероидов, глюкокортикоидов, андрогенов, рифампицина, циметидина, левомицетина, стрептомицина, салицилата натрия, ампициллина, кофеина, этинилэстрадиола, парацетамола, диакарба, ментола, а также целого ряда других препаратов, в метаболизме которых участвует УДФГТ.
Эпизоды желтухи, как правило, разрешаются самостоятельно, без применения лекарственных средств. Однако, если уровень билирубина превышает 50 мкмоль/л и сопровождается плохим самочувствием, возможен прием фенобарбитала коротким курсом (1,5-2,0 мг/кг, или 30-200 мг/сут в 2 приема в течение 2-4 нед). Фенобарбитал входит в состав таких препаратов, как корвалол, барбовал, валокордин, поэтому часто применяют эти препараты (20-30-40 кап 3 р/сут в течение 1 нед), хотя эффект из-за низкой дозы фенобарбитала отмечается лишь у части пациентов. К индукторам ферментов монооксидазной системы гепатоцитов, кроме фенобарбитала, относят флумецинол, назначаемый в дозе 0,4-0,6 г (4-6 кап) 1 раз в неделю или по 0,1 г 3 раза в день в течение 2-4 нед (в Украине не зарегистрирован). Под влиянием этих препаратов снижается уровень билирубина в крови, исчезают диспепсические явления, но в процессе лечения возникают вялость, сонливость, атаксия. В таких случаях эти лекарственные средства назначают в минимальных дозах перед сном, что позволяет принимать их длительное время.
Выведение прямого билирубина возможно с помощью усиленного диуреза, применения активированного угля или других сорбентов, адсорбирующих билирубин в кишечнике. Посредством фототерапии достигается разрушение непрямого билирубина, фиксированного в тканях, тем самым высвобождаются периферические рецепторы, которые могут связать новые порции билирубина, предотвращая его проникновение через гематоэнцефалический барьер.
Доброкачественность СЖ, состоящая в отсутствии исхода в цирроз печени, не исключает усугубление явлений дисфункции желчевыделительной системы, развитие хронического холецистита и формирование ЖКБ. Это наглядно подтверждается тремя из приведенных клинических случаев. В этой связи пациентам с СЖ в индивидуальном порядке назначаются гепатопротекторы – препараты урсодезоксихолевой кислоты (УДХК), фосфолипиды, силибинин, экстракт плодов расторопши пятнистой, экстракт листьев артишока, а также витаминотерапия, особенно витамины группы В.
На наш взгляд, чтобы предотвратить или уменьшить поражение билиарного тракта на фоне СЖ, наиболее целесообразно применение УДХК. Кроме ее известных позитивных эффектов, в эксперименте на крысах было показано, что УДХК способна уменьшать чувствительность нервных клеток к поражающему действию непрямого билирубина. Так, в работе (Silva R.F., Rodrigues C.M., Brites D.Y., 2001) оценивали апоптоз в культуре нервных клеток (нейроны и астроциты) после инкубации с непрямым билирубином без и в присутствии УДХК. В первом варианте было отмечено повышение апоптоза клеток до 7 раз. Присутствие УДХК обеспечило защиту 60% нервных клеток в культуре, уровень апоптоза повысился чуть более 6%. Это актуальный момент, учитывая, что пациенты с СЖ имеют склонность к психосоматическим расстройствам.
УДХК используют в дозе 10-12 мг/кг в сутки. Возможно ее назначение в виде лечебного курса до разрешения процесса, например, устранения билиарного сладжа, профилактическими курсами по 3 мес 2 раза в год (весна-осень), либо в виде постоянного приема профилактической дозы 250 мг/сут однократно вечером.
В заключение необходимо отметить постепенное увеличение среди населения количества скрытых дефектов обмена, которые рано или поздно могут себя проявить. Перед учеными стоит задача создания условий для разумного и в то же время достаточно безопасного вмешательства в материальную основу наследственности с целью исправления таких дефектов. Это направление для будущих исследований.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Інгібітори протонної помпи (ІПП) є одними з найчастіше вживаних препаратів серед усіх вікових груп, як для монотерапії, так і профілактики небажаних ускладнень із боку шлунково-кишкового тракту внаслідок прийому агресивних лікарських засобів. Часте застосування ІПП у комбінованій допоміжній терапії висуває високі вимоги щодо ефективності, безпеки, доступності цих препаратів, а також їхнього сприятливого профілю лікарських взаємодій. У цій статті представлено актуальну інформацію щодо особливостей фармакодинаміки ІПП, зокрема їхнього впливу на ефективність комбінованої антитромботичної терапії. Також подано огляд нещодавньої європейської настанови з лікування гастроезофагеальної рефлюксної хвороби (ГЕРХ), де за сукупністю критеріїв ефективності, безпеки й економічної доцільності було визначено препарат вибору серед ІПП.
Підшлункова залоза (ПЗ) – це унікальний орган, який поєднує в собі елементи відразу двох систем організму: ендокринної та травної. Проте при цукровому діабеті (ЦД) за рахунок щільного анатомо-фізіологічного зв’язку між ацинусами ПЗ й острівцями Лангерганса патологічні процеси в ендокринному апараті органа можуть зумовлювати порушення екзокринної функції, що обтяжує контроль глікемії в пацієнта навіть за умови адекватного лікування.
7-8 жовтня відбулася конференція «Актуальні питання діагностики, лікування та реабілітації гастроентерологічних хворих». У межах цього наукового заходу значна увага була приділена проблемам реабілітації пацієнтів із COVID‑19, у яких з’явилися ускладнення з боку шлунково-кишкового тракту (ШКТ), і курації хворих з уже існуючими захворюваннями ШКТ на тлі коронавірусної інфекції. Вичерпні відповіді на ці запитання надала завідувачка кафедри медико-соціальної експертизи та реабілітації факультету післядипломної освіти ДЗ «Дніпровська медична академія МОЗ України», доктор медичних наук, професор Інна Станіславівна Борисова.
Неалкогольна жирова хвороба печінки (НАЖХП) асоційована із прогресуючим перебігом і несприятливими наслідками COVID‑19 незалежно від наявності ожиріння чи інших коморбідних станів. На науково-практичній конференції з міжнародною участю «Поліморбідна патологія органів травлення в практиці сімейного лікаря», яка відбулася 4-5 листопада в м. Дніпро, широко охопили увагою підходи до лікування НАЖХП. Препарат Укрлів (урсодеоксихолева кислота – УДХК – від фармацевтичної компанії «Кусум») наділений цими якостями, ефективно пригнічує прогресування НАЖХП, тим самим знижуючи ризики розвитку цирозу та гепатоцелюлярної карциноми. Для комплексного лікування НАЖХП доцільно застосовувати подвійну терапію з використанням піоглітазону (Глютазон, «Кусум»). Цей препарат також дозволяє не лише відновлювати порушені фізіологічні функції печінки, а й досягати стійкого глікемічного контролю, що є украй важливим для пацієнтів із цукровим діабетом (ЦД) 2 типу.