чем пахнет болезнь паркинсона
Паркинсонизм
Паркинсонизм или синдром Паркинсона – это патологическое состояние, которое проявляется скованностью в движениях, непроизвольным дрожанием конечностей и головы, постоянным мышечным гипертонусом. Как правило, паркинсонизм связывают с различными органическими патологиями головного мозга.
Не стоит путать синдром Паркинсона и болезнь Паркинсона – болезнь считается самостоятельным заболеванием со схожими симптомами. А паркинсонизм – это синдром, который может развиваться вторично (например, после воздействия токсинов, черепно-мозговых травм).
Симптомы паркинсонизма
У паркинсонизма есть ряд характерных симптомов, которые позволяют четко дифференцировать это заболевание:
Даже характерные симптомы не гарантируют достоверную диагностику. Поэтому необходимо пройти полноценное обследование.
Формы
Выделяют два основных типа паркинсонизма:
Выделяют несколько форм вторичного заболевания, которые классифицируют исходя из предпосылок заболевания.
Причины
Основная причина заболевания – это отмирание нейронов в области головного мозга, которая отвечает за координированное действие мышц и мышечный тонус. Также неврологи отметили недостаток дофамина в этой области мозга, который вызывает такие симптомы, как тремор и мышечная скованность. А вот факторов риска или предпосылок довольно много. Они не обязательно напрямую приводят к развитию заболевания, но значительно повышают его вероятность.
Выявить точную причину может только врач-невролог после полноценного обследования.
Наши врачи
Диагностика
Сначала врач собирает анамнез. Пациенту задают такие вопросы:
Затем врач проводит стандартный для подобных жалоб неврологический осмотр: оценивает походку, мышечный тонус, характер тремора и т.д.
Следующий этап – фармакологический тест. Он заключается в назначении пациенту препарата на основе дофамина или аналогичных веществ. Если есть паркинсонизм, то это способствует снижению симптоматики.
Нередко требуется консультация психолога для оценки когнитивной и эмоциональной сферы. Обычно для этого используют стандартные тесты и опросники.
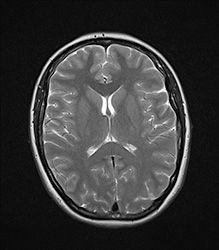
Подтвердить диагноз можно на МРТ – обследование покажет патологические участки в области, отвечающей за мышечный тонус и координацию. Эти высветленные участки показывают отмершие нейроны. МРТ позволяет также подтвердить или исключить опухоль.
Диагностика заканчивается постановкой диагноза, в соответствии с которым назначают лечение.
Лечение паркинсонизма
Лечение сходно и для синдрома Паркинсона, и для болезни Паркинсона. Главное отличие заключается в том, что при синдроме требуется установить причину и начать лечение основного заболевания.
Рекомендуются следующие методы лечения:
Эффективность медикаментозного лечения оценивают по снижению симптоматики. Если консервативная терапия оказалась неэффективной, то назначают хирургическое вмешательство.
Оперативное лечение: к нему прибегают при неэффективности медикаментозного. Операция называется стереотаксической деструкцией ядер таламуса и заключается в разрушении области мозга, отвечающей за чувствительность. Процедура позволяет снизить симптоматику и вернуть способность к нормальному движению.
В клинике ЦЭЛТ работают квалифицированные неврологи, которые предлагают терапию синдрома Паркинсона. Современные методы диагностики позволяют врачам точно установить причину болезни, а многолетний опыт – назначить максимально эффективное лечение.
Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний
Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний
Ученые из Калифорнийского университета в Сан-Диего показали успешную трансформацию астроцитов в нейроны in situ для лечения болезни Паркинсона. Поможет ли эта работа приблизиться к созданию успешной терапии?
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Болезнь Паркинсона до сих пор остается неизлечимой. Однако в июне 2020 года в журнале Nature вышла статья, способная произвести революцию в терапии этого недуга. В этой работе мы рассмотрим, какие предыдущие исследования привели к такому результату и как это может повлиять на будущее всей нейробиологии.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Дисклеймер
Обычно «Биомолекула» не публикует статьи по одинаковым инфоповодам, но в этом году мы приняли две работы, базирующиеся на одной и той же публикации в Nature 2020 года. Статья, которую вы читаете, — обзорная, а вот и ее парная новостная [16].
Болезнь Паркинсона является вторым по распространенности нейродегенеративным расстройством. Она характеризуется отмиранием нейронов в черной субстанции мозга. Существующая терапия направлена на ограниченное сдерживание заболевания. Эффективного лекарства до сих пор не существует. Недавнее исследование может в корне изменить плачевную ситуацию. Хао Цянь из Калифорнийского университета в Сан-Диего (США) вместе с коллегами из Пекинского университета (Китай) продемонстрировал успешное превращение астроцитов в нейроны in situ на мышиной модели болезни Паркинсона. Однако начнем с общей характеристики этого заболевания.
Болезнь Паркинсона: история и молекулярный патогенез
В 1817 году английский врач Джеймс Паркинсон [1] опубликовал работу «Эссе о дрожательном параличе», в которой дал описание неврологического недуга, а также провел анализ и выявил общие закономерности. В названии отражено необычное сочетание основных симптомов — тремор, скованность мышц и неспособность удерживать равновесие [2].
Кстати, одним из ученых, который помог разгадать тайны патогенеза болезни Паркинсона, стал русский невропатолог Константин Николаевич Третьяков, занимавший в 1916–1923 годах должность заведующего лабораторией мозга имени Шарко кафедры нервных болезней Парижского университета (Франция). Он предложил нигральную теорию патогенеза болезни Паркинсона, согласно которой, проявления заболевания были связаны с утратой черной субстанции головного мозга.
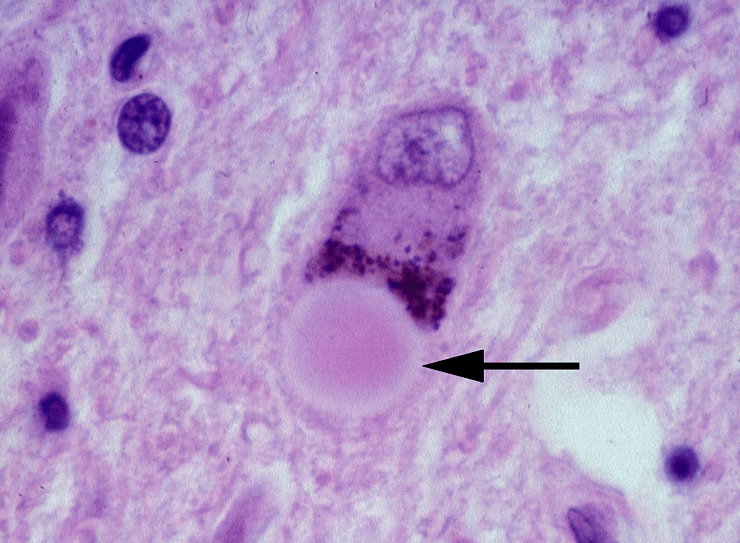
Сегодня известно, что болезнь Паркинсона развивается вследствие дегенерации дофаминергических нейронов в черной субстанции, что приводит к снижению уровня вырабатываемого дофамина — нейромедиатора, ответственного за чувство удовлетворения и привязанности. Клинические проявления связаны с нейротоксическим эффектом: по мере прогрессирования заболевания в клетках накапливается белок альфа-синуклеин [3]. Альфа-синуклеин в норме задействован в механизме транспорта и высвобождения везикул с нейротрансмиттерами. Однако у пациентов с болезнью Паркинсона наблюдается фосфорилирование и аномальное свертывание этого белка с образованием агрегатов — телец Леви (рис. 1). В 2018 году группа ученых из научно-исследовательского института Скриппса (США) обнаружила, что фосфорилированная форма альфа-синуклеина локализуется в митохондриях, вызывая их фрагментацию [4].
Рисунок 1. Тельце Леви в нейроне черной субстанции головного мозга
Возможности сегодняшней терапии
Сейчас существует только симптоматическое лечение, направленное на облегчение имеющихся проявлений заболевания. Одним из наиболее эффективных и широко применяемых лекарств является леводопа, или 3-гидрокси-L-тирозин [5]. Леводопа — биологический предшественник дофамина. Помимо леводопы, иногда используется ряд других лекарственных средств. Агонисты дофаминовых рецепторов имеют химическую структуру, похожую на дофамин, и за счет этого могут стимулировать его рецепторы [6]. Ингибиторы моноаминоксидазы B способны блокировать высвободившийся дофамин и продлевать время его действия. Ингибиторы катехол-О-метилтрансферазы подавляют распад принятой леводопы и удлиняют время ее действия в организме.
Также для терапии болезни Паркинсона применяют так называемые нейротрофические факторы — регуляторные белки, которые поддерживают жизнеспособность и функционирование нейронов. Хотя было проведено множество исследований по использованию нейротрофических факторов в клинической практике, у них есть ряд недостатков. Во-первых, они нуждаются в точной доставке к месту назначения. Для этого используют специальные катетеры. Во-вторых, нейротрофические факторы целесообразно использовать только в том случае, если у пациента еще не повреждены аксоны дофаминергических нейронов. Если же транспортная система в черной субстанции нарушена или уничтожена, то такое лечение не даст никаких положительных эффектов [7].
Часть из вышеперечисленных способов борьбы с болезнью широко используется, однако ничего из этого не поможет вернуть человеку его утраченные нейроны. Поэтому были попытки разработать терапию, направленную на восстановление популяции дофаминергических нейронов. В 2018 году группа ученых из японского Университета Киото [8] пересадила в мозг пациента индуцированные плюрипотентные стволовые клетки (ИПСК) [9], способные превращаться в любую клетку организма. Перед тем как применять ИПСК для лечения болезни Паркинсона у человека, были проведены исследования эффективности и безопасности этой терапии на приматах [10]. У семи людей изъяли ИПСК для их последующего превращения в клетки нейронного ряда. Для трансформации использовали двойное подавление сигнального пути SMAD, участвующего в процессах клеточного роста, дифференциации и смерти. За специализацию дофаминергических нейронов в черной субстанции отвечает сигнальный путь Sonic hedgehog (Shh). Подавление SMAD и активация Shh привели к дифференцировке ИПСК в клетки-предшественники дофаминергических нейронов, которые начали синтезировать нейронные маркеры [11]. Однако трансплантация стволовых клеток для лечения болезни Паркинсона у человека не применяется из-за сложности и недостаточных данных об эффективности.
Астроциты — возможное лекарство?
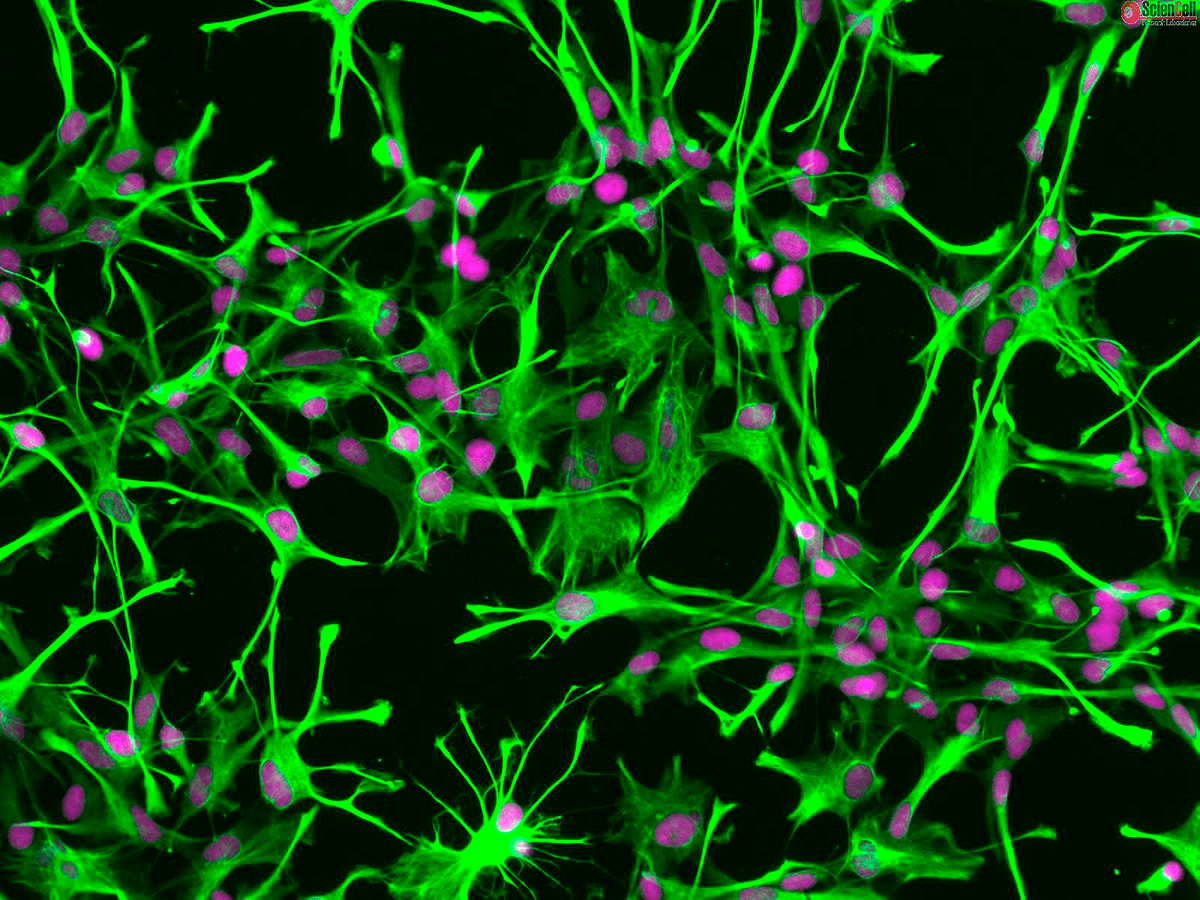
В последнее время было опубликовано несколько научных работ по превращению различных клеток в дофаминергические нейроны. В основном, исследователи останавливали свой выбор на астроцитах — клетках, поддерживающих жизнедеятельность нейронов. Свое название они получили за характерную звездчатую форму (рис. 2). В обязанности этих клеток входит обеспечение метаболических потребностей нейронов, участие в своевременном высвобождении нейротрансмиттеров из нервных окончаний, запас питательных веществ и регуляция активности нейронов.
Рисунок 2. Вспомогательные клетки нервной системы — астроциты. В норме они обеспечивают жизнедеятельность нейронов, но воздействуя на молекулярные процессы, протекающие в астроцитах, можно добиться их «превращения» в нейроны любого типа.
Но больше всего ученых интересует их репаративная функция. В 2014 году группа ученых из Лундского университета и Каролинского института обнаружила, что при повреждении нервной ткани после инсульта астроциты способны замещать погибшие нейроны [12]. При этом у них «выключается» сигнальный путь Notch1, имеющий ключевое значение в процессах пролиферации и дифференцировки клеток. В здоровом головном мозге этот путь активен и блокирует превращение астроцитов в нейроны. Однако после инсульта этот механизм подавляется, и астроциты могут начать трансформироваться в нейроны.
Идея для исследования, проведенного группой из Калифорнийского университета, не нова. Еще в 2017 году группа шведских ученых с помощью вирусных векторов превратила человеческие астроциты в нейроны in vitro. После этого трансформировали и мышиные астроциты, но уже in vivo. Для репрограммирования они использовали три транскрипционных фактора (NEUROD1, ASCL1 и LMX1A) и микроРНК miR218 [13]. Трансформация астроцитов in vitro была улучшена с помощью молекул, способных провоцировать перестройку хроматина и активировать несколько сигнальных путей.
Однако в исследовании 2020 года предлагается куда более простой метод перепрограммирования астроцитов: достаточно просто заблокировать производство одного-единственного белка.
Механизм трансформации астроцитов
В качестве мишени для репрограммирования астроцитов Цянь и коллеги выбрали РНК-связывающий белок PTB1 [14]. Этот белок синтезируется в астроцитах и ингибирует дифференцировку в нейроны. Снижение производства PTB1 вызывает продукцию его нейронного варианта nPTB1.
Сначала ученые провели трансформацию астроцитов in vitro. Астроциты выделили из среднего мозга и коры мыши и из коры человека. Исследователи использовали РНК-шпильку к гену Ptbp1, который кодирует белок PTB1. РНК-шпильки работают по принципу РНК-интерференции: они взаимодействуют с информационной РНК конкретного гена и вызывают ее деградацию, что приводит к неспособности клетки произвести белок. Уровень PTB1 в астроцитах упал, что привело к трансформации астроцитов в нейроны.
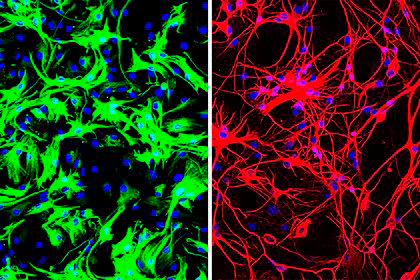
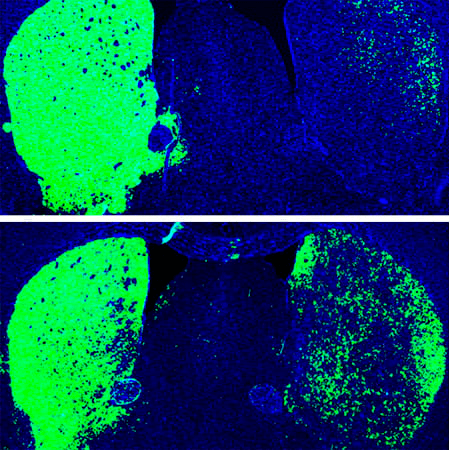
Затем исследователи перешли к экспериментам in vivo: они истощали запасы белка PTB1 в мозге мыши. Симптомы болезни Паркинсона у мышей были вызваны с помощью токсичного аналога дофамина, 6-OHDA, вызывающего гибель дофаминергических нейронов. Цянь и коллеги использовали трансгенных мышей, продуцирующих cre-рекомбиназу. Это позволяло нацелить вирусный вектор непосредственно на астроциты. Чтобы убедиться, что вирус достиг своей цели, в него встроили ген красного флуоресцентного белка. В составе вирусного вектора была маленькая РНК-шпилька (shPTB), которая блокировала ген Ptbp1. Такая стратегия также привела к преобразованию астроцитов в нейронные клетки и восстановлению двигательной активности (рис. 3).
Рисунок 3. Слева: астроциты мыши. Справа: нейроны, полученные в ходе репрограммирования астроцитов.
Результаты
Цянь и коллеги обнаружили, что истощение запасов PTB1 в астроцитах стимулирует их трансформацию в нейроны. Результат такой трансформации зависит от области мозга, в которой находятся целевые астроциты. Обнаружено, что астроциты в среднем мозге синтезируют низкие уровни факторов транскрипции Lmx1a и Foxa2. Эти факторы являются маркерами предшественников дофаминергических нейронов во время развития среднего мозга. Однако истощение белка PTB1 усиливало продукцию этих факторов транскрипции в астроцитах среднего мозга. С другой стороны, воздействие на корковые астроциты приводило к увеличению синтеза факторов транскрипции, характерных для корковых нейронов.
Спустя 4 недели после воздействия на астроциты in vitro 50–80% клеток стали морфологически похожи на нейроны и дали положительный результат на нейронные маркеры TUJ1 и MAP2.
При экспериментах in vivo спустя 3 недели после введения shPTB около 20% клеток, получивших красный флуоресцентный белок, синтезировали маркер нейронов NeuN. После 10 недель было уже около 80% клеток с NeuN. При этом клетки переставали продуцировать GFAP — белок, присутствующий в астроцитах.
Спустя 12 недель 30–35% этих клеток трансформировались в дофаминергические нейроны. Другими словами, перепрограммирование астроцитов помогло восстановить более 600 погибших дофаминергических нейронов (рис. 4).
Рисунок 4. Мозг мыши с «односторонней» болезнью Паркинсона. Сверху — до репрограммирования с помощью shPTB. Снизу — после. Зеленым показаны дофаминергические нейроны.
Более того, новоиспеченные нейроны стали активно производить дофамин. Воздействие 6-OHDA привело к снижению уровня нейромедиатора до 25% от нормальных показателей. После терапии концентрация дофамина поднялась до 65% нормального уровня.
Будет ли создана новая терапия болезни Паркинсона?
Пока что слишком рано говорить о перспективах использования метода репрограммирования астроцитов для лечения болезни Паркинсона у реальных пациентов. Однако уже сейчас можно сказать, что это исследование помогло понять, как лучше подступиться к созданию новых направлений терапии этого недуга. Хотя эта многообещающая терапевтическая стратегия в будущем может быть применима и для лечения других нейродегенеративных заболеваний, сами авторы указывают, что «применение нашего подхода к людям потребует преодоления многих препятствий, включая возрастные ограничения перепрограммирования и потенциальные побочные эффекты». Вдобавок, в дальнейших экспериментах необходимо определить, сохранят ли перепрограммированные клетки свою функциональную активность в течение длительных промежутков времени.
Стандарты лечения болезни Паркинсона
Статья основана на положениях «Протокола ведения пациентов с болезнью Паркинсона», разработанного группой экспертов, в которую вошли ведущие отечественные специалисты по болезни Паркинсона (БП), и утвержденного Минздравсоцразвития РФ в 2005 г. Положения Протокола основаны на анализе в соответствии с принципами доказательной медицины контролируемых исследований, проведенных в нашей стране и за рубежом [1, 2, 4–7, 9–11, 13, 15], и в целом соответствуют недавно опубликованным рекомендациям по лечению БП Европейской федерации неврологических обществ [8] и Американской академии неврологии [12, 14, 16]. Текст Протокола опубликован в журнале «Проблемы стандартизации в здравоохранении» [3]. В Протоколе используется следующая шкала убедительности доказательств данных: А — доказательства убедительны (есть веские доказательства предлагаемому утверждению), B — относительная убедительность доказательств (есть достаточно доказательств в пользу того, чтобы рекомендовать данное предложение), C — достаточных доказательств нет (имеющиеся доказательства недостаточны для вынесения рекомендаций, но они могут быть даны с учетом иных обстоятельств).
Начальный этап лечения
Общие принципы. Поскольку на данный момент нейропротекторный потенциал ни одного средства при БП убедительно не доказан, лечение основывается главным образом на симптоматическом действии противопаркинсонических средств, которые принято назначать в том случае, когда хотя бы одно из проявлений заболевания приводит к ограничению жизнедеятельности пациента.
Лечение начинается с монотерапии. Если препарат оказался неэффективным (нет регресса симптоматики в течение месяца после достижения оптимальной дозы) или плохо переносится, его заменяют средством той же или другой фармакологической группы. При выборе препарата и его дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. При частичном эффекте (недостаточное улучшение функций) к принимаемому препарату последовательно добавляют лекарственные средства иной фармакологической группы.
Принципы выбора противопаркинсонического препарата. Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (табл.).
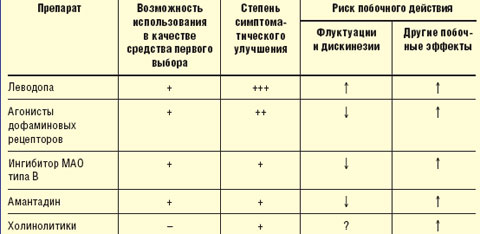 |
| Таблица Выбор препарата для начального лечения болезни Паркинсона |
У лиц моложе 50 лет при умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы (МАО) типа В (селегилин), амантадин, антихолинергические средства (тригексифенидил, бипериден).
Лечение предпочтительнее начинать с одного из агонистов дофаминовых рецепторов, которые хотя и не позволяют достичь того же уровня симптоматического контроля, как препараты леводопы, способны обеспечить поддержание уровня жизнедеятельности пациентов в течение длительного времени, отсрочить назначение леводопы и тем самым развитие осложнений долгосрочной терапии леводопой (уровень А). Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности, и избежать побочного действия (уровень С). Неэрголиновые агонисты (пирибедил, прамипексол) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин).
Лечение пирибедилом начинают с дозы 50 мг 1 раз в день (днем или вечером — после основного приема пищи), в дальнейшем суточную дозу увеличивают на 50 мг 1–2 раза в неделю — до достижения необходимого эффекта, но не выше 250 мг/сут (50 мг 5 раз в день). Лечение прамипексолом начинают с дозы 0,125 мг 3 раза в день (после еды), затем еженедельно дозу последовательно увеличивают до 0,25 мг 3 раза в день, 0,5 мг 3 раза в день, при недостаточном эффекте — до 1 мг 3 раза в день и 1,5 мг 3 раза в день (максимальная доза — 4,5 мг/сут). Лечение бромокриптином начинают с дозы 2,5 мг 3 раза в день, в дальнейшем ее еженедельно последовательно увеличивают до 5 мг 3 раза в день, 7,5 мг 3 раза в день, 10 мг 3 раза в день, 10 мг 4 раза в день (максимальная доза — 40 мг/сут). При появлении тошноты в период титрования назначают домперидон. При неэффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы (уровень С).
Антихолинергические средства показаны при наличии выраженного тремора покоя и сохранности нейропсихологических функций (уровень С). Хотя у этой категории лиц они могут применяться в качестве средств первого выбора, более целесообразно их добавление к агонисту дофаминовых рецепторов, если последний не обеспечивает достаточного подавления тремора. Лечение тригексифенидилом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут). Лечение бипериденом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут).
Лечение амантадином начинают с дозы 100 мг 2 раза в день, при недостаточном эффекте она может быть увеличена до 100 мг 3 раза в день, в дальнейшем — до 100 мг 4–5 раз в день (максимальная доза — 500 мг/сут). Лечение селегилином начинают с дозы 5 мг утром, через 1 нед ее увеличивают до 5 мг 2 раза в день.
Если указанные препараты и их комбинация в максимально переносимых дозах не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат, содержащий леводопу (стандартный препарат или препарат с замедленным высвобождением) в минимальной эффективной дозе (уровень А).
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности нейропсихологических функций лечение начинают с одного из агонистов дофаминовых рецепторов. Если максимальные переносимые дозы одного из этих препаратов не обеспечивают достаточного функционального улучшения, к нему последовательно добавляют по указанным выше схемам один из следующих препаратов: селегилин, амантадин или холинолитик (при наличии тремора покоя). Больным после 65 лет тригексифенидил и другие антихолинергические средства не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов (уровень В). При недостаточной эффективности к комбинации из двух-трех указанных выше препаратов добавляют средство, содержащее леводопу, в минимальной эффективной дозе (200–400 мг/сут).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и/или возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта, лечение начинают с препаратов, содержащих леводопу. Для лечения могут быть использованы как стандартные препараты, так и препараты с замедленным высвобождением. Если небольшие дозы леводопы (200–400 мг/сут) не обеспечивают необходимого улучшения, к ним последовательно добавляют по указанным выше схемам следующие препараты: агонист дофаминовых рецепторов, амантадин, селегилин.
У лиц старше 70 лет лечение следует начинать со средств, содержащих леводопу. Для лечения могут применяться как стандартные препараты, содержащие леводопу, так и препараты с замедленным высвобождением (уровень В).
Другие меры. Поскольку дофаминергические препараты у больных с глаукомой могут повысить внутриглазное давление, перед их назначением у всех пациентов старше 40 лет следует измерить внутриглазное давление. В дальнейшем его измерение проводят после подбора противопаркинсонической терапии (обычно на втором месяце лечения) либо при появлении жалоб на ухудшение зрения. Больным с запорами и другими проявлениями нарушения моторики желудочно-кишечного тракта показана диета с высоким содержанием пищевых волокон (уровень С); при снижении массы тела показана диета с повышенным содержанием белковых продуктов, а также продуктов, богатых витаминами и микроэлементами (уровень С); для подбора диеты назначается консультация врача-диетолога.
При ограничении подвижности и наличии скелетно-мышечных болей показано проведение лечебной физкультуры, включающей упражнение на растяжение мышц, поддержание гибкости и тренировку координации движений (уровень С), физиотерапии (уровень С), рефлексотерапии (уровень С); в связи с этим назначаются консультации врача лечебной физкультуры, физиотерапевта, рефлексотерапевта. Больному рекомендуется посильная двигательная активность с ежедневными занятиями лечебной гимнастикой, по показаниям — занятия с логопедом. В зависимости от тяжести двигательных расстройств больной может продолжать прежнюю работу, перейти на более легкую, изменить условия работы (неполный рабочий день). При стойкой утрате трудоспособности больному определяется группа инвалидности (вопросы трудоспособности определяются МСЭК).
Алгоритм лечения БП представлен на рисунке.
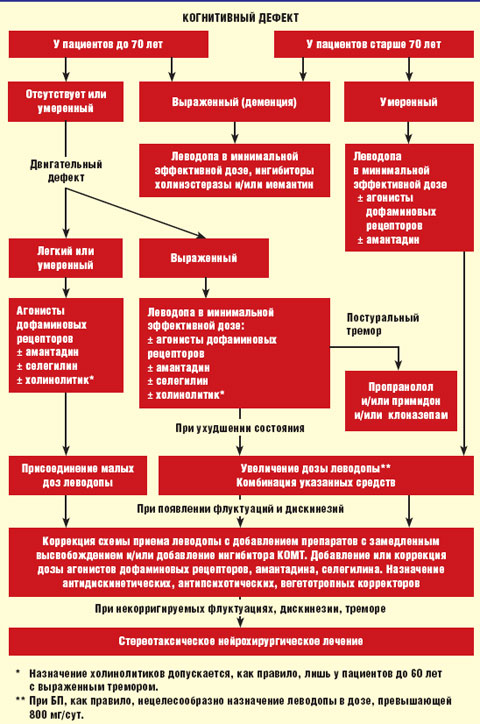 |
| Рисунок. Алгоритм лечения болезни Паркинсона |
Дальнейшая терапия при стабильной реакции на противопаркинсонические средства
Общие принципы лечения. Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности или поддержания повседневной активности, и избежать побочного действия. При необходимости для усиления эффекта противопаркинсонической терапии проводятся следующие мероприятия.
Особенности лечения больных с тремором. При выраженном дрожательном гиперкинезе, нарушающем функции конечностей, особенно если он имеет постурально-кинетический компонент, к противопаркинсоническим средствам при отсутствии противопоказаний добавляют пропранолол (уровень В). Лечение пропранололом начинают с дозы 10 мг 3 раза в день. В дальнейшем дозу последовательно увеличивают не чаще чем 1 раз в неделю до 20 мг 3 раза в день, 40 мг 3 раза в день, 40 мг 4 раза в день (максимально до 320 мг/сут в 3–4 приема). При наличии противопоказаний к применению пропранолола (брадиаритмия, сахарный диабет, заболевания периферических сосудов), непереносимости или неэффективности препарата назначают примидон (уровень С). Первоначально препарат назначают в дозе 31,25 мг на ночь, затем дозу последовательно увеличивают 1 раз в 7–10 дней до 62,5 мг на ночь, 125 мг на ночь, 250 мг на ночь (максимально до 750 мг/сут в 2–4 приема или однократно на ночь).
Если пропранолол вызвал недостаточное улучшение, то к нему добавляют примидон в указанных дозах (уровень С). Клоназепам может быть добавлен к пропранололу или примидону при наличии выраженного кинетического компонента тремора (уровень С). Клоназепам первоначально назначают в дозе 0,5 мг на ночь, затем 1 раз в 7–10 дней дозу последовательно увеличивают до 0,5 мг 2 раза в день, 1 мг 2 раза в день, 2 мг 2 раза в день, пока не будет достигнуто существенное ослабление дрожания. При выраженном треморе может быть также использован клозапин в дозе 12,5–50 мг/сут (уровень В).
Особенности лечения больных с аффективными нарушениями. При наличии аффективных нарушений назначается консультация врача-психотерапевта для решения вопроса о целесообразности проведения аутогенной тренировки или других методов психотерапии. При наличии депрессии у больных без выраженных нарушений познавательных функций лечение следует начинать с одного из агонистов дофаминовых рецепторов (прамипексол, пирибедил), способных корригировать легкую депрессивную симптоматику, или их сочетания с малыми дозами леводопы (уровень В). При выраженной депрессивной симптоматике после консультации с психиатром показано назначение одного из следующих антидепрессантов: амитриптилин (25–150 мг на ночь), имипрамин (50–150 мг/сут), циталопрам (20–40 мг/сут), флуоксетин (20–40 мг/сут), сертралин (50–100 мг/сут), пароксетин (10–20 мг/сут), миртазапин (7,5–30 мг/сут), венлафаксин (75–225 мг/сут). После получения лечебного эффекта продолжительность назначения антидепрессанта в эффективной дозе должна быть не менее 6 мес (уровень С).
Продолжение читайте в следующем номере.
О. С. Левин, доктор медицинских наук, профессор
РМАПО, Центр экстрапирамидных заболеваний, Москва