чем отличаются типы коллагена
Какие бывают типы и виды коллагена?
Коллаген − это белок, состоящий из нескольких аминокислот, включая гидроксипролин, глицин, лизин, аргинин. Он является основой и строительным материалом для всех соединительных тканей в человеческом организме. Это вещество содержится в наших суставах, хрящах, связках, коже и ногтях, но постепенно его количество уменьшается в организме, и поэтому добавки и косметика с коллагеном стали настолько популярными.
Коллаген подразделяется на типы – делится по принципу пользы для организма, и виды – по принципу источника, из которого выделяют коллаген. Разберёмся в нюансах классификации этого важного для человека белка.
Существующие типы коллагена
I и III тип
Первый и третий тип часто ставят рядам, т.к. отвечают они за схожие функции. А именно – за эластичность кожи и обновление её клеток, водный баланс, уменьшение степени изменений, приходящих с возрастом, и усвоение питательных веществ. В продающихся коллагеновых добавках эти два типа тоже часто объединены вместе.
Первый тип является в человеческом организме основным и также находится в наших костях, сухожилиях, связках и дёснах. Третий – в мышцах и кровеносных сосудах. Но основная их функция в поддержании кожных покровов в нормальном состоянии.
II тип
Типы коллагена в продуктах
Коллаген можно получать не только из БАДов, но и из привычных нам продуктов питания.
Как принимать разные типы коллагена?
Дневная норма
Рекомендуемая профилактическая доза I и III типа коллагена − 5000 мг. Так вы улучшите состояние волос и эластичность кожи.
Терапевтическая доза I и III типа коллагена составляет 10000 мг. Такое количество стоит принимать при различных травмах и переломах. Принимать коллаген для терапевтического эффекта стоит 2-3 раза в день, т.к. за один раз усваивается только 5000 мг.
II тип коллагена стоит принимать только для терапевтического эффекта, например, при заболеваниях суставов – дозировка составляет 40 мг в сутки.
Сколько пить по времени?
Стандартный профилактический курс приёма коллагена – 2-3 месяца, всё индивидуально, нужно учитывать свой возраст и цели, преследуемые приёмом коллагена, с последующим трёхмесячным отдыхом. Потом курс следует повторить. При проблемах со здоровьем, суставами, менопаузе или возрастных изменениях курс лечения составляет 6 месяцев с последующими 2 месяцами отдыха.
Производители всегда прикладывают инструкции с рекомендуемой схемой и длительностью приёма именно их биологически активной добавки – прислушивайтесь к ним.
Как пить?
Существующие виды коллагена
Под видом, источником, коллагена подразумевается сырьё, из которого его получают. Коллаген по такому принципу делят на животный, морской и растительный.
Эффективность и биологическая доступность коллагеновой добавки полностью зависит от источника белка.
Животный
Коллаген животного происхождения (говяжий) является наиболее популярной разновидностью такого белка. Его получают путём обработки сырых шкур, суставов и хрящевой ткани крупных рогатых животных. Этот вид достаточно хорошо усваивается и обладает эффектом заживления ран, способствует регенерации и увлажнению. Стоимость этой добавки самая демократичная из всех трёх видов, но есть два недостатка:
Морской
Морской коллаген (его ещё именуют «рыбным») получают из чешуи морских рыб и других обитателей моря. По своему составу этот вид коллагена ближе всего к человеческому, поэтому он легче и лучше воспринимается нашим организмом. Основное преимущество морского коллагена заключается в том, что он может стимулировать производство собственного коллагена в организме и менее аллергенен, чем животный вид.
Минусы морского вида коллагена:
Откройте для своей кожи 8 пищевых продуктов, богатых коллагеном
Влияние коллагена, что важно?
Коллаген является основным компонентом, который составляет основу соединительной ткани организма: мышц, сухожилий, связок, кожи, хрящей, суставов и т.д. Это один из главных компонентов, отвечающий за ь прочность и эластичности всей соединительной ткани, в том числе и стенок кровеносных сосудов и сердца.
С возрастом выработка коллагена постепенно снижается. Примерно после 35-40 лет выработка коллагена в организме сокращается, что может вызывать проблемы (дряблость и провисание кожи, появление морщин). Кроме того, снижение выработки коллагена может привести к таким заболеваниям как: остеоартрит, боли в суставах и мышцах.
Преимущества коллагена для кожи
К основным преимуществам коллагена для кожи относятся:
Продукты, которые улучшают выработку коллагена в коже
Не секрет, что для того, чтобы организм получал все необходимые витамины и питательные вещества, питание должно быть разнообразным и сбалансированным. Употребление достаточного количества жидкости также влияет на выработку коллагена и гидратации кожи. Это самый простой и доступный способ поддерживать выработку коллагена.
Не существует никаких чудодейственных препаратов и средств для кожи, но есть те, которые способствуют повышению упругости кожи и позволяют ей выглядеть здоровой.
Мы составили список продуктов, которые способствуют выработке коллагена:
1. Животный белок: мясо и рыба
В белке животного происхождения (мясо, субпродукты, желатин животного происхождения) содержится большое количество коллагена.
Важно избегать полуфабрикатов.
Эксперты рекомендуют употреблять мясо красного цвета умеренно (не более одного раза в неделю).
Рыба, особенно лосось, тунец или форель с высоким содержанием омега-3 жирных кислот естественно повышает концентрацию коллагена (также являясь полезными для костей и суставов).
2. Фрукты и овощи
А фрукты богатые витамином С необходимы для производства коллагена: апельсин, киви, грейпфрут, манго, ананас и некоторых других. Например, лимон не стимулирует производство коллагена, но и действует, как антиоксидант.
3. Яйца
Яйца являются лучшей пищей для нашей кожи, ведь в них большая концентрация ценных белков и витаминов группы В, Е, аминокислот и серы).
4. Сухофрукты и орехи
Арахис, грецкие орехи, фисташки, миндаль также стимулирует выработку коллагена.
5. Молочные продукты
Молочные продукты (молоко, сыр, йогурт и т.д.) благотворно влияют на производство коллагена благодаря высокому содержанию белка.
6. Серные продукты
Нужно употреблять в пищу продукты, которые содержат серу в своём составе (чеснок, лук, сельдерей, огурцы, оливки, виноград) они тоже обеспечивают хороший уровень коллагена в организме.
7. Чай
Чай (зеленый, белый, черный или красный) является натуральным антиоксидантом, который предотвращает снижение коллагена в нашем организме.
8. Желе
Желатин в организме превращается в коллаген и это тоже ценный источник животного белка.
Масло Bio-Oil способствует улучшению эластичности вашей кожи
Употребляйте в пищу полезные продукты и не забывайте про ритуал красоты с использованием масла Bio-Oil утром и вечером для сохранения красоты и молодости вашей кожи.
Как выбрать коллаген?
Содержание
Коллаген — белок, который состоит из нескольких аминокислот, среди которых: гидроксипролина, глицина, пролина, лизина и аргинина. Данное вещество входит в состав наших суставов, хрящей, связок, а также кожи и ногтей, из-за чего добавки и косметические средства с ним стали настолько популярны и пользуются высоким спросом последние несколько лет.
Кто-то пьет коллаген из-за проблем с суставами, кто-то — чтобы “продлить” молодость, при этом не все понимают, что для разных целей нужна своя добавка. Разберем по порядку основные нюансы в выборе коллагена.
Коллаген или аминокислоты?
Как уже было сказано ранее, коллаген состоит из аминокислот, среди которых 8 являются незаменимыми. Поэтому возникает резонный вопрос — не проще ли подобрать аминокислотный комплекс, который помимо стимуляции выработки коллагена обладает массой других полезных свойств?
В отличие от аминокомплекса, коллаген имеет более биодоступную гидролизированную форму, в котором аминокислотный профиль гораздо выше, чем в том же комплексе или протеине. То есть основных аминокислот, из которых состоит коллаген (пролин, гидроксипролин и глицин), там содержится больше.
Поэтому если ваша цель — оздоровление суставов или улучшение качества кожи и волос, то лучше остановить свой выбор именно на коллагене.
Типы коллагена
Следующий пункт при выборе коллагеновой добавки — тип коллагена. Всего их существует более 20, но нас интересуют три из них, у каждого из которых своя функция:
Таким образом, для улучшения состояния кожи нужно принимать добавку с коллагеном I и III типа, для суставов — II тип.
Виды коллагена
Когда говорят об источниках коллагена (или видах) подразумевают сырье, из которого он получен, и от вида этого сырья зависит эффективность и биодоступность добавки.
Животный (или бычий ) коллаген — самый популярный вид, который получают путем переработки верхнего слоя шкуры, а также суставов и хрящей крупного рогатого скота.
Такой коллаген хорошо усваивается, оказывает ранозаживляющее, восстанавливающее и увлажняющее действие. Стоимость такой добавки небольшая, но есть пара минусов: животный коллаген может вызвать аллергическую реакцию и уступает по количеству питательных веществ морскому или растительному.
Морской коллаген получают из эпидермиса морской рыбы, по аминокислотному составу он ближе к человеческому, поэтому гораздо лучше воспринимается организмом.
Главным преимуществом морского коллагена является то, что он стимулирует выработку собственного коллагена, а так же он менее аллергичен по сравнению с животным аналогом.
И морской и говяжий коллаген могут вызвать побочные эффекты в виде высыпаний на коже. Это редко связано с качеством самого продукта, часто такая реакция вызвана неправильной работой кишечника или недостаточной выработкой ферментов со стороны поджелудочной железы
Минусом может быть достаточно высокая цена и он требует особых условий хранения, которые подразумевает соблюдения температурного режима и абсолютной стерильности.
Наиболее редкий вид коллагена — растительный, который не совсем является коллагеном как таковым — это белок пшеницы. Он абсолютно гипоаллергенен и хорошо усваивается, но из-за сложного производства такая добавка стоит очень дорого.
Выбирать между морским или бычьим коллагеном нужно, исходя из конкретных целей: для бьюти-целей (кожа и волосы) подходит морской коллаген, а для здоровья суставов — животный.
Дополнительные компоненты в составе
При выборе добавки с коллагеном следует обращать внимание на состав: конечно, можно выбрать чистый продукт, но наличие дополнительных витаминов и минералов, которые улучшают усвоение коллагена, а также способствуют синтезу собственного, будет преимуществом.
В какой форме выбрать коллаген?
Коллаген выпускают в трех формах: капсулы/таблетки, порошок и жидкий. У каждой из этих форм есть свои достоинства:
Выбор формы больше зависит от удобства, но в случае каких либо проблем с ЖКТ, когда есть риск неполного усвоения активного вещества, преимущества за капсулами, так как они имеют специальную желатиновую оболочку. Подробнее о том, как правильно принимать коллаген разных форм и типов можно узнать в статье: «Как правильно принимать коллаген?»
Чем отличаются типы коллагена
• Основная функция коллагена состоит в обеспечении структурной опоры тканей
• Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Эти белки — наиболее распространенные в царстве животных
• Все коллагены организованы в тройные спирализованные «коллагеновые субъединицы», обладающие суперспиральной структурой и состоящие из трех отдельных полипептидов
• Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна
• Мутации в коллагеновых генах вызывают множество патологических состояний, начиная от появления морщин до развития хрупкости костей и таких тяжелых заболеваний, как образование кожных волдырей
Семейство коллагенов включает более 20 белков, которые относятся к наиболее распространенным белкам клеток животных. У многоклеточных организмов коллагены существуют по крайней мере 500 млн лет. Почти все клетки животных синтезируют и секретируют по меньшей мере одну из форм коллагена.
Коллагены обеспечивают тканям структурную поддержку и существуют во множественных формах, организованных в различные структуры. Все белки семейства коллагенов характеризуются одним общим свойством: они собраны в тонкие (примерно 1,5 нм диаметром) тройные спиральные суперспирализованные структуры, состоящие из трех субъединиц коллагеновых белков, которые удерживаются вместе ковалентными и нековалентными связями.
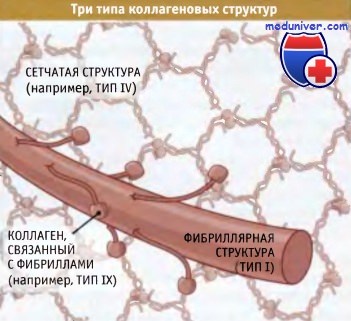
где они связаны между собой другими белками внеклеточного матрикса, включая коллагены, связанные с фибриллами.
Суперспирализованные структуры бывают трех типов — фибриллярные, слоистые и связанные с фибринами:
• В фибриллярных коллагенах суперспирализованные спирали организованы в фибриллы или «канаты», которые обеспечивают прочность структуры вдоль единственнной оси (такая структура напоминает прочный стальной трос, образованный проволочными пучками). Когда эти фибриллы собраны в параллельно расположенные пучки, как в сухожилиях, они обеспечивают невероятную прочность структуры, которая способна противостоять усилиям, развиваемым мышцами, закрепленными на костях.
• Слоистые коллагены представляют собой сеть, состоящую из суперспирализованных спиральных структур. Они в меньшей степени устойчивы к мышечным усилиям, но гораздо лучше противостоят растяжению в нескольких направлениях. Сеть таких структур, например, характерна для кожи.
• Третий тип коллагена, известный как «фибриллярные связки», образует суперспирализованные спиральные структуры, связывающие коллагеновые фибриллы вместе.
Независимо от организации, коллагены образуют основную каркасную структуру внеклеточного матрикса. Такие входящие во внеклеточный матрикс белки, как фибронектин и витронектин, связываются с коллагенами и вплетены в структуры, образованные коллагеновым каркасом. Один из представителей семейства коллагенов представляет собой трансмембранный белок, который участвует в формировании межклеточных контактов.
Существует примерно 20 различных типов коллагена, большая часть которых может быть сгруппирована в четыре класса. Каждая из тройных спиралеобразных структур обозначается римской цифрой (I, II, III и т. д.). Каждая коллагеновая субъединица имеет обозначение как субъединица а, а ее типу присвоен номер (а1, а2, а3 и т. д.), после которого римской цифрой обозначен тип, в котором она находится. Например, основной фибриллярный коллаген хвоста (и других тканей) крыс относится к типу I и состоит из двух копий субъединиц а1(1) и одной копии субъединицы а2 (I).
На рисунке ниже представлена структура коллагеновых волокон. Три полипептидные субъединицы параллельно обернуты вокруг друг друга и образуют суперспирализованную спиральную структуру длиной 300 нм. Для коллагенов характерна повторяющаяся последовательность аминокислот, содержащая элемент глицин-X-Y, где X и Y могут представлять собой любую аминокислоту, но обычно это пролин и гидроксипролин соответственно.
Такая последовательность способствует плотной упаковке трех субъединиц и облегчает образование суперспиральной структуры. Субъединицы длиной 300 нм скрепляются вместе посредством ковалентных связей, которые образуются между N-концевым участком одной субъединицы и С-концевым участком примыкающей к ней. Суперспирализованные спиральные структуры располагаются параллельно, образуя между собой небольшие зазоры (64-67 нм). Эти зазоры обеспечивают характерный вид (исчерченность) фибрилл, видимый в электронном микроскопе.

характеру полимерных форм и по распределению в тканях. Некоторые группы включают коллагены нескольких типов.
Полностью собранные коллагеновые структуры (фибриллярные или сетчатые) по размерам оказываются гораздо больше, чем сами клетки; некоторые фибриллы могут достигать нескольких миллиметров длины. Таким образом, субъединицы коллагена синтезируются и секретируются в виде суперспирализованных спиральных структур, и окончательные этапы их сборки происходят вне клетки. Как показано на рисунке ниже, синтез коллагена и дальнейший его процессинг происходят на протяжении всего секреторного пути. При синтезе коллагеновые белки направляются в гранулярный эндоплазматический ретикулум (ЭПР) при участии частиц, распознающих сигнал и связанного с ними белкового аппарата.
Коллагеновые субъединицы синтезируются в виде крайне длинных полипептидов, которые называются проколлагены и содержат пропептиды, представляющие собой «хвосты», расположенные на амино- и карбоксильном концах.
После того как проколлагены попали в просвет ЭР, по мере транспорта из ЭР через аппарат Гольджи и в секреторные везикулы, они претерпевают серию модификаций. В процессе транспорта проколлагена через ЭР и аппарат Гольджи, к боковым цепям пролина и лизина, находящимся в средней части молекул проколлагена, добавляются гидроксильные группы (-ОН). При этом образуются гидроксипролин и гидроксилизин.
Эти модификации обеспечивают правильное образование водородных связей, которые скрепляют вместе три субъединицы в суперспирализованной спиральной структуре. Между амино- и карбоксиконцевыми частями пропептидов образуются дисульфидные связи, которые затем обеспечивают правильное расположение трех проколлагеновых субъединиц с образованием тройной спиральной суперспирализованной структуры. Затем спираль образуется спонтанно, в направлении от С-конца к N-концу.
Пропептиды препятствуют взаимодействию суперспирализованных спиралей друг с другом, тем самым предотвращая полимеризацию коллагена в клетке. Когда произошла секреция тройных спиралей проколлагена, ферменты, которые называются протеазы проколлагена, отщепляют пропептиды. Остающийся белок, известный под названием тропоколлагена, почти весь организован в тройную спираль и представляет собой основную структурную единицу коллагеновой фибриллы.
Фибриллы собираются просто: боковые цепи лизина в тропоколлагене модифицируются при действии фермента лизилоксидазы, образуя аллизины. Эти модифицированные лизины образуют ковалентные сшивки, которые обеспечивают полимеризацию тропоколлагенов. Лизилоксидаза представляет собой внеклеточный фермент, и эта стадия сборки фибрилл происходит только после выхода проколлагена из клетки. После сборки фибриллы могут объединяться, образуя большие пучки или волокна, характерные для фибриллярного коллагена.
Принимая во внимание всю важность коллагена в обеспечении структурной поддержки тканей, можно представить, какие тяжелые последствия для организма будет иметь нарушение процесса сборки фибрилл. Мутации в генах, кодирующих синтез коллагенов или ферментов, модифицирующих проколлаген, вызывают развитие множества генетических заболеваний, затрагивающих практически все ткани. Например, коллаген типа I представляет собой основной структурный белок костной ткани. Мутации в коллагеновых генах этого типа служат причиной незавершения остеогенеза, т. н. развития «болезни хрупких костей».
Мутации в коллагеновом гене типа IV приводят к нарушению сборки базальной ламины в большинстве эпителиальных тканей и к развитию такого кожного заболевания, как буллезный эпидермоз.
Клетки связываются с коллагеном посредством специфических рецепторов, называемых интегринами. Эти рецепторы обеспечивают возможность обратимого связывания клеток с коллагенами по мере их движения по внеклеточному матриксу. Интегриновые рецепторы также активируют пути передачи сигналов, так что связывание с коллагенами (и с другими белками внеклеточного матрикса) изменяет активность в клетке биохимических процессов и, таким образом, способствует контролю над ростом и дифференцировкой клеток.
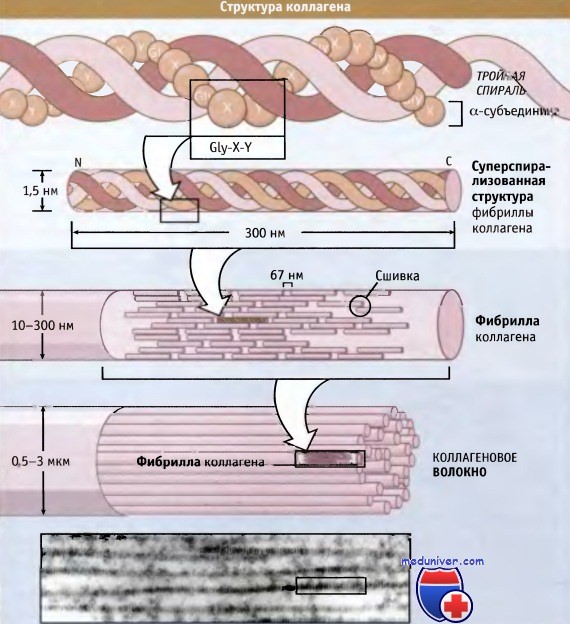
организация витой структуры в фибрилле (в середине) и фибрилл в коллагеновом волокне (внизу).
Наличие 67-нм зазора между соседними спиральными структурами обусловливает видимую в электронном микроскопе исчерченность фибрилл, составляющих волокно. 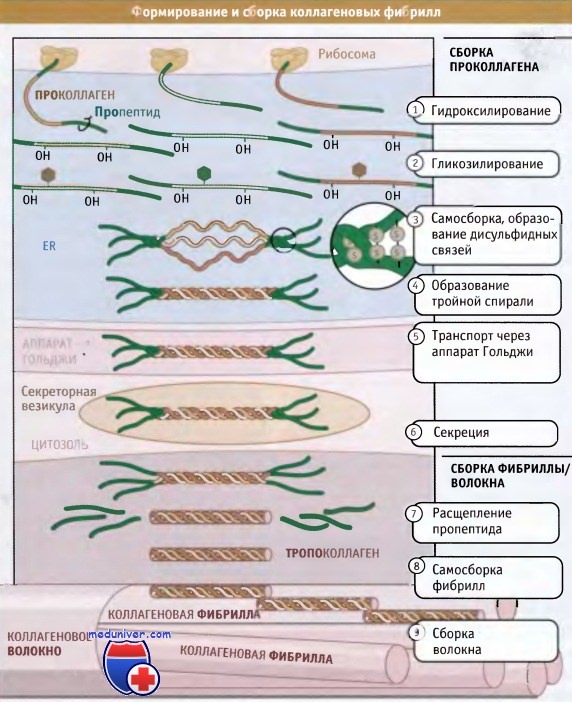
Однако сборка фибрилл происходит во внеклеточном пространстве после секреции тройных спиралей, обладающих витой структурой.
Для упрощения в тройных структурах не показаны гидроксильные группы и сахарные остатки. 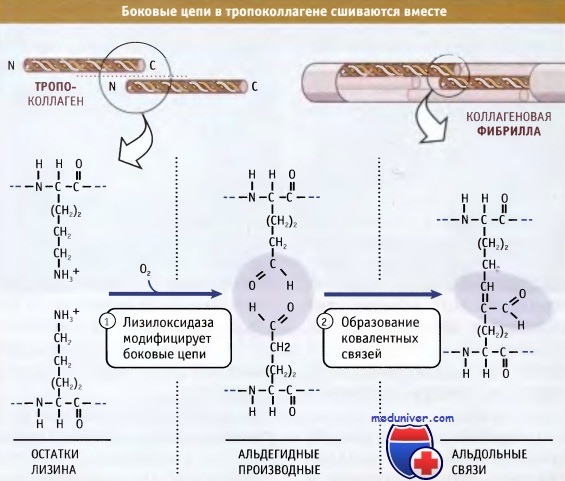
которые затем образуют между собой альдольную связь.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Неоколлагеногенез: физиологический механизм и эффективность процедур
Илья Кругликов ДОКТОР ФИЗИКО-МАТЕМАТИЧЕСКИХ НАУК, WELLCOMET GMBH, ГЕРМАНИЯ
Les nouvelles esthetiques 5/2013
Неоколлагеногенез, или образование нового коллагена, представляет собой одно из ключевых понятий в эстетической медицине. Это связано с той важной ролью, которую коллаген играет в механических и структурных свойствах соединительной ткани. Поэтому неоколлагеногенез часто рассматривается как основная цель применения различных неинвазивных и малоинвазивных методов лечения в эстетической медицине.
Результаты лечения трактуются следующим образом: любое улучшение состояния кожи – уменьшение пор, сокращение глубины и количества морщин, повышение тургора – объясняется локальной стимуляцией неоколлагеногенеза в коже. Это касается практически всех аппаратных методов омоложения, таких, например, как лазерные, IPL- и LED-методы, а также методов, основанных на применении высокочастотных токов, ультразвуковых волн и их комбинаций.
Утверждение о том, что использование принципиально разных физических факторов приводит к воздействию на механизм нео коллагеногенеза, не случайно. Сторонники каждого из упомянутых методов претендуют на получение пролонгированного результата, что теоретически возможно только в том случае, если после проведения процедуры можно добиться уплотнения либо хотя бы значительного обновления структурной сетки зрелого нерастворимого коллагена в межклеточном матриксе.
В основе этой концепции лежат результаты фундаментальных исследований, которые показали, что по мере хронологического старения содержание в коже коллагена постоянно снижается, причем его деструкция может быть дополнительно усилена фотоиндуцированным старением или повторным ремоделированием соединительной ткани.
Таким образом, в эстетической медицине неоколлагеногенез представляется как неспецифическая реакция фибробластов, например на изменение температуры или давления в соединительной ткани, причем предполагается, что этот эффект возникает даже при незначительных отклонениях параметров от их нормальных значений. В принципе это возможно. Но при более детальном изучении данного явления возникает ряд проблем, которые противоречат закономерностям обмена коллагена, известным из фундаментальных исследований.
ОСНОВНЫЕ ПРОТИВОРЕЧИЯ
Изменение содержания коллагена в соединительной ткани зависит как от количества находящихся в ней фибробластов, так и от интенсивности процессов синтеза и распада коллагена. Эти процессы коррелируют между собой через механизмы обратной связи и характеризуются разным временем протекания. В результате возникают определенные противоречия, связанные с реальной ролью неоколлагеногенеза в улучшении структуры кожи после применения неинвазивных или малоинвазивных методов эстетической коррекции. Для понимания этих противоречий рассмотрим ряд особенностей неоколлагеногенеза.
Саморегуляция внеклеточного матрикса
Процессы синтеза коллагена в соединительной ткани связаны с процессами его распада через механизм обратной связи. Любая стимуляция, ведущая к усиленной выработке фибробластами коллагена, одновременно вызывает и деструкцию вновь произведенного ими коллагена (в основном через стимуляцию матриксных металлопротеиназ, MMP). Поэтому в физиологических условиях система находится в динамическом равновесии. Если процессы распада полностью отключены или частично не работают из-за какой-либо патологии, может возникнуть бесконтрольный рост содержания коллагена в коже. Однако большая часть вновь синтезированного коллагена вскоре опять распадается. Этот процесс, впрочем, можно минимизировать, если применить специальную стратегию: стимулировать синтез нового коллагена и одновременно подавлять синтез MMP.
Процессы саморегуляции работают на всех этапах синтеза коллагена, однако управляются они по-разному и на каждом этапе имеют собственную динамику. Для правильной интерпретации клинических результатов, полученных после применения тех или иных эстетических процедур, важно сначала выяснить, какая именно стадия синтеза коллагена имеется в виду – образование проколлагена или ассемблирование зрелого коллагена.
Стадии синтеза коллагена
Можно выделить три стадии синтеза коллагена: активация матричной РНК (мРНК), образование проколлагена и ассемблирование зрелого коллагена.
Увеличить количество мРНК можно относительно просто, однако это не приведет к прямому повышению оборота проколлагена в ткани. Синтез тройной спирали (проколлагена) происходит в фибробластах. Выделившись оттуда во внеклеточный матрикс, проколлаген снова разлагается под действием ферментов. Лишь небольшая его часть превращается в так называемый ассемблированный (зрелый) коллаген с множественными поперечными связями, благодаря которым он оказывается очень устойчив к действию ферментов. Важно помнить, что только устойчивый зрелый коллаген, а не неустойчивый проколлаген определяет в конечном счете механические свойства кожи. Описанные три стадии значительно различаются по динамике и имеют разные периоды полураспада. Эти периоды отличаются друг от друга на порядок. Таким образом, возникает парадоксальная ситуация: время реагирования внеклеточного матрикса, состоящего в основном из зрелого коллагена, намного превышает временные границы, в рамках которых, как правило, наблюдается результат после одной корректирующей процедуры.
Практически во всех проводимых экспериментальных и клинических исследованиях в тканях измеряется содержание либо мРНК, либо проколлагена, и увеличение их синтеза после воздействия тем или иным фактором трактуется как неоколлагеногенез. Это изменение, однако, не относится к зрелому коллагену. В результате совершается классическая ошибка – на основании наблюдаемой корреляции между измеренным увеличением синтеза проколлагена и улучшением состояния кожи вскоре после лечения делается вывод о наличии причинно-следственной связи между этими явлениями. На самом же деле ее не существует.
Эстетическая коррекция и динамика стимуляции коллагена
Ниже представлены примеры, подтверждающие тот факт, что применение различных методов эстетической коррекции может привести к совершенно разной динамике стимуляции коллагена.
Пример 1. Одновременная стимуляция синтеза проколлагена и матриксных металлопротеиназ (MMP)
Было показано, что при применении CO2- лазера можно значительно увеличить синтез проколлагена I типа (почти в 7,5 раза от исходного значения на 21-й день после процедуры). Содержание мРНК при этом также резко возрастает (примерно в 40 000 раз на 7-й день после процедуры), что коррелирует с увеличением количества протеина MMP-1. Хотя концентрация проколлагена I типа в обработанной коже остается повышенной в течение как минимум шести месяцев после процедуры, его концентрация все же значительно ниже, чем концентрация соответствующей мРНК, что объясняется вышеописанным механизмом обратной связи.
Пример 2. Стимуляция синтеза проколлагена при одновременном подавлении выработки MMP
При использовании KTP-лазера (532 нм) или Q-switched Nd:YAG лазера (1,064 нм) с плотностью излучения всего 1,5 Дж/cм2 можно стимулировать выработку мРНК проколлагена I и III типов и одновременно подавить активность MMP-1 и MMP-2, что в конечном счете уменьшает распад вновь синтезированного коллагена.
Процессы активации/подавления ММР в ткани в значительной степени зависят от вида применяемого физического фактора и от того, при какой плотности излучения проводится обработка. Так, свет в зависимости от используемой плотности излучения и длины волны может оказывать на MMP стимулирующее либо подавляющее действие. Эластокомпрессия (один из стандартных методов терапии при открытых ранах и рубцах, а также целлюлите) неодинаково воздействует на желатиназы MMP-2 и MMP-9, которые, как известно, по-разному вырабатываются на различных стадиях заживления ран. Радиочастотный ток низкой интенсивности подавляет синтез MMP, но при определенном повышении температуры в ткани, напротив, стимулирует их выработку. Легкая гипертермия (43–45°C) повышает концентрацию MMP-1 почти на 100%, что существенно отражается на содержании в ткани коллагена I типа. В то же время легкая гипотермия (32–34°C) заметно сокращает активность желатиназ.
Статическое и циклическое моноаксиальное растяжение кожи также может поразному воздействовать на некоторые ММР. Было, например, показано, что применение механического усилия в 1 дин/cм2 подавляет выработку определенных MMP, а воздействие силой более 6 дин/cм2 – стимулирует.
Такое многообразие возможных реакций ставит под сомнение исключительную роль неоколлагеногенеза при применении различных неинвазивных методов эстетической коррекции.
Период полураспада коллагена в коже
В литературе встречаются различные оценки времени полураспада проколлагена и зрелого коллагена в коже. Это связано с тем, что скорость разрушения данного белка (особенно на первом этапе его формирования) в значительной степени зависит от окружающих условий и в норме составляет приблизительно 0,076% в час. Исходя из этого, период полураспада проколлагена составляет примерно 28 дней, а полное его обновление в коже происходит в течение 56 дней. При определении этих величин предполагалось, что одновременная деструкция вновь образуемого проколлагена не происходит.
Период полураспада зрелого коллагена, напротив, очень длителен и оценивается приблизительно в 15 лет, что объясняется наличием в нем многочисленных поперечных связей и высокой резистентностью к действию ферментов. Иными словами, замена зрелого коллагена в коже происходит крайне медленно, при этом новые структурные элементы коллагеновой сетки поступают из имеющегося пула проколлагена. Именно благодаря такому замедленному обмену зрелого коллагена по мере старения происходит хотя и постоянное, но относительно медленное ухудшение состояния кожи, обусловленное не только вышеупомянутым распадом коллагена, но и накоплением в коже фрагментированного белка, который сильно ограничивает адгезию фибробластов и, следовательно, производство нового коллагена. Столь медленные процессы ремоделирования в коже делают быстрое изменение ее структуры в физиологических условиях невозможным даже теоретически.
Поскольку в физиологических условиях система находится в равновесии, можно легко вычислить, каким при этом должно быть соотношение между проколлагеном и зрелым коллагеном в ткани. Если исходить из того, что весь проколлаген сможет преобразоваться в коже в зрелый коллаген (с периодами полураспада соответственно 28 дней и 15 лет), а не распадется хотя бы частично под действием ферментов, то его доля должна составлять приблизительно 0,5% от общего содержания коллагена. И хотя это максимальная (к тому же расчетная) величина, она хорошо согласуется с результатами некоторых известных исследований. Такая незначительная доля проколлагена в общем количестве коллагена в коже должна означать, что в физиологических условиях только небольшая часть зрелого коллагена лабильна и может быть подвержена влиянию различных физических факторов.
Механические свойства проколлагена значительно хуже, чем зрелого коллагена, а его доля в общем количестве коллагена настолько низка, что он не может играть существенной роли в улучшении состояния кожи ни сразу после лечения, ни в течение более длительного промежутка времени после проведения процедуры. Волокна зрелого коллагена отвечают за механические и структурные свойства кожи, однако период его полураспада настолько велик, что никакая существенная модификация структуры в квази-физиологических условиях не может произойти в течение нескольких дней или недель после проведенной процедуры.
РЕАЛИСТИЧНЫЕ ОЦЕНКИ
Насколько реально улучшение состояния кожи вследствие неоколлагеногенеза после проведения неинвазивной или малоинвазивной эстетической процедуры?
Чтобы произвести разумную оценку, предположим, что период полураспада зрелого коллагена составляет приблизительно 15 лет, а количество проколлагена I типа в дерме увеличивается после процедуры в 2,4 раза (что соответствует максимальному значению, наблюдаемому через 7 дней после проведения фотодинамической терапии) и остается неизменным в течение всего времени наблюдения (что, естественно, сильно завысит нашу оценку). При соблюдении всех указанных условий доля зрелого коллагена, замена которого произойдет в течение первых 7 дней после процедуры, составит всего 0,15%. Даже если бы концентрация проколлагена I типа выросла по сравнению с базовым значением в 24 раза и оставалась бы стабильной в течение всех этих 7 дней, доля замещенного зрелого коллагена все равно составила бы максимум 1,5%. Представляется крайне маловероятным, что подобное минимальное изменение качества и количества зрелого коллагена может вызвать видимое улучшение состояния кожи.
Примерно те же данные получаются при анализе эффективности неинвазивной радиочастотной терапии. Было показано, что через два дня после процедуры содержание в коже мРНК проколлагена I типа увеличилось в 2,4 раза по сравнению с базовым значением, а через 7 дней – оно несколько упало и лишь в 1,7 раза превышало нормальный уровень. В данном случае увеличение содержания проколлагена I типа еще меньше, чем после фотодинамической терапии, а доля замещаемого зрелого коллагена спустя 7 дней после процедуры вообще ничтожно мала.
Для улучшения эффекта можно было бы применить одну из следующих стратегий:
Оба способа должны сочетаться с эффективным локальным подавлением активности MMP в области проведения процедуры. Например, после ежедневного применения в течение 12 месяцев препаратов с содержанием витамина А (одного из сильнейших натуральных ингибиторов MMP) в коже устанавливается стабильно повышенный (почти на 80%) уровень содержания проколлагена I типа, что соответствует более чем 6%-ному дополнительному ремоделированию фибриллярной сетки коллагена в физиологических условиях.
ФИЗИОЛОГИЧЕСКИЕ И ПАТОЛОГИЧЕСКИЕ УСЛОВИЯ
Если при квази-физиологических условиях проведения терапии в коже не происходит существенного неоколлагеногенеза, то можно ли достичь более сильной реакции при создании патологических условий, например путем применения малоинвазивных методов эстетической коррекции или значительного повышения интенсивности процедур?
При малоинвазивном воздействии в ткани обычно происходит неоднородное (точечное или каналообразное) распределение поглощенной энергии. В этих участках энергия концентрируется таким образом, чтобы ее плотность превышала допустимый уровень толерантности соединительной ткани. При этом стимулируется более интенсивный синтез коллагена, правда, уже не за счет физиологического неоколлагеногенеза, а в результате развития патологического фиброза, связанного с возникающими микроожогами и их последующим рубцеванием.
Физиологический и патологический виды производства коллагена существенно различаются: физиологический неоколлагеногенез характеризуется изотропностью, фиброз же – анизотропностью и приводит к совершенно иному распределению давления и натяжения в соединительной ткани. В патологических условиях подобные фиброзы могут развиваться достаточно быстро, создавая в коже более высокое напряжение, проявляющееся в виде такого же быстрого улучшения ее состояния. Именно это следует считать типичным эффектом при использовании фракционных методов омоложения, таких как лазерные или радиочастотные (особенно при пропускании высокочастотного тока через введенные в кожу иглы). Как себя поведут сформировавшиеся после такой процедуры микрорубцы при повторном снижении тургора кожи, предсказать сложно, так как в настоящее время результаты пролонгированных клинических исследований после применения малоинвазивных эстетических процедур подобного рода практически отсутствуют.
В патологических условиях еще один механизм может оказывать значительное влияние на общее содержание коллагена в коже – выработка и миграция новых фибробластов. Его можно наблюдать, в частности, при заживлении ран, когда происходит быстрое и значительное восстановление кожных структур и большая часть поврежденного коллагена должна быть сначала разрушена и элиминирована, а затем заново синтезирована и замещена. В физиологических условиях данный механизм играет второстепенную роль.
ВЫВОДЫ
Рекомендуемая литература
1. Dang Y, Ye X, Weng Y, Tong Z, Ren Q. Effects of the 532-nm and 1,064-nm Q-switched Nd:YAG lasers on collagen turnover of cultured human skin fibroblasts: a comparative study. Lasers Med Sci, 2010, 25, рр. 719–726.
2. El-Harake WA, Furman MA, Cook B, et. аl. Measurement of dermal collagen synthesis rate in vivo in humans. Am J Physiol, 1998, 274, рр. E586–E591.
3. Fisher GJ, Varani J, Voorhees JJ. Looking older. Fibroblast collapse and therapeutic applications. Arch Dermatol, 2008, 144, рр. 666–672.
4. Fligiel SEG, Varani J, Datta SC, et. аl. Collagen degradation in aged/ photodamaged skin in vivo and after exposure to matrix metalloproteinase-1 in vitro. J Invest Dermatol, 2003, 120, рр. 842–848.
5. Griffiths CEM, Russman AN, Majmudar G, et. аl. Restoration of collagen formation in photodamaged human skin by tretinoin (retinoic acid). New Engl J Med, 1993, 329, рр. 530–535.
6. Kruglikov IL. Neocollagenesis in noninvasive Aesthetic treatments. J Cosm Dermat Sci, 2012, Аppl 2(4).
7. Orringer JS, Kang S, Johnson TM, et. аl. Connective tissue remodeling induced by carbon dioxide laser resurfacing of photodamaged human skin. Arch Dermatol, 2004, 140, рр. 1326–1332.
8. Orringer JS, Hammerberg C, Hamilton T, et. аl. Molecular effects of photodynamic therapy for photoaging. Arch Dermatol, 2008, 144, рр. 1296–1302.
9. Verzijl N, DeGroot J, Thorpe SR, et. аl. Effect of collagen turnover on the accumulation of advanced glycation end products. J Biol Chem, 2000, 275, рр. 39027–39031.
10. Zelickson BD, Kist D, Bernstein E, et. аl. Histological and ultrastructural evaluation of the effects of a radiofrequency-based nonablative dermal remodeling device. A pilot study. Arch Dermatol, 2004, 140, рр. 204–209.
Оригинальный вариант статьи был опубликован в журнале KOSMETISCHE MEDIZIN (1/13), Германия.





