чем отличаются изотопы водорода
Изотопы водорода
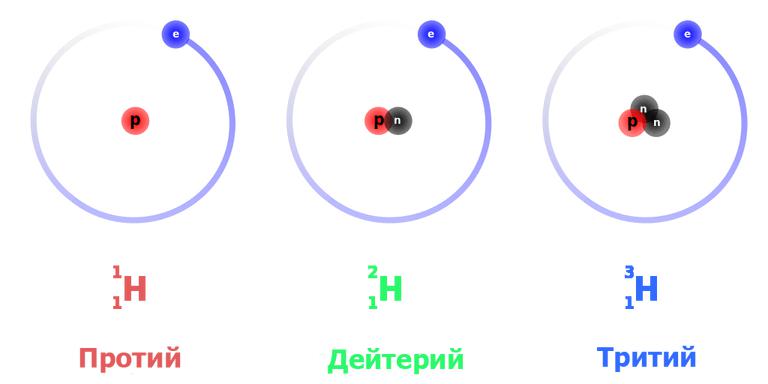
Известно несколько изотопов водорода: дейтерий ( 2 H) с одним протоном и одним нейтроном в ядре, тритий ( 3 H) с одним протоном и двумя нейтронами в ядре и очень неустойчивые тяжелые изотопы 4 H, 5 H, 6 H и 7 H. Ядра протия и дейтерия стабильны, а ядра трития подвергаются бета-распаду:
Предполагают, что эта реакция является главным источником изотопа гелия-3 в атмосфере.
Время жизни атомов остальных изотопов составляет ничтожные доли секунды.
Таблица изотопов водорода:
Содержание изотопов водорода в природе:
Массовая доля (в %) в природной смеси:
1 H – 99,9849 2 H – 0,0139 3 H – 0,0012
Нормальный изотопный состав природных соединений водорода соответствует отношению D : H=1 : 6800
3·10-18 % (мольные доли). Очевидно, он образуется в результате ядерных реакций, вызванных действием космических лучей.
Получение изотопов водорода
В настоящее время дейтерий получают ректификацией жидкого водорода и пот так называемому двухтемпературному сероводородному методу, в основе которого лежит реакция изотопного обмена:
Константа равновесия которой при 30 и 120 °C равна соответственно 2,31 и 1,86.
Тритий синтезируют, действуя на 6 Li3 нейтронами, получаемыми в ядерном реакторе:
Для водорода, как ни для какого другого элемента, относительное различие изотопных масс достигает значительной величины. Поэтому, несмотря на одинаковую электронную структуру, все изотопы заметно различаются не только физическими, но и химическими свойствами. Вследствие резкого преобладания протия влияние тяжелых изотопов сказывается незначительно и может быть зафиксировано лишь в очень точных экспериментах. Поэтому можно считать, что свойства природного водорода соответствуют свойствам чистого протия.
Небольшие различия свойств, называемые изотопным эффектом, обусловлены различием масс изотопных атомов, которое в первую очередь сказывается на частоте колебаний атомов в молекулах и твердых телах. Так, колебательная энергия молекул T2 и D2 меньше, чем H2. А это, в свою очередь, сказывается на термодинамических свойствах: теплоемкости, температуре плавления и кипения, энтальпии плавления и испарения, давлении насыщенного пара и т.д. Так, D2 по сравнению с обычным водородом обладает меньшей теплоемкостью, теплопроводностью и скоростью диффузии. Таким образом, для изотопных соединений характерна термодинамическая неравноценность, а, следовательно, неравноценность активных комплексов при химических реакциях, в результате чего имеет место различие в скоростях протекания реакций, т.е. наблюдается кинетический изотопный эффект. Он выражается отношением констант скоростей химических реакций для различных изотопных соединений. Например, отношение констант скоростей синтеза HBr и DBr равно 5. Такие значительные отличия физических и химических свойств изотопов одного и того же элемента уникальны и не имеют аналогов в периодической системе. Все это в какой-то мере оправдывает применение для каждого изотопа водорода собственного названия (особенно для протия и дейтерия).
| Eдис(H2) = 436 кДж/моль | dH-H = 0,07414 нм |
| Eдис(D2) = 439,56 кДж/моль | dD-D = 0,07417 нм |
| t°пл(D2O) = 3,82 °C | t°кип(D2O) = 101,42 °C | ρ = 1,1050 г/см 3 (20 °C) |
Заметно с H2O различаются также энтальпия растворения солей, константы диссоциации кислот и другие характеристики растворов. Реакции в D2O идут медленнее, поэтому она является биологическим ядом.
Изотопы водорода: свойства, характеристика и применение
Любой химический элемент имеет разновидности природного или искусственного происхождения, называемые изотопами. Различие между ними заключается в неодинаковом количестве нейтронов в ядрах и, следовательно, в атомном весе, а также в степени стабильности. Что касается количества протонов, то оно одинаково, благодаря чему элемент, собственно, и остается самим собой. В этой статье мы обратимся к изотопам водорода – самого легкого и распространенного элемента во Вселенной. Нам предстоит рассмотреть их свойства, роль в природе и область практического применения.
Сколько разновидностей имеет водород
Ответ на этот вопрос зависит от того, какие изотопы водорода имеются в виду.
Для этого элемента установлено три природных изотопных формы: протий – легкий водород, тяжелый дейтерий и сверхтяжелый тритий. Все они обнаружены в естественном виде.
Таким образом, всего на сегодняшний день у водорода известно семь изотопных разновидностей. На трех из них, имеющих практическое значение, мы и сосредоточим свое внимание.
Легкий водород
Это наиболее просто устроенный атом. Изотоп водорода протий с атомной массой 1,0078 а. е. м. обладает ядром, в состав которого входит только одна частица – протон. Поскольку он стабилен (теоретически время жизни протона оценивается не менее чем в 2,9×10 29 лет), то стабилен и атом протия. При записи ядерных реакций он обозначается как 1 H1 (нижний индекс – это атомный номер, то есть число протонов, верхний – общее число нуклонов в ядре), иногда просто p – «протон».
Легкий изотоп – это почти 99,99 % всего водорода; лишь чуть более одной сотой процента приходится на остальные формы. Именно протий вносит решающий вклад в распространенность водорода в природе: во Вселенной в целом – около 75 % массы барионного вещества и приблизительно 90 % атомов; на Земле – 1 % массы и целых 17 % атомов всех элементов, входящих в состав нашей планеты. Вообще, протий (точнее сказать, протон как один из главных компонентов Вселенной) смело можно назвать важнейшим элементом. Он обеспечивает возможность термоядерного синтеза в недрах звезд, в том числе и Солнца, и за счет него образуются прочие элементы. Кроме того, легкий водород играет важную роль в построении и функционировании живого вещества.
В молекулярной форме водород вступает в химические взаимодействия при высоких температурах, поскольку для расщепления его достаточно прочной молекулы нужно много энергии. Атомарный водород характеризуется очень высокой химической активностью.
Дейтерий
Тяжелый изотоп водорода имеет более сложно устроенное ядро, состоящее из протона и нейтрона. Соответственно атомная масса дейтерия вдвое больше – 2,0141. Принятое обозначение – 2 H1 или D. Эта изотопная форма также стабильна, так как в процессах сильного взаимодействия в ядре протон и нейтрон постоянно превращаются друг в друга, и последний не успевает претерпеть распад.
На Земле водород содержит от 0,011% до 0,016% дейтерия. Концентрация его различна в зависимости от среды: в морской воде этого изотопа больше, а в составе, например, природного газа – существенно меньше. На других телах Солнечной системы отношение дейтерия к легкому водороду может быть иным: так, лед некоторых комет содержит большее количество тяжелого изотопа.
Дейтерий плавится при 18,6 К (легкий водород – при 14 К), а кипит при 23,6 К (соответствующая точка протия – 20,3 К). Тяжелый водород проявляет, в общем, те же химические свойства, что и протий, образуя все характерные для этого элемента типы соединений, однако ему присущи и некоторые особенности, связанные с серьезной разницей в атомной массе – ведь дейтерий тяжелее в 2 раза. Следует заметить, что по этой причине изотопным формам водорода свойственны наибольшие химические различия из всех элементов. В целом для дейтерия характерны более низкие (в 5 – 10 раз) скорости протекания реакций.
Роль дейтерия в природе
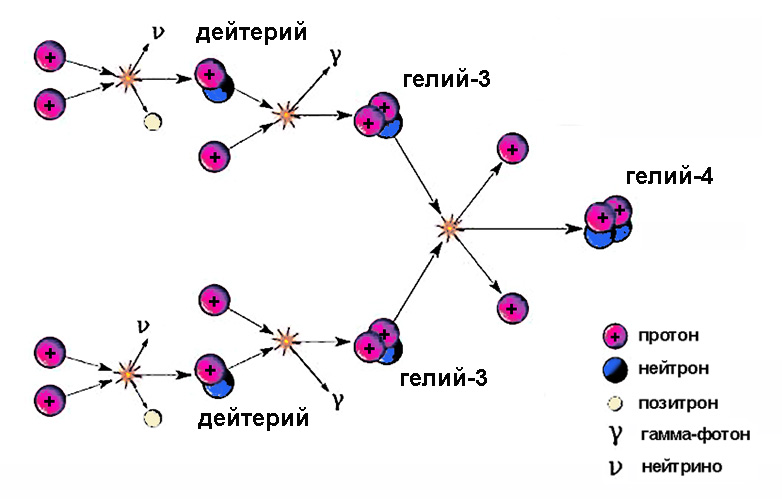
Ядра тяжелого водорода принимают участие в промежуточных стадиях термоядерного цикла. Солнце светит благодаря этому процессу, на одном из этапов которого образующийся изотоп водорода дейтерий, сливаясь с протоном, рождает гелий-3.
Вода, в состав которой входит, кроме протия, один атом дейтерия, называется полутяжелой и имеет формулу HDO. В молекуле тяжелой воды D2O дейтерий полностью заменяет легкий водород.
Тяжелая вода характеризуется замедленным течением химических реакций, вследствие чего в больших концентрациях она вредна для живых организмов, особенно высших, таких как млекопитающие и в том числе человек. Если в составе воды четверть водорода замещена дейтерием, длительное употребление ее чревато развитием бесплодия, анемии и других заболеваний. При замещении 50% водорода млекопитающие погибают через неделю употребления такой воды. Что касается кратковременных повышений концентрации тяжелого водорода в воде, она практически безвредна.
Как получают тяжелый водород
Удобнее всего получать этот изотоп в составе воды. Есть несколько способов обогащения воды дейтерием:
Тритий
Сверхтяжелый изотоп водорода, в ядре которого наличествуют протон и два нейтрона, имеет атомную массу 3,016 – примерно втрое больше, чем у протия. Тритий обозначается символом Т либо 3 H1. Он плавится и кипит при еще более высоких температурах: 20,6 К и 25 К соответственно.
Это радиоактивный нестабильный изотоп с периодом полураспада 12,32 года. Образуется он при бомбардировке ядер атмосферных газов, например, азота, частицами космических лучей. Распад изотопа происходит с испусканием электрона (так называемый бета-распад), при этом один нейтрон в ядре претерпевает превращение в протон, а химический элемент повышает атомный номер на единицу, становясь гелием-3. В природе тритий присутствует в следовых количествах – его очень мало.
Сверхтяжелый водород образуется в тяжеловодных ядерных реакторах при захвате дейтерием медленных (тепловых) нейтронов. Часть его доступна для извлечения и служит источником трития. Кроме того, его получают как продукт распада лития при облучении последнего тепловыми нейтронами.
Тритий характеризуется малой энергией распада и представляет некоторую радиационную опасность только в случаях, когда попадает внутрь организма с воздухом или пищей. Для защиты кожных покровов от бета-излучения достаточно резиновых перчаток.
Применение изотопов водорода
Легкий водород используется во множестве отраслей: в химической промышленности, где с его помощью ведется производство аммиака, метанола, соляной кислоты и других веществ, в нефтепереработке и металлургии, где он необходим для восстановления тугоплавких металлов из оксидов. Также он применяется на некоторых стадиях производственного цикла (в производстве твердых жиров) в пищевой и косметической промышленности. Водород служит одним из видов ракетного топлива и используется в лабораторной практике в науке и на производстве.
Дейтерий незаменим в ядерной энергетике как прекрасный замедлитель нейтронов. Он применяется в этом качестве, а также как теплоноситель в тяжеловодных реакторах, позволяющих использовать природный уран, что снижает затраты на обогащение. Он также, наряду с тритием, является компонентом рабочей смеси в термоядерном оружии.
Химические свойства тяжелого водорода позволяют использовать его в производстве медицинских препаратов в целях замедления выведения их из организма. И, наконец, дейтерий (как и тритий) имеет перспективы в качестве топлива в термоядерной энергетике.
Итак, мы видим, что все изотопы водорода так или иначе «находятся при деле» как в традиционных, так и в высокотехнологичных, имеющих прицел на будущее отраслях техники, технологии и научных исследований.
Свойства водорода
Изотопы водорода как разновидности атомов химического элемента водорода, имеющие разное содержание нейтронов в ядре, общая характеристика. Сущность понятия «легкая вода». Знакомство с основными достоинствами протиевой воды, анализ способов получения.
изотоп водород нейтрон
В отличие от стабильного дейтерия тритий радиоактивен и имеет период полураспада 12,26 лет. Тритий и тритиды металлов используются для получения ядерной энергии; например, в водородной бомбе происходит следующая реакция термоядерного синтеза:
Целью исследования является рассмотрение и анализ роли, которую играют изотопы водорода в жизни планеты и людей. Для этого необходимо детально разобраться в том или ином вопросе.
2. Изотопы водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия:
Температура плавления, K
Температура кипения, K
Тройная точка, K/kPa
Критическая точка, K/kPa
Плотность жидкий/газ, кг/м 3
Дейтерий и тритий также имеют орто- и парамодификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и парамодификаций.
Для водорода, как ни для какого другого элемента, относительное различие изотопных масс достигает значительной величины. Поэтому, хотя все изотопы характеризуются одинаковой электронной структурой, они заметно различаются не только физическими, но и химическими свойствами. Вследствие резкого преобладания протия влияние тяжелых изотопов сказывается незначительно и может быть зафиксировано лишь в очень точных экспериментах. Поэтому без большой погрешности можно считать, что свойства природного водорода соответствуют свойствам системы, состоящей из чистого протия.
Небольшие различия свойств, именуемые изотопным эффектом, обусловлены различием масс изотопных атомов, которое в первую очередь сказывается на частоте колебаний изотопов в молекулах и на твердых телах. Так, колебательная энергия молекул трития и дейтерия меньше, чем у протия. А это, в свою очередь, сказывается на термодинамических свойствах: теплоёмкости, температуре плавления и кипения, энтальпии плавления и испарения, давлении насыщенного пара и т.д. Так, дейтерий по сравнению с обычным водородом обладает меньшей теплоёмкостью, теплопроводностью и скоростью диффузии. Таким образом, для изотопных соединений характерна термодинамическая неравноценность. Последняя ведёт к неравноценности активных комплексов при химических реакциях, в результате чего имеет место различие в скоростях протекания реакций, т.е. наблюдается кинетический изотопный эффект. Он выражается отношением констант скоростей химических реакций для различных изотопных соединений. Например, отношение констант скоростей синтеза бромидов протия и дейтерия равно 5. Такие значительные отличия физических и химических свойств изотопов одного и того же элемента уникальны и не имеют аналогов в Периодической системе. Всё это в какой-то мере оправдывает применение для каждого изотопа водорода собственного названия (особенно для протия и дейтерия)[3].
Относительная масса легкого изотопа водорода определена прямо-таки с фантастической точностью: 1,007276470 (если принять массу изотопа углерода 12С равной 12,0000000). Если бы с такой точностью была измерена, к примеру, длина экватора, то ошибка не превысила бы 4 см!
4. Изотопные эффекты
5. Самый лёгкий изотоп водорода
Удельная энергия связи (на нуклон)
Сплин и чётность ядра
Протий составляет 99,9885±0,0070% от общего числа атомов водорода во Вселенной и является наиболее распространённым нуклидом в природе среди изотопов всех химических элементов. Является не металлом. В нормальных условиях прибывает всегда в газообразном состоянии, без цвета, вкуса и запаха, но при желании водород можно довести до сжиженного или затвердевшего состояния, но для этого нужна невероятно низкая температура и очень высокое давление.
Воду, в которой присутствует протий, называют «лёгкой водой», ведь вода, обогащённая лёгким водородом протием более подвижна, жизнеспособна. Протий в воде меняет кристаллическую решётку, на молекулярном уровне такая вода отдаёт все свои полезные свойства каждой клеточке организма без остатка, такая вода обладает большей растворяющей способностью, увеличивает скорость биохимических реакций, ускоряет процесс обмена веществ, вследствие чего оказывает нормализующее воздействие на весь организм.
Основную массу природной воды (свыше 99%) составляет протиевая вода.
Чистой в естественных условиях не существует. Во всем мире такую воду можно отыскать лишь в немногих специальных лабораториях. Её получают очень сложным путём и хранят с величайшими предосторожностями. Для получения чистой ведут очень тонкую, многостадийную очистку природных вод или синтезируют воду из исходных элементов и, которые предварительно тщательно очищают от изотопных примесей.
7. Достоинства протиевой воды
Талая вода биологически активна. Она стимулирует обмен веществ в организме, способствует лучшему выводу шлаков и токсинов, требует меньшее количество энергии для усвоения.
Регулярное употребление талой воды способствует оздоровлению и омоложению организма. От умывания такой водой кожа становится мягче шелка, а волосы лучше моются и легче расчесываются.
Достоинства протиевой воды:
ѕ Она очищена от примесей, насколько это возможно в домашних условиях.
ѕ Протиева вода оптимальна по насыщенности минеральными солями для повседневного применения.
8. Получение «лёгкой воды»
Вот как рекомендуют специалисты получать протиевую воду:
1. Налитую в емкость водопроводную воду необходимо отстоять в течение 6-8 часов для вывода из нее хлора. Для удобства лучше всего использовать в качестве емкости обычные пластиковые ПЭТ бутылки.
2. Затем, отстоянную воду поместить в холодильную камеру и периодически контролировать образование первого льда.
3. Образовавшийся первый лед это тяжелая вода, температура замерзания такой воды на 3,8? больше, т.е. тяжёлая вода или дейтериевая замёрзнет быстрее. Для отделения оставшейся в жидком состоянии воды ото льда, её необходимо перелить в другую емкость.
4. После чего лёд выбрасывают, а отделенную воду снова помещают на заморозку и ждут образования льда занимающего чуть более половины объема емкости, но не более 2/3.
Удельная энергия связи (на нуклон)
Спин и чётность ядра
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия)[7].
9. Появление дейтерия
Чтобы познакомиться с ним поближе, пришлось создавать эффективные способы разделения изотопов водорода. Началось с того, что Э. В. Уошборн и Г. Юри, исследовав старую воду из ванны промышленного электролизера, убедились, что в ней дейтерия больше, чем в обычной воде. Объяснение было найдено быстро: в процессе разложения воды на кислород и водород преимущественно выделяется легкий изотоп протий, дейтерий же соединен с кислородом более прочно. Так уже на первом этапе познания этого необычного изотопа было замечено одно из его важных химических отличий от водорода обычного.
Электролитический метод разделения изотопов водорода стал основным в годы, предшествовавшие второй мировой войне.
Сейчас с помощью этого метода получают воду, содержащую 99,9% дейтерия. Тяжелую воду D2O получают путем постепенного или, правильнее, поступенного разделения протиевой и дейтериевой воды. Ступеней обычно 5-7.
Эффективна для получения дейтерия и реакция изотопного обмена между водой и сернистым водородом[8].
10. Разница в свойствах протия и дейтерия
Прекрасные замедляющие свойства тяжелой воды полностью определяются ядерными характеристиками дейтерия. Медленные нейтроны почти не поглощаются дейтронами, а быстрые в среднем на одном столкновении с ним теряют 52% своей кинетической энергии. Всего 25 столкновений с атомами дейтерия, и нейтрон, освободившийся при делении тяжелого ядра (ядра урана, например), становится тепловым. Для графита аналогичное число столкновений равно 114. В обычной воде нужное замедление достигается уже после 18 столкновений, но протий в 700 раз сильнее дейтерия поглощает тепловые нейтроны.
11. Дейтерий в ядерных исследованиях
В этой реакции тритий был открыт Э. Резерфордом, М. Олифантом и П. Хартеком в 1934 г. при бомбардировке соединений, содержащих дейтерий, ускоренными дейтронами. Ученым удалось зарегистрировать появление частиц с зарядом, равным единице, и малым пробегом в воздухе. Из этих данных следовало, что масса частицы равна примерно трем. В дальнейшем по энергиям продуктов реакций и атомным массам известных изотопов водорода атомную массу трития удалось вычислить достаточно точно [10].
12. Сверхтяжёлый изотоп водорода