чем отличаются атомы химических элементов
§ 1.2. Атом как единица материи. Разновидности атомов. Химический элемент
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что, собственно, и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее греческих философов, атомы не являются абсолютным минимумом материи, так как сами имеют сложное строение.
В состав каждого атома входит три типа более простых частиц, называемых субатомными, которые подразделяются на протоны, электроны и нейтроны. Протоны и электроны имеют наименьший по модулю из существующих в природе зарядов и отличаются друг от друга знаком заряда: протоны заряжены положительно, а электроны — отрицательно. Масса протона примерно 2000 раз больше массы электрона.
Нейтроны имеют близкую с протонами массу и, как можно догадаться из их названия, нейтральны, то есть не имеют заряда. Протоны, электроны и нейтроны принято обозначать символами 1 p, e — и n0 соответственно.
Не следует считать, что все эти частицы в атоме перемешаны наподобие салата «Оливье». Такая теория некоторое время существовала в науке, но была опровергнута. На самом деле протоны с нейтронами сосредоточены в центре атома, образуя единое целое ядро, вокруг которого движутся электроны (см. рисунок 1).

Рисунок 1. Строение атома
Поскольку, как уже было сказано, масса протона практически равна массе нейтрона и примерно в 2000 раз больше массы электрона, можно сделать вывод о том, что практически вся масса атома сосредоточена в его ядре.
В каждом атоме количество протонов равно количеству электронов, в связи с чем суммарный заряд атома равен нулю. Поскольку количества протонов и электронов у любого атома равны, то получается, что атомы могут отличаться друг от друга либо количеством протонов (и, как следствие, электронов), либо количеством нейтронов, либо же и количеством и протонов, и нейтронов.
Следует отметить, что если атомы отличаются друг от друга только количеством нейтронов, а количество протонов у них одинаково, то это практически не влияет на их химическое поведение, то есть соединения, образованные такими атомами, практически идентичны по химическим свойствам, а по физическим отличаются друг от друга лишь немного.
Группу таких атомов с одинаковым химическим поведением принято называть химическим элементом. Легко догадаться, что внутри группы атомов одного химического элемента, скорее всего, есть разновидности атомов с разным количеством нейтронов. Такие разновидности химического элемента, отличающиеся только количеством нейтронов, называют изотопами.
В настоящий момент известно более 110 химических элементов, из которых стабильны около 90 – они могут быть обнаружены в природе, остальные же были получены искусственным способом.
Каждому химическому элементу в науке присвоены индивидуальные название и обозначение. Так, например, простейший химический элемент, в ядрах атомов которого содержится только один протон, называется «водород» и обозначается латинской буквой H, которую следует читать как «аш» и ни в коем случае не «эйч», как вы бы это могли невольно сделать на английский манер. Выбор именно данного символа обусловлен тем, что на латинском языке водород пишется как «Hydrogenum»; соответственно, в качестве символа данного элемента была взята первая буква этого латинского слова
В таблице 1 представлены наиболее часто встречающиеся в курсе химии элементы, их название, обозначение и общепринятое произношение.
Таблица 1. Названия и обозначения химических элементов
Автор текста Анисимова Е.С. Из курса лекций по химии.
Типы атомов. Химические элементы.
Что такое химический элемент.
Теперь обсудим вопрос о количестве протонов в атомах.
В природе есть атомы с одним протоном, с двумя, с тремя и т.д. – примерно до ста протонов. (114).
Атомы с одним протоном в каждом – это одна группа атомов, один тип атомов.
Атомы с двумя протонами в каждом – другая группа атомов, другой тип атомов.
Атомы с одинаковым числом протонов в каждом считаются атомами одного ТИПА.
Атомы с разным числом протонов в каждом считаются атомами разных типов.
Разные типы атомов (атомы разных типов) отличаются числом протонов.
Химический элемент
Ещё раз. Элемент водород – это не один атом водорода,
а все атомы с одним протоном в каждом,
то есть весь элемент, вся группа атомов с одним протоном.
Правильное название атома из группы атомов с одним протоном –
«атом химического элемента «водород»».
Или короче – «атом водорода».
Хотя часто атом водорода называют просто водородом, имея в виду «атом элемента водород».
Но вообще-то это неточное название, а самое главное –
оно может запутать тех, кто не знает разницы между атомом и элементом.
Более того, атомы водорода могут соединяться между собой по два:
такие соединения из двух атомов водорода называют молекулами водорода.
Но часто молекулы водорода называют просто водородом, то есть так же, как элемент. Что может запутывать ещё больше.
Читая про элемент водород, люди могут думать, что речь про молекулу водорода или наоборот.
Поэтому очень важно не путать названия элементов
с точно такими же названиями молекул (подробнее далее) или атомов.
Нужно понимать разницу между атомами и элементами и всегда сообщать слушателям (чтобы не запутать их),
какой водород имеется в виду – элемент, атом или молекула.
Говоря не просто «водород», а «элемент водород», «атом водорода» или «молекула водорода».
Даже если это как бы понятно из контекста.
«Просто водородом» допустимо называть разве что элемент водород –
например, во фразах типа «водород относится к неметаллам».
Но называть атом водорода просто водородом – всё равно что яблоко называть фруктами. Именно – не фруктом, а фруктами.
Также, встречая слово «водород», нужно самим задаться вопросом –
о каком водороде идёт речь – о молекуле, атоме или элементе.
Иначе понимание текста может быть ошибочным.
Теперь увеличим таблицу, добавив элементы и примеры веществ из их атомов.
А ещё – заряд ядра, который всегда равен числу протонов, так как ими и создаётся, а заряд одного протона равен единице.
Таблица «Первые 10 элементов»:
Число протонов
в атоме этого типа Заряд
ядра
атома Номер
элемента Число электронов
в атомах элемента Названия
элементов Символ
элемента
или его атома Вещества
из
атомов
элемента
Один +1 №1 (первый) 1 Элемент
Водород Н Молекула из двух атомов водорода
Н2
Два +2 №2 (второй) 2 Элемент
Гелий Не Атом гелия Не
Три +3 №3 (третий) 3 Элемент
Литий Li Атом лития
Li
Четыре +4 №4 (четвёртый) 4 Элемент
Бериллий Ве Атом
бериллия
Пять +5 №5 (пятый) 5 Элемент
Бор В Атом
бора
Шесть +6 №6 6 Элемент
Углерод С Атом углерода
С
Семь +7 №7 7 Элемент
Азот N Молекула из двух атомов азота
N2
Восемь +8 №8 8 Элемент
кислород O Молекула из двух атомов кислорода
О2
Девять +9 №9 9 Элемент
Фтор F Молекула из двух атомов фтора
F2
Десять +10 №10 10 Элемент
Неон Ne Атомы неона
11 +11 №11 11 Элемент
Натрий Na Атомы
натрия
Сотня химических элементов расставлены в специальной таблице,
которую называют периодической системой химических элементов Менделеева
или просто таблицей Менделеева (ТМ).
О ней см. отдельный файл.
Урок 1. Атомы и химические элементы
В уроке 1 «Атомы и химические элементы» из курса «Химия для чайников» рассмотрим, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выясним, что из себя представляет химический элемент и каким образом обозначается.
Все, что нас окружает, мы сами, Земля, на которой мы живем, состоит из самых разнообразных веществ. А из чего состоят сами вещества? Ведь их можно дробить на более мелкие части, а те, в свою очередь, на еще более мелкие. Где предел такого деления? Что представляют собой частицы, которые дальше уже нельзя раздробить обычными способами? Над этими вопросами задумывались ученые еще в глубокой древности.
Атомное строение веществ
Первые представления об атомах как мельчайших, далее неделимых частицах веществ появились у философов Древней Греции еще за 400 лет до н. э. Они считали, что каждое вещество составлено из присущих только ему атомов, т. е. существуют атомы, например, мяса, песка, дерева, воды и т. д. Другими словами, сколько есть веществ, столько и видов атомов.
Доказательств существования атомов в то время, конечно, не было, и это учение было забыто почти на две тысячи лет. И только в самом начале XIX в. идея атомного строения веществ была возрождена английским ученым Дж. Дальтоном.
Согласно его теории все вещества состоят из очень маленьких частиц — атомов. В процессе химических превращений атомы не разрушаются и не возникают вновь, а только переходят из одних веществ в другие. Они являются как бы деталями конструктора, из которых можно собирать всевозможные изделия.
Атомы — мельчайшие, химически неделимые частицы.
Химические элементы
Общее число атомов во Вселенной невообразимо велико. Однако видов атомов сравнительно немного. Каждый такой определенный вид атомов называется химическим элементом.
Химический элемент — определенный вид атомов.
Позже, после изучения строения атома, вы узнаете более точное определение этого понятия.
Всего в настоящее время известно 118 химических элементов. Атомы одного и того же элемента имеют одинаковые размеры, практически одинаковое строение и массу. Атомы разных элементов различаются между собой, прежде всего, строением, размерами, массой и целым рядом других характеристик.
На заметку: Из 118 химических элементов в природе встречается только 92, а остальные 26 получены искусственно с помощью специальных физических методов.
Из атомов такого небольшого числа химических элементов построены все вещества, существующие в природе и полученные химиками в лабораториях. А это более 60 млн веществ. Все они представляют собой самые различные сочетания атомов тех или иных элементов. Так же, как из 33 букв алфавита составлены все слова русского языка, из атомов относительно небольшого числа элементов состоят все известные вещества.
Символы химических элементов
Каждый элемент имеет свое название и условное обозначение — химический символ (знак).
Химический символ (знак) — условное обозначение химического элемента с помощью букв его латинского названия.
Символы химических элементов состоят из одной или двух букв их латинских названий. Понятно, что вторая буква нужна, чтобы различать элементы, в названиях которых первая буква одинакова. Например, элемент углерод обозначается первой буквой С его латинского названия — Carboneum (карбонеум), а элемент медь — двумя первыми буквами Cu его латинского названия — Cuprum (купрум).
Современные символы и названия наиболее распространенных элементов, необходимые вам на начальном этапе изучения химии, приведены в таблице под спойлером.
| Название химического элемента | Химический знак элемента | Относительная атомная масса (округленная) |
| Азот | N | 14 |
| Алюминий | Al | 27 |
| Водород | H | 1 |
| Железо | Fe | 56 |
| Золото | Au | 197 |
| Калий | K | 39 |
| Кальций | Ca | 40 |
| Кислород | O | 16 |
| Кремний | Si | 28 |
| Магний | Mg | 24 |
| Медь | Cu | 64 |
| Натрий | Na | 23 |
| Ртуть | Hg | 201 |
| Свинец | Pb | 207 |
| Сера | S | 32 |
| Серебро | Ag | 108 |
| Углерод | C | 12 |
| Фосфор | P | 31 |
| Хлор | Cl | 35,5 |
| Цинк | Zn | 65 |
Если вы хотите познакомиться с названиями и символами всех химических элементов, загляните сюда. Там представлена периодическая система элементов, о которой вы узнаете позже.
Распространенность химических элементов в природе крайне неравномерна. Самый распространенный элемент в земной коре (слое толщиной 16 км) — кислород О. Его содержание составляет 49,13 % от общего числа атомов всех элементов. Доли остальных элементов показаны на рис. 28.
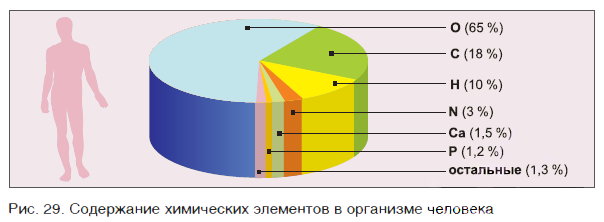
В организме человека на долю атомов кислорода приходится 65 % от массы тела, в то время как доля атомов углерода — 18 %, водорода — 10 %, азота — 3 % (см. рис. 29).
Во всей нашей Галактике почти 92 % от общего числа всех атомов приходится на долю водорода Н, 7,9 % — на долю гелия He и только 0,10 % — на атомы всех остальных элементов. Именно эти два самых легких элемента составляют основу звездной материи.
Краткие выводы урока:
Надеюсь урок 1 «Атомы и химические элементы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Чем атом отличается от элемента. Чем отличаются атомы? Что такое изотопы
Чем отличаются понятия «атом» и «молекула»? и получил лучший ответ
Ответ от Диана Мамина [гуру]
Молекула состоит из атомов.
Ответ от НЕТ [гуру]
Кроме общих мест, ещё и родом.
Ответ от Мариям Абдулла [новичек]
еще у атомов электрический заряд, тогда как молекула нейтральна
Ответ от Мурват Казымов [новичек]
атом это то из чего состоит молекула
Вся материя вокруг нас, которую мы видим, состоит из различных атомов. Атомы отличаются друг от друга строением, размером и массой. Существует более 100 видов различных атомов, более 20 видов атомов были получены человеком и не встречаются в природе, так как неустойчивы и распадаются по более простые атомы.
Существующие химические элементы перечислены в Периодической таблице Менделеева. Часто о ней говорят как о системе (периодическая система), потому что существуют определенные строгие правила по которым тот или иной элемент помещается в свою ячейку таблицы. В строках и столбцах периодической таблицы наблюдаются закономерные изменения свойств элементов. Таким образом, у каждого элемента в таблице есть свой номер.
Атомы химических элементов не изменяются в результате химических реакций. Изменяется набор веществ, образуемых атомами, но не они сами. Например, если в результате химической реакции угольная кислота (H 2 CO 3) разложилась на воду (H 2 O) и углекислый газ (CO 2), то никаких новых атомов не образовалось. Изменились лишь связи между ними.
Таким образом, атом можно определить как мельчайшую химически неделимую частицу вещества.
Самым распространенным элементом во Вселенной является водород, затем следует гелий. Это самые простые по строению химические элементы. На остальные химические элементы приходится около 0,1% от всех атомов. Однако атомы остальных химических элементов имеют большую массу, чем атомы водорода и гелия. Поэтому если выражать содержание остальных химических элементов во Вселенной в массовых процентах, то на них придется 2% от массы всего вещества Вселенной.
На Земле распространенность химических элементов сильно отличается, если рассматривать всю Вселенную. На Земле преобладают кислород (O) и кремний (Si). На их долю приходится около 75% массы Земли. Далее идут по убыванию алюминий (Al), железо (Fe), кальций (Ca), натрий (Na), калий (K), магний (Mg), водород (H) и многие другие элементы.
Атом и ион – элементарные частицы химических элементов. Эти частицы являются носителями свойств элементов. Отличаются они зарядами: атом нейтрален, а ион бывает положительно или отрицательно заряженным.
Определение
Атом – электрически нейтральная микроскопическая частица химического элемента, определяющая его свойства. Центр атома – положительно заряженное ядро, окруженное электронным облаком, по орбиталям которого движутся электроны. Атомы, присоединяя или отдавая электроны, превращаются в ионы.
Ионы – микроскопические электрически заряженные, одноатомные или многоатомные и химически активные частицы. Они обладают положительным (катионы) или отрицательным (анионы) зарядом. Ионы образуются из атомов или групп атомов, приобретающих электроны или, наоборот, теряющих их.
Ионы – самостоятельные частицы, встречающиеся в любых агрегатных состояниях. Они есть в газах (в атмосфере), в кристаллах, в жидкостях (и растворах, и расплавах) и в плазме (межзвездном пространстве.)
Ионы в химических реакциях способны взаимодействовать между собой, с молекулами и атомами. В растворах эти активные частицы образуются в процессе электролитической диссоциации и определяют свойства электролитов.
Сравнение
Атом всегда электрически нейтрален, ион, напротив, заряженная частица. У атомов внешние энергетические уровни, как правило, не завершены (исключением является группа благородных газов). У ионов же внешние уровни завершены.
Ион в противоположность атому не способен обладать свойствами простого вещества. Например, металлический калий вступает в бурную реакцию с водой, продуктами которой становится водород и щелочь. А ионы калия, имеющиеся в составе солей калия, не обладают подобными свойствами. Хлор – желто-зеленый ядовитый газ, а его ионы не ядовиты и бесцветны.
Цвет меди – красный, а ее ионы в растворах приобретают голубую окраску. Кристаллы йода – серые, пары – фиолетовые, спиртовой раствор – красно-бурого цвета, в смеси с крахмалом он дает синее окрашивание. Ионы йода не могут изменить окраску крахмала, они бесцветны.
Выводы сайт
В переводе «атом» означает неделимый. Назван он так потому, что долгое время его считали наименьшей частью вещества. Но дальнейшее развитие науки показало, что это не так. Итак, давайте разберемся, из чего состоит атом и чем отличаются атомы различных элементов.
Строение атома
Атомы различных элементов
Поскольку количество протонов у различных атомов разное, массы у них тоже отличаются. Масса элемента в основном формируется протонами и нейтронами, ведь вес электронов ничтожно мал. Но даже у атомов одного и того же элемента вес может отличаться из-за разного количества нейтронов в ядре. Атомы, у которых количество нейтронов отличается от количества протонов, называют изотопами. Например, в природе существуют атомы углерода С12 (6 протонов и 6 нейтронов), С13 (6 протонов и 7 нейтронов) и другие разновидности с содержанием нейтронов от 2 до 16.
Внимание, только СЕГОДНЯ!
ДРУГОЕ
Иностранное слово «альфа» прочно прижилось в русском языке и встречается в самых разных сочетаниях. О том,…
Слово «ядро» означает сердцевину чего-либо, имеющую форму шара. Однако значения у данного понятия могут быть разными, в…
Каждый из нас хоть раз, но любовался прекрасным ночным небом, усыпанным множеством звёзд. Не задумывались ли вы о том,…
Определение большого адронного коллайдера звучит так: БАК является ускорителем заряженных частиц, и создан он с целью…
Существует невидимая сила, которая протекает внутри биологических объектов и неживой среды. Эта сила называется…
Не так много людей хорошо разбираются в различных терминах, теориях и законах физики и химии. А некоторые, может быть,…
Реакции между разного рода химическими веществами и элементами являются одним из главных предметов изучения в химии.…
Понятие вещества изучается сразу несколькими науками. Вопрос о том, какие есть вещества, мы разберём с двух точек…
На уроках химии в школе учат решать различные задачи, популярными среди которых являются задачи на вычисление…
Электрический заряд – физическая величина, которая определяет способность тела принимать участие в электромагнитных…
Степень окисления – это условный заряд атома в молекуле, он получает атом в результате полного принятия электронов, его…
Чем отличаются атомы?
В переводе «атом» означает неделимый. Назван он так потому, что долгое время его считали наименьшей частью вещества. Но дальнейшее развитие науки показало, что это не так. Итак, давайте разберемся, из чего состоит атом и чем отличаются атомы различных элементов.
Строение атома
Атомы различных элементов
Поскольку количество протонов у различных атомов разное, массы у них тоже отличаются. Масса элемента в основном формируется протонами и нейтронами, ведь вес электронов ничтожно мал. Но даже у атомов одного и того же элемента вес может отличаться из-за разного количества нейтронов в ядре. Атомы, у которых количество нейтронов отличается от количества протонов, называют изотопами. Например, в природе существуют атомы углерода С12 (6 протонов и 6 нейтронов), С13 (6 протонов и 7 нейтронов) и другие разновидности с содержанием нейтронов от 2 до 16.
Атомы химических элементов
Для начала выясним что такое элемент?
Элемент — это вещество, которое состоит исключительно из атомов одного вида.
Например кусок висмута содержит только атомы висмута, причем все они химически идентичны. Мы можем этот кусок размельчить кузнечным молотом, а затем размолоть в порошок. Однако каждый кусок, каждая отдельная частичка порошка — это все еще висмут. Мы можем нагревать его до тех пор, пока он не потечет как вода, или пока он не закипит, и каждый атом не вылетит в воздух. Но мы все еще будем иметь те же атомы химического элемента висмута и ничего более.
Большинство атомов способно соединяться с другими, образуя при этом молекулы. Атом одного химического элемента может соединяться с другими подобными атомами. Так, два атома кислорода образуют молекулу кислорода. Атом может также соединяться с одним или с несколькими атомами других элементов, образуя молекулы или химические соединения.
Удивительно в химическом процессе то, что при соединении двух различных атомов образуется совершенно иное вещество с новыми свойствами. Сильно воспламеняющийся газ — водород, соединяясь с кислородом, образует воду. Два ядовитых вещества: газообразный хлор и мягкий серебристо-белый металл натрий, соединяясь, образуют обычную столовую соль.
Другое хорошо известное соединение — сахар удается без труда разложить на более простые составные части. Для этого нужно положить некоторое количество сахара в реторту и нагреть ее. Вскоре молекулы сахара начнут распадаться. Образующийся черный остаток указывает на то, что сахар частично состоит из углерода. Другие атомы, которые были связаны в молекуле сахара, разъединяются, испаряются и конденсируются в виде капелек, которые стекают в стакан. Оказывается, эти капли — обычная вода. Мы можем пойти еще дальше и пропустить электрический ток через полученную воду, поместив ее в аппарат для электролиза. При этом молекула воды разлагается на водород и кислород, которые выделяются в виде отдельных пузырьков.
Сахар, таким образом, состоит из следующих химических элементов: углерода, водорода и кислорода. Каждая молекула сахара содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.Значит, химическая формула сахара выглядит так: С12Н22О11.
В реторте мы имели дело с миллиардами миллиардов молекул сахара, но интересно выяснить, что же происходит с каждой молекулой в отдельности.
Наглядное представление об этом процессе можно получить с помощью модели.
Черные шарики изображают атомы углерода, белые — атомы водорода и красные — атомы кислорода. Палочки показывают химические связи, которые удерживают отдельные атомы элемента вместе. Это, конечно, не совсем та молекула сахара, которая оказалась бы на самом деле, если бы мы могли увидеть ее, но все же модель хорошо иллюстрирует общее расположение атомов внутри молекулы.
При нагревании молекула разлагается. 12 атомов углерода остаются на дне реторты, а 11 молекул воды переходят в пар. Этот результат можно выразить таким уравнением:
Другими словами, из одной молекулы сахара образуется 12 атомов углерода и 11 молекул воды. Наконец, когда молекулы воды разлагаются, из них возникают 22 атома водорода и 11 атомов кислорода. Они соединяются парами, образуя 11 молекул водорода (Н2) и 5 1 /2 молекул кислорода (О2) на каждую разложенную молекулу сахара.
Можно написать эту реакцию при помощи целых чисел, если удвоить число молекул воды, участвующих в реакции:
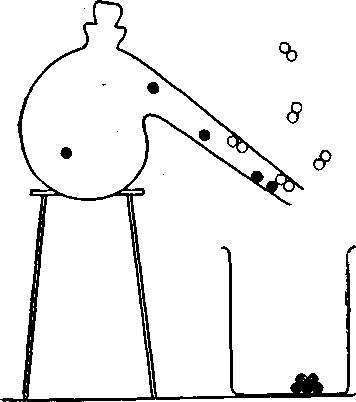
В другом эксперименте будем нагревать химическое соединение — окись ртути, представляющее собой порошок красного цвета. Название этого соединения говорит о том, что оно состоит из ртути и кислорода.
Вначале окись ртути изменяет окраску. Затем она закипает и начинает испаряться из колбы. Образовавшиеся газы, после того как они вырываются через шейку реторты, охлаждаются. Ртуть образует капли, которые собираются в стакане. Кислород также выделяется из реторты.
Мы не можем увидеть газообразный кислород, но зато сможем установить его присутствие, поднеся к реторте тлеющую деревянную лучинку. В атмосфере почти чистого кислорода лучинка загорается ярким пламенем.
Таким образом, нами установлено, что сухой красный порошок состоит из блестящего жидкого металла и газа, способного поддерживать горение. Молекула окиси ртути намного проще молекулы сахара. Она состоит всего лишь из двух атомов — ртути (символ которой — Hg) и кислорода. Это сразу видно из формулы окиси ртути: HgO.
При нагревании молекулы окиси ртути разлетаются в стороны, ударяются друг о друга или о стенки реторты. Каждая молекула разрушается, атом кислорода отскакивает от атома ртути.
Одиночные атомы ртути проходят через шейку реторты,, как обычный газ, и при охлаждении конденсируются в форме капелек. Атомы кислорода соединяются попарно и выделяются в виде газа. Этот процесс можно совсем просто записать с помощью химических символов:
Однако, так как молекулы кислорода состоят из двух атомов, то свободный кислород, т. е. молекулу кислорода, надо обозначить символом О2. Так что мы должны поправить эту запись, заменив одну молекулу окиси ртути на две:
Это означает, что две молекулы HgO образуют два атома ртути и одну молекулу кислорода, которая, естественно, содержит два атома кислорода. Таким образом, окись ртути, как и сахар, является скоплением одинаковых молекул, каждая из которых построена из атомов более чем одного сорта.
Пять чистых жидкостей, которые мы испытывали ранее, также были простыми соединениями (точнее, последняя из них была раствором двух соединений). Кстати, все пять жидкостей состояли только из газообразных или из газообразных и твердых элементов. Эти жидкости:
Для получения пяти различных жидкостей было использовано всего шесть элементов. Но даже если взять всего два элемента — водород и углерод, то из них можно получить тысячи различных соединений, в частности парафин, керосин, пластмассы.
Свойства таких углеводородов зависят только от относительного числа атомов углерода и водорода в каждой молекуле, а также от способа, по которому атомы соединяются вместе.
Конечно, нужно взять много квадриллионов молекул, чтобы получить видимые или весомые количества углеводорода или какого-либо другого соединения. Ведь размер атома углерода порядка одной пятидесятимиллионной сантиметра.
Свойства атомов химических элементов
Что же касается атомного ядра, то оно еще меньше атома: диаметр атома превосходит диаметр его ядра примерно в десять тысяч раз. Если мы представим себе атом углерода увеличенным до размеров футбольного поля, то электроны будут похожи на мух, летающих над стадионом, а ядро — на футбольный мяч, причем этот мяч будет а тысячи раз тяжелее всех мух (т. е. электронов) вместе взятых.
Это означает, что более 99,9% всего вещества Вселенной сконцентрировано в очень маленьких ядрах атомов. И таким образом, атом является в основном пустым пространством.
О весе атома можно получить представление, основываясь на том, что равные объемы всех простых газов и паров содержат одинаковое число молекул. Если мы на каждую чашку весов положим колбы горловинами вниз, мы уравновесим один литр воздуха другим. Если теперь одну из колб наполнить водородом, вытеснив из нее воздух, то разница в весах этих колб покажет, насколько литр воздуха тяжелее литра водорода.
Можно пересчитать это на одну молекулу — путем очень длинного деления. Ведь известно, что в каждой колбе имеется одинаковое число молекул — примерно 26 870 000 000 000 000 000 000.
Число атомов будет вдвое больше, ибо свободные азот и кислород (основные компоненты воздуха), как и водород, имеют по два атома в молекуле.
Равные объемы некоторых металлов также весят по-разному, в зависимости от весов их атомов* Например, одинаковые кубики магния, железа, свинца и урана, подвешенные на одинаковых резинках, растянут их на разную длину.
Это, однако, дает только приблизительное представление об относительных весах атомов. Получить же их точные веса несравненно труднее: надо знать, насколько тесно атомы твердых элементов упакованы в различных материалах. Действительные атомные веса, взятые относительно веса атома кислорода, принятого равным 16, указаны в периодической системе. Они приблизительно равны: 238 — для урана, 207 — для свинца, 56 — для железа и 24 — для магния.
Следовательно, атом урана весит приблизительно столько, сколько весят 238 атомов водорода или 15 атомов кислорода.
Таково одно из многих сведений, содержащихся в периодической таблице. Периодическая таблица указывает также основные данные, которые необходимы для выяснения того, как атомы соединяются между собой.
Строение атомов химических элементов
Начнем с первого элемента — водорода, потому что его ядро представляет собой всего-навсего один протон. А протоны, как нам уже известно, являются основными частицами, из которых состоят ядра всех других элементов.
Каждый материальный объект во Вселенной состоит из атомов одного или более элементов. Общее число элементов немного больше ста, так что мы будем правы, если назовем атомы химическтх элементов строительными кирпичиками материи.
Но все элементы построены из одних и тех же основных ( фундаментальных ) частиц — протонов, нейтронов и электронов. Что же делает один элемент отличным от другого? Не что иное, как число протонов, нейтронов и электронов, входящих в его состав.
Протон — это частица с единичным зарядом положительного электричества. Он в то же время является ядром атома водорода и составляет более 99,9% его атомного веса.
Итак, ядро водорода — протон имеет заряд 1, как можно видеть из периодической таблицы, в которой указано, что атомный номер водорода равен 1. Мы можем изобразить его в виде кружочка со знаком +. Если мы добавим к протону вторую частицу такого же веса, но без электрического заряда, то такая система будет иметь вес, равный двум. Но ее заряд остается равным 1, так как в ней имеется только один протон. Нейтральная частица — нейтрон имеется в ядре каждого элемента, за исключением обычного водорода. Если теперь добавить сюда второй протон и второй нейтрон, то получится сложная частица с зарядом 2 и весом 4.
Из периодической таблицы нетрудно установить, что эта частица представляет собой ядро атома гелия, у которого атомный номер равен 2, а массовое число — 4. Массовое число — это общее число протонов и нейтронов, т. е. это атомный вес элемента, округленный до целого числа.
Если мы добавим к ядру гелия третий протон и третий нейтрон, то получим ядро лития, называемое литием-6. Это ядро имеет положительный заряд 3 и массовое число 6.
Наиболее распространенной формой этого серебристо-белого металла является литий-7, в состав которого входит еще один нейтрон. 92% природного лития состоит из лития-7, имеющего атомный вес 7,02 и массовое число 7. Средний же атомный вес природного лития (содержащего литий-6 и литий-7) равен 6,940.
Прибавляя протоны и нейтроны к этому ядру, мы будем получать ядра все более тяжелых элементов.
Но атом не станет атомом до тех пор, пока ядро не будет окружено соответствующим числом электронов — по одному электрону на каждый протон. Электрон — это единичный заряд отрицательного электричества, и он точно уравновешивает положительный заряд протона.
Таким образом, атом водорода состоит из одного протона и единственного электрона, вращающегося вокруг него.
Для атома химического элемента гелия потребуются два электрона, чтобы уравновесить положительный заряд 2, обусловленный его двумя протонами. Для атома характерно то, что только строго определенное число электронов может находиться на каждой данной орбите, или оболочке. Орбита, ближайшая к ядру, может иметь только два электрона. В этом случае считается, что первая оболочка заполнена, и далее начнет заполняться следующая орбита, на которой может находиться 8 электронов. Так, в атоме лития, как и в атоме гелия имеются два электрона на первой оболочке и, кроме того, третий электрон, одиноко вращающийся на внешней орбите.
В действительности орбиты трехмерны, а электроны движутся по поверхности воображаемой сферы. Причем их реальные пути намного сложнее, чем можно представить себе из нашего упрощенного описания.
Рассмотрев следующие семь элементов, мы обнаружим, что у них постепенно заполняется вторая оболочка. Последний из них, неон, имеет 10 протонов в ядре и 10 электронов на двух оболочках.
В атоме неона вторая оболочка с ее восемью свободными местами заполнена до предела. Внутренняя, двухэлектронная оболочка, конечно, тоже заполнена. Таким образом, неон, подобно гелию, является также «укомплектованным» атомом — в нем нет свободных мест или внешних, избыточных электронов.
После неона идет натрий, имеющий 11 протонов и 11 электронов. Одиннадцатый электрон одиноко вращается на третьей оболочке. Натрий, который в периодической таблице помещен непосредственно под литием и водородом, имеет, так же как и они, единственный электрон на своей внешней орбите.
Теперь мы начинаем понимать, почему мы говорим — периодическая таблица элементов. Мы установили, что определенные свойства атомов периодически повторяются, если располагать элементы по порядку возрастания их атомных номеров.
Важно, что каждый раз, когда к ядру прибавляется один протон, атом также должен получить и один дополнительный электрон. Этот электрон, обычно помещаемый на внешнюю орбиту, необходим для того, чтобы сохранить электрическую нейтральность атома в целом.
Следовательно, от числа протонов в ядре зависит количество электронов, вращающихся вокруг ядра. В нейтральном атоме должно находиться всегда одинаковое число протонов и электронов.
Число этих электронов и характер их размещения на возможных орбитах — это и определяет химические свойства любого данного элемента. Химические свойства просто означают, как элемент должен соединяться (или отказываться соединяться) с другими элементами. Они указывают также на то, насколько легко элемент должен соединяться и насколько устойчиво будет это соединение.
Химические свойства зависят от числа и расположения электронов в атоме и никак не связаны с протонами и нейтронами, находящимися в самом ядре.
Число нейтронов в атомном ядре, однако, различно для различных изотопов одного и того же элемента. Слово изотоп означает: занимающий то же самое, или равное (iso), место (topos). Изотопы элемента занимают одно и то же место в периодической системе и имеют одинаковое число протонов и электронов. Хорошим примером может служить природный литий, который содержит два изотопа: литий-6 и литий-7.
Главное, что отличает изотопы,— это их разные атомные веса, а нередко и радиоактивность.
Если мы возьмем атом водорода (протон с вращающимся вокруг него электроном) и добавим к его ядру нейтрон, то нам нет нужды прибавлять электрон: нейтрон не имеет заряда и не нуждается в электроне для сохранения электронейтральности атома. А так как мы не изменили числа электронов, то не изменили и химических свойств атома.
Единственное, что изменено, так это вес атома. У водорода имеется три изотопа: обычный водород, содержащий только протон в ядре; дейтерий, который имеет еще нейтрон, и поэтому его атомный вес равен 2; наконец, радиоактивный тритий, который имеет вес примерно три атомных единицы и содержит 1 протон и 2 нейтрона в ядре.
Природный уран — это, главным образом, изотоп U-238 с 92 протонами и 146 нейтронами в ядре. Но в природном уране содержится и другой хорошо известный изотоп U-235, способный к делению и служащий поэтому источником атомной энергии. U-235 имеет также 92 протона, но только 143 нейтрона, т. е. три единицы меньше атомного веса U-238. Наличие изотопов означает, что мы были не совсем точны, когда определяли элемент как вещество, все атомы которого идентичны.
Ядро атома трехмерное, а не плоское, каким мы его изображали. Некоторые ядра имеют почти сферическую форму, подобно футбольному мячу. Зато другие, в частности уран, более похожи на мяч для игры в регби (по форме он напоминает дыню).