чем остановить рост опухоли
Во власти опухоли: почему метастазы так сложно остановить?
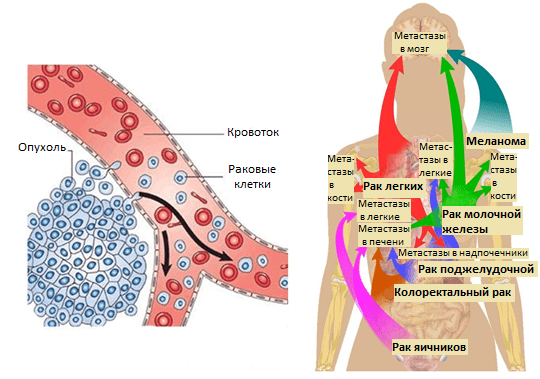
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда в организме случилось несчастье, и из 100 триллионов нормальных клеток хоть одна переродилась в раковую и не была уничтожена, срабатывает спусковой крючок, и запускается рост опухоли. Постепенно она приспосабливает к себе окружающие клетки, а также оказывает значительное влияние на весь организм. С развитием заболевания некоторые раковые клетки покидают опухоль и формируют метастазы — вторичные очаги опухолевого роста. Зачастую своевременное удаление первичной опухоли и послеоперационная терапия не способны вызвать ремиссию. Оказывается, что первичная опухоль способна «обучать» микроокружение в очагах развития будущих метастазов уже на ранних этапах своего роста. Кроме того, метастазные раковые клетки перепрограммируют экспрессию своих генов так, чтобы лучше прижиться в новом месте обитания. Знание того, как предотвратить эти процессы, а не только рост первичной опухоли, поможет спасти до 90% людей, умирающих от основных видов рака.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Революция в понимании природы метастазирования
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
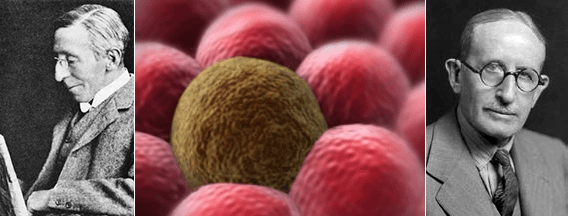
Процесс рассеивания раковых клеток по организму, названный метастазированием (от древнегреч. «менять, переносить»: meta — «через» + histanai — «устанавливать»), впервые описал еще в 1889 году Стивен Педжет [4], но механизм его развития оставался загадкой для ученого сообщества долгое время (рис. 2).
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Педжет провел аналогию такого распространения раковых клеток с прорастанием семян. Они тоже выживают и делятся на плодотворной «почве» — в подходящем микроокружении. В те времена невозможно было найти этому экспериментального подтверждения, и долго преобладала совсем иная теория — Джеймса Юинга (рис. 2). Он утверждал, что основную роль в распределении метастазов по организму играет динамика кровотока и устройство сосудистой системы.
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
Генетическая и эпигенетическая гетерогенность при метастазировании
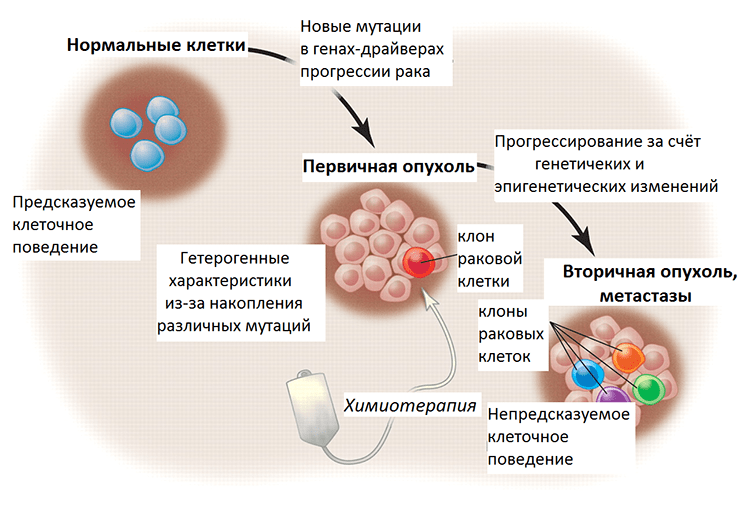
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
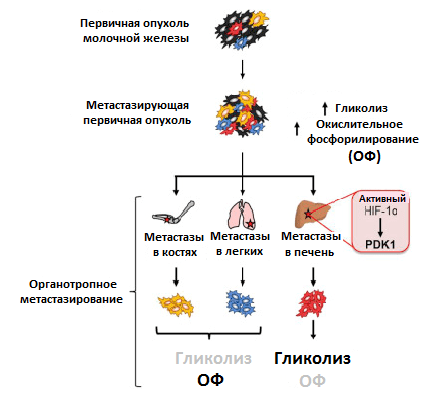
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
И все же метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей — освоением совершенно незнакомого места обитания. Эксперименты группы Дэвида Лидена в 2005 году впервые показали, что первичная опухоль за счет продуцируемых факторов стимулирует формирование так называемых преметастазных ниш в различных органах. Ученые показали, что раковые клетки первичной опухоли за счет стимулирования рецептора фактора роста сосудов (VEGFR-1) на миелоидных клетках-предшественниках активируют их распространение из костного мозга в известные очаги развития метастазов [13]. Кроме того, в этих очагах запускается избыточная экспрессия фибробластами одного из компонентов внеклеточного матрикса (ВКМ) — фибронектина. Миелоидные клетки-предшественники, имея рецепторы клеточной адгезии (интегрины) к этому белку, активно «ловятся на удочку» и заселяют преметастазные ниши. Они секретируют воспалительные цитокины, факторы роста и проангиогенные факторы, стимулирующие формирование сосудов. Это способствует ремоделированию стромы и колонизации ее метастазами (рис. 5) [13].
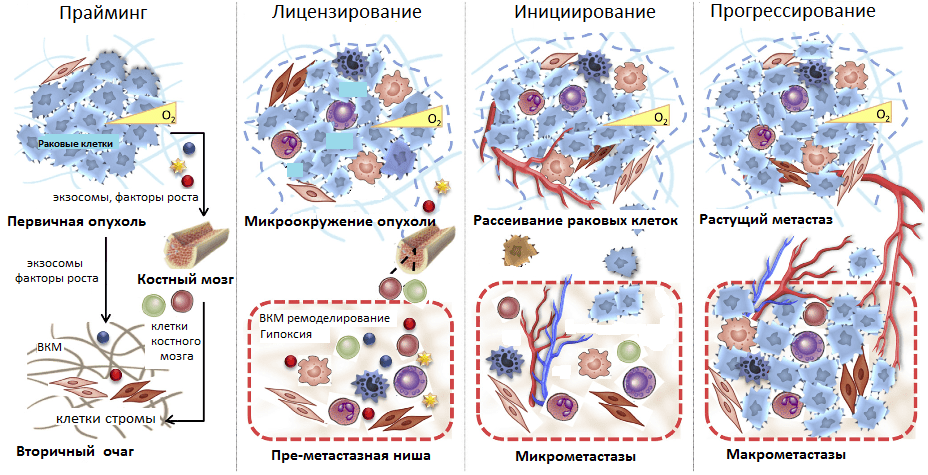
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
Хотя для большинства органов характерна эта общая схема, существуют некоторые особенности в зависимости от места (органа) формирования ниши. Например, преметастазная ниша в печени и легких также формируется за счет привлечения нейтрофилов. Известно, что они могут помогать метастазирующим клеткам при интеграции в новую нишу за счет секретирования протеаз, цитокинов и непосредственного контакта с раковыми клетками при выходе из капилляров. Другой пример — клетки рака поджелудочной железы. Они выделяют экзосомы — липидные везикулы, которые переносят макрофаг-ингибирующий фактор (MIF). Их поглощают клетки Купфера в печени, и это запускает цепочку обучения ниши. Клетки Купфера синтезируют трансформирующий фактор роста β (TGF-β), клетки Ито активируются им и запускают перестраивание ВКМ, затем привлекая к нему макрофагов [15]. Их роль в микроокружении опухоли подробнее рассмотрена в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [16].
Метастазы в костях — одни из самых коварных, и их преметастазная ниша по-своему особенна. Например, оказалось, что при раке молочной железы только раковые клетки без рецепторов к эстрогену метастазируют в кости. Такие клетки первичной опухоли активно выделяют фермент лизилоксидазу. В костях он вызывает образование взрослых остеокластов и за счет этого стимулирует резорбцию кости. [17]. Именно эти «емкости» внутри кости метастазы занимают позднее. Другая и, пожалуй, основная функция лизилоксидазы — формирование поперечных связей между коллагеновыми волокнами ВКМ — также связана с образованием преметастазных ниш, но в легких. Преобразование коллагеновых волокон привлекает миелоидные клетки, а те позднее разрушают коллагеновые сети и дают путь раковым клеткам при заселении ткани легкого [18].
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
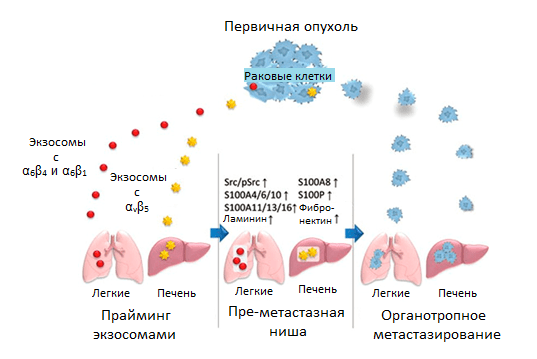
Ключевой механизм, известный на данный момент, основан на обучении будущих очагов рассеивания метастазов с помощью специфичных к ним экзосом. Эти везикулы, ранее описанные в статье «Экзосома — механизм координации и взаимопомощи клеток организма» [20], представляют собой структуры с рецепторами на своей поверхности и генетическим и секретируемым материалом внутри. Ученые провели интересный эксперимент — выделили экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и пр.) и, внедрив их в кровоток мышей с отличным типом опухоли, показали, что с их помощью возможно перепрограммировать распределение метастазов по органам. Это обусловлено тем, что экзосомы разных типов рака преимущественно содержат на своей поверхности основные рецепторы адгезии, интегрины, специфичные к определенному белку ВКМ (к ламинину — α6β4 и α6β1; к фибронектину — αvβ5 и т.д.).
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
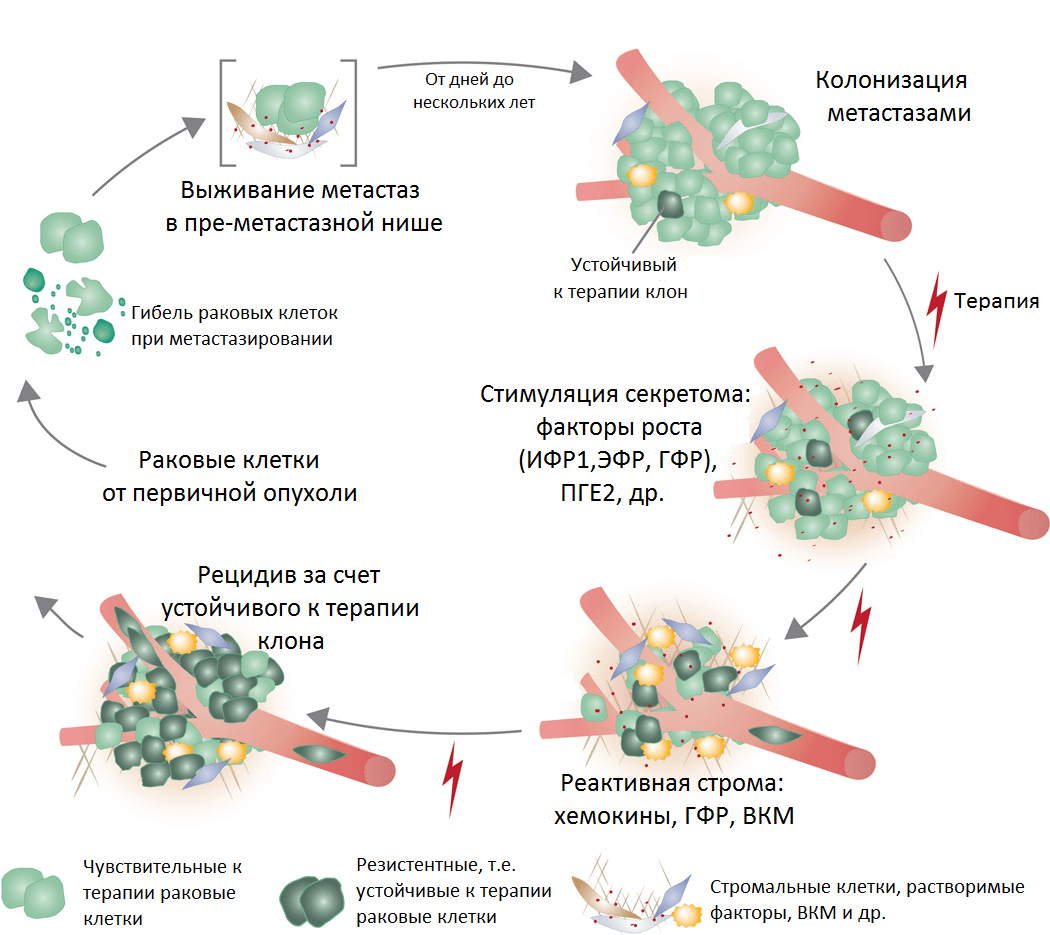
Мы также знаем, что после химиотерапии зачастую выживают субклоны раковых клеток с полезными в новой среде мутациями. Под стрессом воздействия цитостатиков субклоны раковых клеток активируют секрецию факторов роста и запускают клеточную сигнализацию, препятствующую гибели (рис. 7). Кроме того, их выживанию помогает поддержка клеток стромы, заодно изменяющих свое поведение на «оборонительное» под эффектом терапии.
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.
Чем остановить рост опухоли
Аргументы и Факты
Вакцина против рака. Бороться с опухолью могут иммунные клетки больного
Меланома. Саркома. Рак прямой кишки. Каждый из этих диагнозов звучит как приговор. Традиционные методы лечения не помогают. Девять из десяти больных погибают в первый же год после диагноза. Остановить прогрессирование болезни – значит спасти жизнь. Пусть на время, пусть на 10–15 лет, но всё-таки…
Иммунная система пациента с агрессивной формой рака словно вывешивает белый флаг и в упор не видит опасные для жизни клетки. Но научить её распознавать клетки новообразования и бороться с ними всё-таки возможно.
Лаборатория в составе отделения биотерапии опухолей была создана в НИИ онкологии имени Н. Н. Петрова в 1998 году. Уже через пять лет учёные получили свой первый патент – на иммунотерапию костномозговыми дендритными клетками больных солидными опухолями. Ещё через пять лет, в 2003 году, запатентована аутологичная вакцина на основе костномозговых дендритных клеток в сочетании с фотодинамической терапией для лечения химиорезистентных диссеминированных солидных опухолей. В 2010 году специалисты НИИ получают разрешение применять своё изобретение в клинической деятельности. В 2014‑м создаётся научный отдел онкоиммунологии.
А если иммунитет очнётся?
Новое – это хорошо забытое старое. Уникальные противоопухолевые вакцины учёные из НИИ онкологии имени Н. Н. Петрова создают в конце XX – начале XXI века. Но мало кто помнит, что ещё в XIX веке медицинская наука обратила внимание на интересную закономерность: пациенты, у которых есть опухоль, заболевают инфекцией и… выздоравливают. Опухоль разрушается!
А почему разрушается опухоль? Впоследствии выяснилось: потому что активируется иммунная система. Она как будто приходит в сознание и начинает видеть не только вирусы или бактерии, но и опухолевые клетки, которые до поры до времени успешно уклонялись от иммунного надзора. Новое направление в медицине начало развиваться, но вскоре изобрели лучевую терапию, а затем химиотерапию. Эти методы стали давать результаты, и об иммунной системе на время забыли.
Но прошло много лет, и стало понятно, что химиотерапия и лучевая терапия – ещё не панацея. Необходимы дополнительные методы лечения, которые восстановят противоопухолевый иммунный ответ. К исследованию клеток иммунной системы вернулись вновь.
Когда опухоль сильнее лимфоцита
Кстати, а почему иммунитет оказывается беспомощным перед опухолевой клеткой? Наш организм похож на общество: наиболее активно и эффективно отстаивают свои права те, у кого они не так уж и нарушены.
«Опухолевые клетки секретируют факторы, которые уменьшают активность лимфоцитов, – рассказывает заведующая научным отделом онкоиммунологии, доктор медицинских наук, ведущий научный сотрудник Ирина Александровна Балдуева. – Бывает так, что когда лимфоцит контактирует с опухолевой клеткой, то… не лимфоцит разрушает опухолевую клетку, а опухолевая клетка запускает механизм клеточной смерти лимфоцита. Она оказывается сильнее. Своей изменчивостью, своим желанием защитить себя. В опухолевом очаге 3,5 см генетики насчитывают более ста тысяч мутаций. По некоторым опухолевым клеткам нельзя уже определить, от мужчины они или от женщины…»
Из-за мутаций и быстрого роста опухоли иммунная система перестаёт узнавать опасные клетки, которые когда-то были родными, а теперь стали чужеродными. Есть даже теория, что опухолевым клеткам помогают… нормальные, здоровые клетки, расположенные по соседству. Они начинают синтезировать факторы роста, благодаря которым развивается новообразование.
Надо успеть
У каждого пациента своя вакцина. Та, которая подействует именно на его опухоль. Для этого учёные тщательно изучают опухолевые клетки, взятые у больного. Измельчив биоматериал с помощью специальной автоматической машины, пытаются полностью охарактеризовать опухоль – выявить все особенности её поведения, все иммуносуппрессирующие факторы, которые она продуцирует. Нет, это совсем не опечатка.
Опухолевые клетки в отличие от многих из нас всеми силами цепляются за жизнь. Не сработал один механизм подавления иммунной системы – она вырабатывает другой. Не сработал другой – создаёт третий. На экране клеточного видеокомпьютера видно, как стремительно делятся клетки рака толстой кишки. Специальные ножи лабораторной автоматической машины, раскрошившие опухоль на отдельные клетки, новообразованию, кажется, нипочём.
«Конечно, то, что вы видите сейчас, – это процесс, ускоренный в несколько раз. Но как растёт опухоль здесь, в лаборатории, так она растёт и в организме пациента. И надо успеть начать лечить заболевшего человека», – замечает кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Татьяна Леонидовна Нехаева. И продолжает знакомить с процессом воссоздания клеток иммунной системы, способных вернуть к жизни уже ни на что не реагирующую иммунную систему.
Чтобы успеть, необходимо приготовить вакцинный препарат и ввести больному человеку его первую инъекцию. На создание препарата требуется десять дней – если процесс пройдёт удачно с первой же попытки.
За два первых месяца лечения пациент получит вакцину четырежды. В препарате будут активированные дендритные клетки, которые научат лимфоциты распознавать опухоль. Так стартует иммунный ответ.
Как рождается вакцина
Противоопухолевая вакцина создаётся из собственных клеток иммунной системы больного. Со стороны начало работы очень похоже на обычный анализ крови из вены. В биоматериале учёные по специальным методикам выделят предшественников периферических дендритных клеток – моноциты. А потом начнётся самое сложное. Моноциты необходимо дифференцировать в дендритные клетки. Для этого нужны специальные факторы роста клеток человека (никак не факторы роста для экспериментальных животных), в частности, интерлейкин‑4, гранулоцитарно-макрофагальный колониестимулирующий фактор и особая бессывороточная питательная среда (без ксеногенных факторов лабораторных животных) для получения индивидуальной вакцины человека. В такие условия моноциты помещаются на десять дней. Через неделю их забирают на анализ – проточную цитометрию. Если процесс прошёл правильно, лаборатория обнаружит в материале предшественников – незрелые дендритные клетки. Если же нет, придётся начинать всё сначала. И дай бог успеть вовремя. Так бывает у начинающих учёных без опыта работы, наличия импортных ростовых факторов и специальной дендритноклеточной питательной среды.
Следующий шаг – превратить дендритные клетки из круглых, незрелых, в зрелые, древовидные. Дендритная клетка растёт, когда «ловит» специфические антигены и представляет их на своей поверхности, поясняет Татьяна Нехаева. Если в период роста дендритной клетке добавить антигены бактериальные, то она поможет иммунной системе сформировать антибактериальный иммунитет. Если же клетка получит антигены опухоли, формируется сильный противоопухолевый иммунный ответ.
Созревшая дендритная клетка, уже представляющая частицы опухоли на своей поверхности, становится основным компонентом противоопухолевой вакцины.
Теперь, когда пациента вакцинируют, самое главное – способность полученных дендритных клеток к миграции. После введения вакцины в организм больного клетки направятся в лимфоузлы и там смогут представить опухолевые антигены клеткам иммунной системы, Т‑лимфоцитам. Т‑лимфоциты получат «отпечаток» опасности и, узнав врага в лицо, начнут с ним бороться. А врач будет следить за тем, как развивается противоопухолевый иммунный ответ в организме пациента, и думать, как его усилить, чтобы излечить болезнь.
Надо просто любить эти клеточки…
«Клетки ведут себя точно так же, как само поведение человека. У пациента с повышенной нервозностью состояние клеток будет соответствовать его душевному состоянию. И наоборот. Один из наших пациентов до болезни служил в разведке, длительное время работал за рубежом. Его индивидуальная вакцина оказалась образцовой! Снимки можно было помещать хоть на картинки в учебниках», – рассказывает Ирина Балдуева.
Приготовление вакцинного препарата – процесс не только и не столько химический. Если не любить отдельные живые клетки, если не относиться к ним бережно и заботливо, как к маленьким детям, лекарство не получится. И пациент не выздоровеет.
А причины могут быть самые разные: «молодой» учёный забыл добавить ростовые факторы, ошибся с дозировкой, не проверил состояние вакцинных клеток, проглядел инфекцию, непонятным образом проникшую в стерильный асептический блок…
Доктор медицинских наук Ирина Александровна Балдуева, разрабатывающая противоопухолевые вакцины в НИИ онкологии им. Н. Н. Петрова с 1998 года, замечает: важен не только настрой больного на выздоровление, но и настрой специалиста, который создаёт вакцинный препарат. И пусть это кажется странным, но клетки иммунной системы получаются активными и жизнеспособными только тогда, когда к ним относятся с особой любовью.
Одиночество опасно для жизни
Наши клетки – это мы сами в миниатюре. Сегодня в науке уже известно: когда человек в депрессии, по-другому работает не только мозг, но и все без исключения органы и системы. Возможности нашего организма безграничны – и многое вопреки всем достижениям медицинской науки зависит от того, какой приказ отдаст подсознание.
«Если больной НЕ хочет жить, то медицина бессильна, – говорит кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Алексей Викторович Новик. – У меня была пациентка, которая заболела раком яичника. Её внучке было три года. И женщина поставила себе цель: хочу выдать любимую внучку замуж, увидеть, как начинается её семейная жизнь». Несмотря на страшный диагноз, бабушка прожила ещё 18 лет. И успела поздравить внучку со счастливым браком.
Другой случай из практики врачей НИИ онкологии им. Н. Н. Петрова. На сей раз печальный. Молодую женщину спасти не удалось. А всё началось с того, что во время медового месяца её муж случайно задел наручными часами родинку у неё на спине. На месте содранной родинки началось кровотечение. Несомненно, кровотечение остановили. Но вскоре развилась агрессивная форма меланомы. Далее было всё очень банально – пациентку бросил муж, ставший невольным виновником заболевания. Это подкосило женщину ещё больше. Не помогли ни поддержка родителей, ни усилия врачей. Красивая и очень молодая женщина с онкологическим диагнозом твёрдо решила, что жить ей незачем.
Пациент не должен оставаться один – это одно из главных условий выздоровления. Когда человек небезразличен своим близким, то и лечение идёт намного эффективнее. Другой вопрос, что одиночество и брошенность каждый понимает по-своему. Есть люди, для которых при расставании с супругом или возлюбленным перестают существовать и друзья, и родные, и смысл жизни. А кто-то считает, что у меня есть три кошки и я буду жить ради них. «Выздороветь ради счастливой будущей жизни вас и очень важных для вас близких людей», – напутствует своих пациентов доктор Ирина Александровна Балдуева.
На стенах кабинета Ирины Александровны Балдуевой – прекрасные картины. Многие из них создал её пациент – художник, капитан 2-го ранга в отставке. Несмотря на ампутированную руку, Борис Матвеевич пишет новые пейзажи, руководит Фондом культуры и учит рисованию маленьких детей из неполных семей. Денег за уроки он не берёт.
Метастазы может остановить противоопухолевая терапевтическая вакцина. В НИИ онкологии им. Н. Н. Петрова, на окраине Санкт-Петербурга, в посёлке Песочный, учёные трудятся над созданием профилактической вакцины против рака – такой, которую можно будет ввести каждому пациенту с факторами риска прогрессирования заболевания. Чтобы страшного диагноза «рак» он и его близкие не услышали уже никогда.