чем остановить метастазы в печени
Метастазы в печени
Метастазы – это опухолевые очаги, которые попадают в печень с током лимфы или крови попадают раковые клетки из первичной, основной опухоли, находящейся в другом органе.
В зависимости от количества, метастазы в печени делят на:
По размерам опухолевые узлы бывают мелкими (до 1 см в диаметре), средних размеров (1–3 см) и крупные (более 3 см). От количества и размеров очагов зависит прогноз выживаемости и лечебная тактика.
Откуда в печени берутся метастазы?
Злокачественные опухоли метастазируют в печень примерно так же часто, как в лимфатические узлы. Примерно у трети пациентов с любым онкологическим заболеванием при тщательном обследовании выявляются метастазы в печени. Такие высокие показатели связаны с тем, что через печень постоянно проходит очень много крови – примерно 1,5 литра в минуту, что составляет 30–40% от общего объема. Есть и еще одна интересная особенность: печень получает кровоснабжение сразу из двух разных сосудов – 30–35% из печеночной артерии и 70–75% из воротной вены, которая собирает кровь от части кишечника.
Чаще всего в печень метастазируют следующие злокачественные опухоли:
Другие опухоли тоже могут метастазировать в печень, но реже.
В 2/3 случаев опухолевые клетки в метастазах по своим характеристикам похожи на те, что находятся в первичной опухоли. В 1/3 случаев они отличаются, так как в них происходят новые мутации. Из-за этого бывает сложно установить, откуда произошел рак.
Симптомы метастазов в печени
Симптомы могут длительное время отсутствовать. При единичных метастазах они возникают, когда узлы увеличиваются более 5–7 см, начинают сдавливать желчевыводящие пути и возникает желтуха (желчь начинает в избыточном количестве поступать в кровь). Клиническая картина складывается из нескольких симптомокомплексов, связанных с теми или иными нарушениями:
Синдром нарушения печеночной функции. Из-за поражения опухолью печень не может эффективно обезвреживать токсичные вещества в крови и выводить желчь. Беспокоят боли и неприятные ощущения под правым ребром, тошнота, рвота, отрыжка, привкус горечи во рту, диарея или запоры. Кожа приобретает землистый оттенок.
Астено-вегетативный синдром. Проявляется постоянной слабостью, разбитостью, повышенной утомляемостью. Снижается масса тела, хотя пациент питается, как обычно, у него может быть хороший аппетит. Это состояние характеризуется постепенным снижением работоспособности.
Синдром обструкции (нарушения проходимости) желчевыводящих путей. Возникает из-за того, что растущая опухоль сдавливает желчевыводящие пути. Нарастает желтуха, стул становится обесцвеченным, а моча – темной, появляется кожный зуд. Постоянно беспокоят распирающие боли под правым ребром. Периодически без видимых причин повышается температура тела.
Синдром сдавления нижней полой вены – сосуда, по которому кровь оттекает от печени. На ногах появляются отеки, нарастает асцит – скопление жидкости в брюшной полости.
Если ничего не предпринимать, состояние больного ухудшается. Симптомы нарастают. Сильно снижается аппетит, развивается сильное истощение – кахексия. Расширяются вены пищевода, прямой кишки, видны расширенные вены на животе, которые расходятся в стороны от пупка. Повышение давления в венах грозит кровотечениями – они проявляются в виде рвоты «кофейной гущей», черного дегтеобразного стула. При тяжелом асците в брюшной полости может скапливаться до 25 литров жидкости, из-за этого нарушается работа кишечника и других внутренних органов.
Методы диагностики метастазов в печени
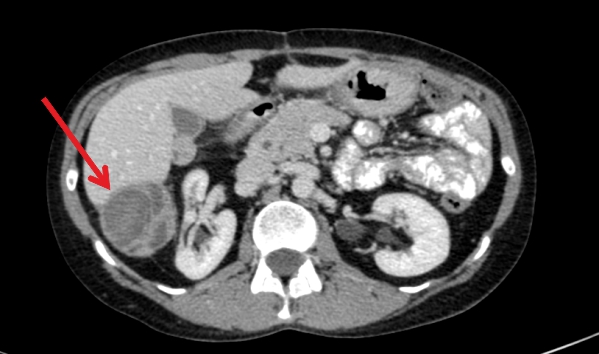
В качестве самого простого, скринингового, метода, прибегают к ультразвуковой диагностике. Но с помощью УЗИ можно обнаружить лишь очаги диаметром более 0,4–0,5 мм. Чувствительность данного метода 40%. Более информативные методы: КТ, МРТ и ПЭТ-сканирование. Они помогают оценить число очагов, их размеры, локализацию, характер роста, выявить распад и нагноение, проверить, насколько сильно затронуты соседние органы. Микрометастазы помогает выявить портография – процедура, во время которой в воротную вену вводят контраст и выполняют компьютерную томографию. Для того чтобы обнаружить опухолевые клетки и оценить их характеристики, проводят биопсию: с помощью тонкой иглы (тонкоигольную) или специального инструмента в виде трубки с острыми краями – трепана (кор-биопсия). Многие больные переживают о том, что из-за биопсии раковые клетки могут распространиться в другие органы, возникнут новые метастазы. Это не более чем миф.
Современные методы лечения
Северцев Алексей Николаевич
д.м.н., профессор, врач хирург-онколог
«Для нас не бывает безнадежных пациентов. Всегда стоит бороться. Даже если диагноз не дает надежды на излечение, облегчить состояние и улучшить качество жизни больного – это то к чему нужно стремится. Развиваются технологии, появляются новые препараты, и с каждым годом наши возможности растут».
Выбор лечебной тактики зависит от некоторых факторов:
Применяют разные виды лечения.
У 5–20% пациентов удается выполнить резекцию – удаление пораженной части печени. Также в России есть врачи, которые выполняют аутотрансплантацию (операция Пильхмайера). При этом метастазы из печени удаляют «на соседнем столе».
У 50% пациентов, помимо хирургического вмешательства, можно выполнить радиочастотную аблацию и химиоэмболизацию.
Химиоэмболизация – процедура, во время которой в сосуд, питающий метастаз, вводят эмболизирующий препарат в сочетании с химиопрепаратом. Эмболизирующий препарат состоит из микрочастиц, которые перекрывают просвет сосуда, и опухолевая ткань перестает получать кислород, питательные вещества. Химиопрепарат уничтожает раковые клетки.
Радиочастотная аблация предполагает уничтожение злокачественных узлов током высокой частоты с помощью иглы-электрода, введенной через кожу.
Оставшимся 50% пациентов приходится довольствоваться лишь паллиативной терапией, но и им можно помочь.
Цены на лечение метастазов в печени
| Консультация онколога-хирурга | 5 000 руб. |
| Компьютерная томография органов брюшной полости (без контраста) | 8 840 руб. |
| Компьютерная томография органов брюшной полости (с контрастом) | 14 000 руб. |
| Чрескожное чреспеченочное дренирование желчных протоков | 62 800 руб. |
Где можно получить лечение?
Ехать за границу не обязательно. Современные методы лечения доступны в России, в Москве. Мы знаем, где искать клинику, в которой есть все необходимые препараты, врача-эксперта, который сможет выполнить сложную операцию, правильно вести пациента. Мы сотрудничаем с лучшими онкоцентрами страны.
Метастазы в печени
По своей сути, метастазы являются провокаторами онкологического процесса и переносятся из первичного очага заболевания в здоровый орган. Метастазы в печени встречаются чаще всего, потому что в печени сосредоточена богатая сосудистая система с интенсивным кровообращением. Именно поэтому риск метастазирования в печень гематогенным путем очень велик.
Метастатические очаги в печени бывают единичные и множественные, а скорость их появления и роста зависит от биологического типа первичной опухоли, то есть от степени ее агрессивности.
После появления метастазов в печени ее функции постепенно нарушаются, при множественных метастазах печень значительно увеличивается в размерах и теряет работоспособность.
Симптомы метастазов в печени
К сожалению, гепатопротекторы в таблетированной форме хуже усваиваются и менее эффективны, поэтому терапия проводится внутривенно.
Тверезовская Ирина Александровна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Лечение метастазов в печени
Если обнаружены отдаленные метастазы в печени, это всегда свидетельствует о распространенном опухолевом процессе, то есть означает четвертую стадию рака.
Какое лечение возможно при раке четвертой стадии с метастазами в печени?
Метастатические очаги в печени имеют схожую с первичной опухолью гистологическую структуру и фенотип, поэтому и лечат метастазы, как правило, по той же схеме, что и основное заболевание.
Химиотерапия при метастазах в печени
Химиотерапия, а также таргетная терапия являются наиболее распространенными методами лечения метастазов в печени. Химиотерапия обычно назначается при множественном поражении печени, когда метастазы невозможно удалить или облучить.
Для лечения метастазов в печени пациенту назначаются цитостатики в комбинации с таргетными препаратами. Какая комбинация препаратов будет максимально эффективной для пациента, определяет онколог-химиотерапевт на консультации, он же рассчитывает оптимальную дозировку и продолжительность терапии.
При прогрессировании рака кишечника часто метастатические очаги образуются именно в печени. При проведении адекватной системной химиотерапии (например, по схемам FolFOx, FolFiri, Xelox) оригинальными препаратами в комбинации с таргетной терапией (Авастин, Вектибикс, Залтрап) часто удается уменьшить количество и размер метастазов в печени при раке кишечника и остановить их дальнейший рост, иногда образования в печени исчезают и не появляются вновь.
После проведения химиотерапии, при резектабельности процесса, метастатические очаги в печени возможно удалить, после чего химиотерапия продолжается для сохранения эффекта.
Лучевая терапия при метастазах в печени
В лечении метастазов в печени используются лучевая терапия SRS (сильное излучение сфокусированного типа), лучевая терапия SIRT (изотопное излучение посредством внедрения в печеночную вену шунтированием капсул SIRT) и радиочастотная гипертермия (воздействие на раковые клетки высокими температурами, порядка 700 0 С).
Процедура «кибер-нож» помогает уничтожить мелкие метастазы (до 1 мм в диаметре) посредством воздействия на них точечными пучками фотонов.
Хирургический метод или резекция печени
Данный метод лечения метастатических очагов в печени заключается в иссечении хирургическим путем части органа, где расположены метастазы.
Обычно резекции применяются при наличии единичных метастазов с капсульным расположением. Прежде чем назначить резекцию, хирург-онколог уточняет стадию заболевания (при множественном метастазировании по всему периметру печени операция невозможна), а также расположение метастазов (при локализации метастатических очагов рядом с кровеносными сосудами резекция не назначается).
Паллиативная помощь
В тяжелых ситуациях, когда противоопухолевое лечение невозможно, мы оказываем паллиативную помощь пациентам с метастазами в печени.
В зависимости от симптомов, которые необходимо купировать, мы назначаем гепатопротективную, дезинтоксикационную терапию. Метастазы в печени могут нарушать синтез белка, в таком случае мы поддерживаем организм введением белковых препаратов.
Лечение вакцинами и экспериментальными препаратами
Лечение метастазов в печени вакцинами и другими экспериментальными препаратами не является эффективным, оно не зарегистрировано ни в одних международных рекомендациях по терапии онкологических заболеваний (NCCN, ESMO).
В развитых странах Европы и США данное лечение даже не рассматривается, так как оно не показало своей результативности и может ухудшить общее состояние пациента.
Сколько живут с метастазами в печени: прогноз и продолжительность жизни
Дать однозначный ответ на вопрос, сколько живут с метастазами в печень, невозможно. Радикальное излечение рака четвертой стадии с отдаленными метастазами невозможно, поэтому любое противоопухолевое лечение будет паллиативным.
Средняя продолжительность жизни с метастазами в печени составляет около 3-х лет. С учетом адекватного и эффективного лечения эта цифра может увеличиться на неопределённое количество лет.
На продолжительность жизни пациента с метастазами в печени влияют несколько факторов: степень злокачественности опухоли, локализация новообразований и их размеры, своевременность обращения к специалистам, правильность схемы лечения, общий статус пациента, а также как опухоль будет отвечать на лечение.
Решение о выборе тактики лечения пациента с метастазами в печень принимается консилиумом докторов нашей клиники индивидуально в каждом случае.
Мы прилагаем все усилия, знания и достижения современной онкологии для того, чтобы помочь каждому пациенту с метастатическим раком любой локализации.
Для записи к онкологу, пожалуйста, позвоните по телефонам клиники: +7 (812) 952-83-73, +7 (812) 318-59-90.
Лечение метастазов в печени
Егиев Валерий Николаевич
Метастазы в печени — это вторичное онкологическое поражение, которое возникает при опухолях в других органах. Чаще всего к ним приводит рак органов брюшной полости, в первую очередь кишечника и желудка, но также нередко их провоцируют злокачественные образования в другой локализации. Дело в том, что печень служит внутренним фильтром. Вместе с кровью и лимфой опухолевые клетки попадают в орган и разрастаются. По статистике метастазы в печени обнаруживаются у каждого третьего больного раком.
Виды метастазов в печени
В зависимости от количества поражений метастазы подразделяют на:
В зависимости от локализации очаги поражения могут быть:
Все эти факторы обязательно учитываются, когда принимается решение об операции.
Чем опасны метастазы в печени?
Метастазы нарушают нормальное функционирование органа. Многие витамины и минералы перестают усваиваться из-за недостатка ферментов, хуже переваривается пища. Печень не справляется с задачей по фильтрации крови. Кроме того, при крупных поражениях могут пережиматься воротная вена и желчные протоки. В результате возникают симптомы механической желтухи, которые являются противопоказанием для большинства методов лечения рака. Такое состояние может вызвать сильное отравление, опасное для головного мозга. Поэтому метастазы в печени необходимо лечить сразу, как только они были диагностированы.
Хирургическое лечение метастазов в печени
Хирургический метод лечения в комбинации с современной химио-, таргетной и иммунотерапии применяется у 50-80% пациентов, особенно при метастазах рака кишки. В комплексе с химиотерапией это позволяет значительно увеличить продолжительность жизни. Ткань печени имеет высокую способностью к восстановлению, поэтому допускается удаление даже 60-70% пораженного органа.
Резекция лапароскопическим методом
Выполняется при небольших единичных метастазах. Через небольшие проколы в брюшной стенке удаляется пораженная ткань печени. Данную операцию я провожу с использованием самого современного эндоскопического оборудования. При такой низкотравматичной методике здоровые ткани практически не повреждаются, а пациенты быстрее восстанавливаются. Однако данная операция проводится редко. Метастазы часто диагностируются, когда уже достигли крупных размеров.
Резекция печени открытым путем
Данная методика используется, когда из-за больших размеров метастазов удалить их через лапароскопический доступ не представляется возможным. Операция проводится через разрез на передней брюшной стенке. Крупные сосуды и желчные протоки перевязываются, затем удаляется пораженная часть тканей печени. Такая резекция требует от хирурга высокой квалификации, чтобы максимально сохранить объем здоровой ткани, а также не повредить желчные пути.
Виды операций по частичной резекции печени
Резекции можно разделить на две группы: анатомические и атипичные. К первым относятся хирургические вмешательства с учетом долевого и сегментарного строения печени. А именно:
Атипичные же резекции проводятся, ориентируясь на расположение кровеносных, венозных сосудов, и желчных протоков.
Я провожу все виды операций и владею современными лапароскопическими методиками. Основываясь на 40-летнем практическом опыте, принимаю решение о целесообразности операции и выбираю наиболее эффективную методику в зависимости от тяжести каждого конкретного клинического случая.
Для меня не существует безнадежных пациентов. Моя многолетняя практика доказывает, что даже в самых сложных случаях необходимо продолжать бороться. Облегчение течения болезни и улучшение качества жизни пациентов — реальные достижимые цели, которые я ставлю в своей работе.
Метастазы в печени: симптомы и прогноз
Злокачественная опухоль существенно отличается от здоровой ткани, которая ее окружает. Ее клетки способны делиться неограниченное количество раз. На определенной стадии они начинают отрываться от новообразования и распространяться по организму, образуя вторичные очаги роста – метастазы (от греческого metastasis – перемещение). Структура дочерней опухоли обычно не отличается первичной. Современной медициной изучено несколько путей миграции патологического материала. Основные из них:
Метастазирование по кровеносной системе возможно практически в любой орган, но наиболее частыми мишенями становятся легкие и печень.
Пути метастазирования в печень
Детоксикационная функция печени – фильтрация венозной крови, поступающей из органов желудочно-кишечного тракта, поджелудочной железы, селезенки, желчного пузыря (система воротной вены). Интенсивность кровообращения (более 1,5 литров в минуту), замедление кровотока в синусоидных капиллярах создают благоприятные условия для оседания и размножения опухолевых клеток. При поражении любого органа системы воротной вены повышается вероятность попадания метастазов в печень.
Поражения могут быть одиночными или множественными, но проявляются не сразу и протекают бессимптомно. Опасны тем, что сам орган обладает высокой регенеративной способностью, а факторы местного иммунитета могут временно блокировать активность вторичных очагов. Через какое время они проявят себя – неизвестно, у каждого организма все индивидуально. Механизм запуска роста дочерних поражений не изучен в достаточной мере, но рост числа клеток говорит о долгосрочности первичного процесса, прогрессировании заболевания.
Опухоли каких органов могут метастазировать в печень?
Симптомы и диагностика
Неспецифичность симптоматики опухолевого поражения может затруднить раннюю диагностику. Что должно насторожить?
Метастазы в печени на УЗИ
Ультразвуковая диагностика не способна дать полную информацию. Для изучения морфологического строения клеток, их типа и зрелости, возможно проведение УЗИ с биопсией. Получение образцов ткани на цитологическое и гистологическое исследование проводится безопасным забором при помощи игл различного диаметра. Биопсия метастазов в печени позволяет установить локализацию первичной опухоли. Это особенно важно в случаях невыявленных первичных поражений. Проведение биопсии безвредно и не оказывает влияния на увеличение скорости метастазирования.
Уточнить величину, локализацию, распространение, характер роста, наличие некротизированной ткани, абсцесса, инфильтрацию в органы – позволяют современные методы рентген-диагностики:
С помощью этих методов, по степени уменьшения очага воспаления, можно также контролировать динамику заболевания.
Прогноз эффективности
Своевременная терапия дает положительный результат в большинстве случаев. Проведение консервативного лечения может быть осложнено чувствительностью органа к лекарству. Введенные противоопухолевые препараты разрушают активно делящиеся клетки, замедляют рост опухоли. Проведение терапии позволяет уменьшить размер новообразования для последующего хирургического вмешательства. Одиночные метастазы рака удаляются хирургически. Правильное питание, образ жизни, распорядок дня – составляющие части комплексной терапии.
Прогноз эффективности лечения во многом зависит от фенотипа, характера поражения, числа метастатических узлов и локализации первичной опухоли. Метастазы опасны риском внутренних кровотечений, сдавлением кровеносных сосудов, токсическим повышением уровня билирубина, нарушением оттока желчи.
Наличие внепеченочных метастазов, множественные запущенные поражения печени, к сожалению, дают неблагоприятный прогноз.
Основные методы лечения
Стратегию лечения согласовывают в зависимости от количества очагов поражения, типа рака, степени нарушения функционирования печени и других поврежденных органов. Активное вмешательство, терапия и прочие методы способствуют продлению жизни и существенному улучшению ее качества. Комплекс процедур может включать:
Во власти опухоли: почему метастазы так сложно остановить?
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Когда в организме случилось несчастье, и из 100 триллионов нормальных клеток хоть одна переродилась в раковую и не была уничтожена, срабатывает спусковой крючок, и запускается рост опухоли. Постепенно она приспосабливает к себе окружающие клетки, а также оказывает значительное влияние на весь организм. С развитием заболевания некоторые раковые клетки покидают опухоль и формируют метастазы — вторичные очаги опухолевого роста. Зачастую своевременное удаление первичной опухоли и послеоперационная терапия не способны вызвать ремиссию. Оказывается, что первичная опухоль способна «обучать» микроокружение в очагах развития будущих метастазов уже на ранних этапах своего роста. Кроме того, метастазные раковые клетки перепрограммируют экспрессию своих генов так, чтобы лучше прижиться в новом месте обитания. Знание того, как предотвратить эти процессы, а не только рост первичной опухоли, поможет спасти до 90% людей, умирающих от основных видов рака.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Революция в понимании природы метастазирования
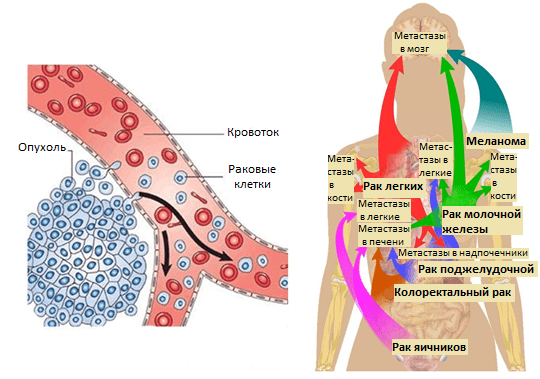
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
Процесс рассеивания раковых клеток по организму, названный метастазированием (от древнегреч. «менять, переносить»: meta — «через» + histanai — «устанавливать»), впервые описал еще в 1889 году Стивен Педжет [4], но механизм его развития оставался загадкой для ученого сообщества долгое время (рис. 2).
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Педжет провел аналогию такого распространения раковых клеток с прорастанием семян. Они тоже выживают и делятся на плодотворной «почве» — в подходящем микроокружении. В те времена невозможно было найти этому экспериментального подтверждения, и долго преобладала совсем иная теория — Джеймса Юинга (рис. 2). Он утверждал, что основную роль в распределении метастазов по организму играет динамика кровотока и устройство сосудистой системы.
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
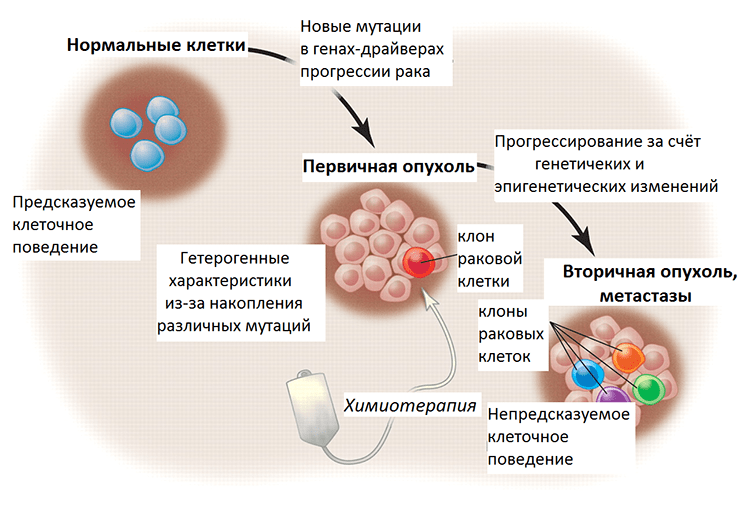
Генетическая и эпигенетическая гетерогенность при метастазировании
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
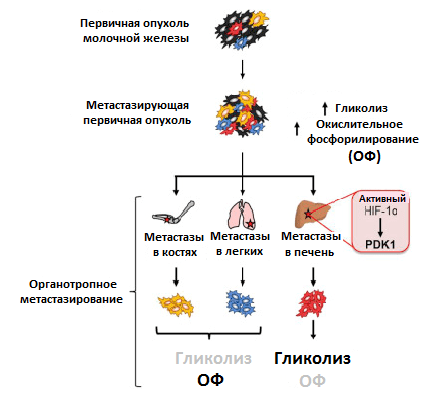
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
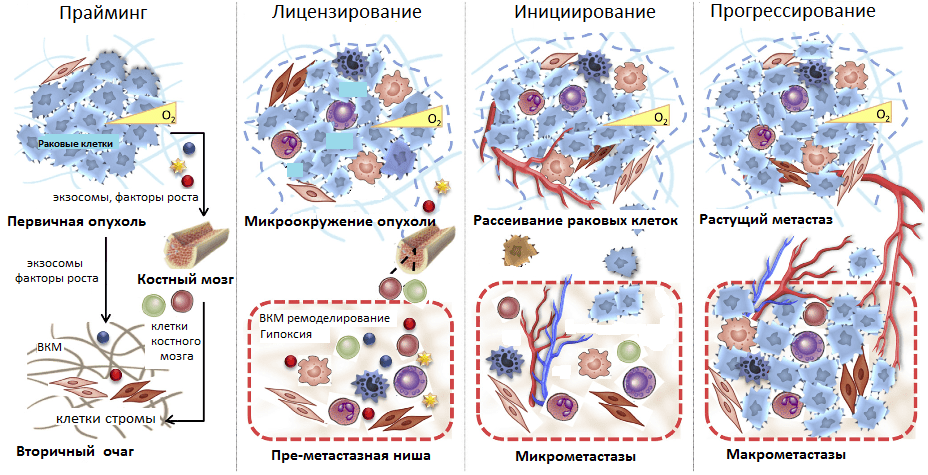
И все же метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей — освоением совершенно незнакомого места обитания. Эксперименты группы Дэвида Лидена в 2005 году впервые показали, что первичная опухоль за счет продуцируемых факторов стимулирует формирование так называемых преметастазных ниш в различных органах. Ученые показали, что раковые клетки первичной опухоли за счет стимулирования рецептора фактора роста сосудов (VEGFR-1) на миелоидных клетках-предшественниках активируют их распространение из костного мозга в известные очаги развития метастазов [13]. Кроме того, в этих очагах запускается избыточная экспрессия фибробластами одного из компонентов внеклеточного матрикса (ВКМ) — фибронектина. Миелоидные клетки-предшественники, имея рецепторы клеточной адгезии (интегрины) к этому белку, активно «ловятся на удочку» и заселяют преметастазные ниши. Они секретируют воспалительные цитокины, факторы роста и проангиогенные факторы, стимулирующие формирование сосудов. Это способствует ремоделированию стромы и колонизации ее метастазами (рис. 5) [13].
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
Хотя для большинства органов характерна эта общая схема, существуют некоторые особенности в зависимости от места (органа) формирования ниши. Например, преметастазная ниша в печени и легких также формируется за счет привлечения нейтрофилов. Известно, что они могут помогать метастазирующим клеткам при интеграции в новую нишу за счет секретирования протеаз, цитокинов и непосредственного контакта с раковыми клетками при выходе из капилляров. Другой пример — клетки рака поджелудочной железы. Они выделяют экзосомы — липидные везикулы, которые переносят макрофаг-ингибирующий фактор (MIF). Их поглощают клетки Купфера в печени, и это запускает цепочку обучения ниши. Клетки Купфера синтезируют трансформирующий фактор роста β (TGF-β), клетки Ито активируются им и запускают перестраивание ВКМ, затем привлекая к нему макрофагов [15]. Их роль в микроокружении опухоли подробнее рассмотрена в статье «Одураченные макрофаги, или несколько слов о том, как злокачественные опухоли обманывают иммунитет» [16].
Метастазы в костях — одни из самых коварных, и их преметастазная ниша по-своему особенна. Например, оказалось, что при раке молочной железы только раковые клетки без рецепторов к эстрогену метастазируют в кости. Такие клетки первичной опухоли активно выделяют фермент лизилоксидазу. В костях он вызывает образование взрослых остеокластов и за счет этого стимулирует резорбцию кости. [17]. Именно эти «емкости» внутри кости метастазы занимают позднее. Другая и, пожалуй, основная функция лизилоксидазы — формирование поперечных связей между коллагеновыми волокнами ВКМ — также связана с образованием преметастазных ниш, но в легких. Преобразование коллагеновых волокон привлекает миелоидные клетки, а те позднее разрушают коллагеновые сети и дают путь раковым клеткам при заселении ткани легкого [18].
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
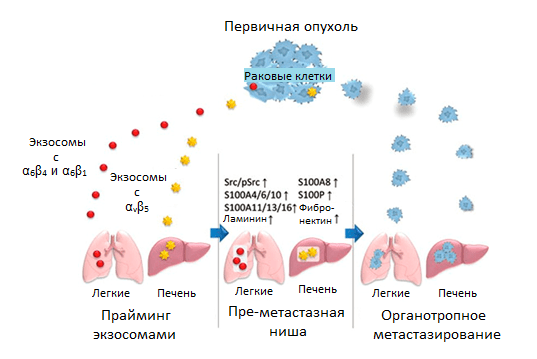
Ключевой механизм, известный на данный момент, основан на обучении будущих очагов рассеивания метастазов с помощью специфичных к ним экзосом. Эти везикулы, ранее описанные в статье «Экзосома — механизм координации и взаимопомощи клеток организма» [20], представляют собой структуры с рецепторами на своей поверхности и генетическим и секретируемым материалом внутри. Ученые провели интересный эксперимент — выделили экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и пр.) и, внедрив их в кровоток мышей с отличным типом опухоли, показали, что с их помощью возможно перепрограммировать распределение метастазов по органам. Это обусловлено тем, что экзосомы разных типов рака преимущественно содержат на своей поверхности основные рецепторы адгезии, интегрины, специфичные к определенному белку ВКМ (к ламинину — α6β4 и α6β1; к фибронектину — αvβ5 и т.д.).
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
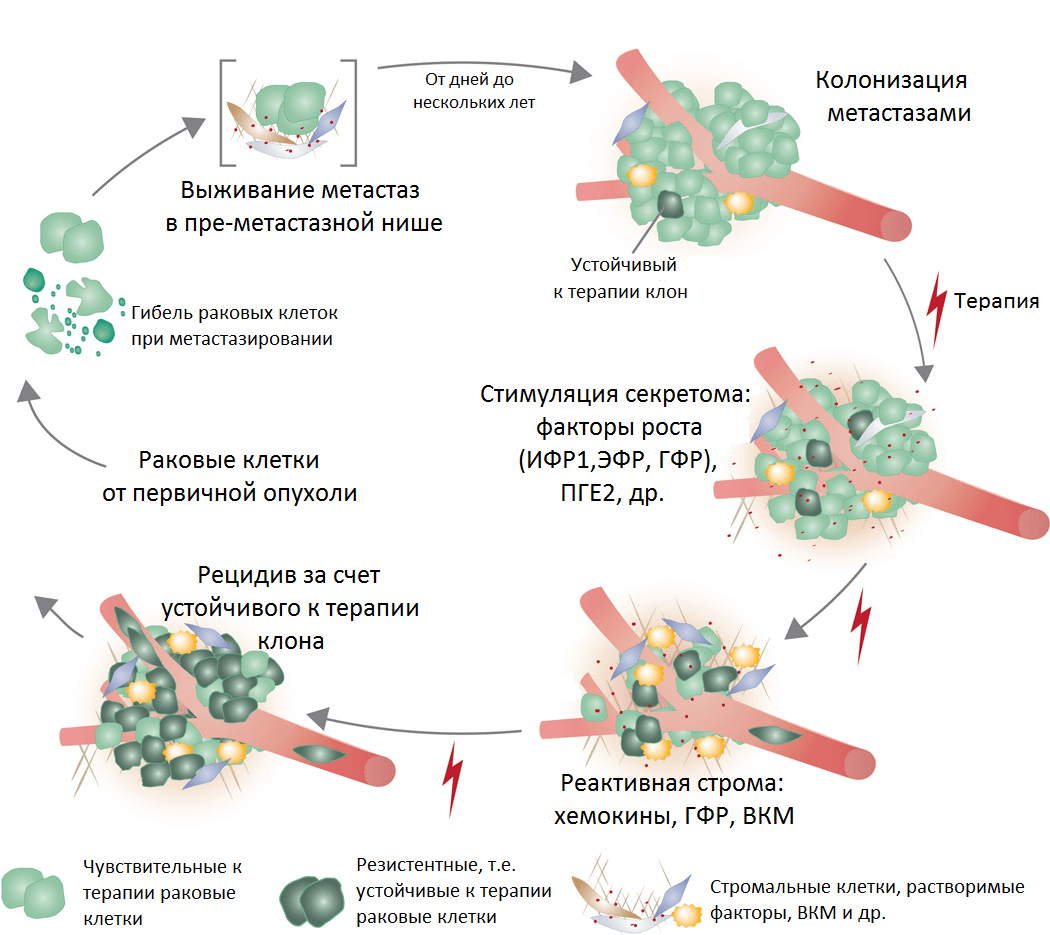
Мы также знаем, что после химиотерапии зачастую выживают субклоны раковых клеток с полезными в новой среде мутациями. Под стрессом воздействия цитостатиков субклоны раковых клеток активируют секрецию факторов роста и запускают клеточную сигнализацию, препятствующую гибели (рис. 7). Кроме того, их выживанию помогает поддержка клеток стромы, заодно изменяющих свое поведение на «оборонительное» под эффектом терапии.
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.