чем определяется то или иное агрегатное состояние
Агрегатные состояния вещества
Конспект по физике для 8 класса «Агрегатные состояния вещества». ВЫ УЗНАЕТЕ: Чем отличается характер движения и взаимодействия молекул вещества в различных агрегатных состояниях. Как происходит переход вещества из одного агрегатного состояния в другое.
Агрегатные состояния вещества
Все вещества в зависимости от условий могут находиться в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Различные агрегатные состояния существуют у каждого вещества. Наглядным примером этому служат лёд, вода и водяной пар.
ЧЕМ ОПРЕДЕЛЯЕТСЯ АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Вы уже знаете, что молекулы одного и того же вещества в твёрдом, жидком и газообразном состоянии ничем не отличаются друг от друга. То или иное агрегатное состояние определяется взаимным расположением составляющих вещество молекул, а также характером их движения и взаимодействия.
В газах при атмосферном давлении расстояния между молекулами намного больше размера самих молекул. Именно поэтому притяжение между молекулами газа мало. При обычных температурах средняя кинетическая энергия молекул газа вполне достаточна для совершения работы по преодолению сил их взаимного притяжения, поэтому молекулы газа разлетаются, если газ не сдерживают стенки сосуда.
Плотности жидкостей и твёрдых тел во много раз больше плотности газа, а их молекулы расположены гораздо ближе друг к другу. В этом случае сила взаимного притяжения молекул намного больше и средней кинетической энергии молекул уже недостаточно для того, чтобы совершить работу по преодолению сил межмолекулярного притяжения. Это является причиной того, что молекулы в жидкостях и особенно в твёрдых телах не могут значительно удаляться друг от друга.
ПЕРЕХОД ВЕЩЕСТВА ИЗ ОДНОГО АГРЕГАТНОГО СОСТОЯНИЯ
Вещества могут переходить из одного агрегатного состояния в другое. Изменение агрегатного состояния вещества всегда связано с выделением или поглощением некоторого количества теплоты.
Переход вещества из одного агрегатного состояния в другое используется для решения огромного числа практических задач. Например, в крупных городах используют снегоплавильные машины, для того чтобы грязный снег с улицы отправлять в канализацию и не загрязнять окружающую среду. На тепловых и атомных электростанциях в паровых турбинах применяют водяной пар. Сжиженный газ (фреон) используют в холодильных установках.
Всего различают шесть процессов, при которых происходит переход вещества из одного агрегатного состояния в другое.
ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ
Переход вещества из твёрдого состояния в жидкое называется плавлением. В твёрдых телах, в отличие от жидкостей, частицы расположены упорядоченно. Поэтому, для того чтобы перевести частицы из упорядоченного состояния в неупорядоченное, нужно совершить работу по преодолению сил молекулярного притяжения. Внутренняя энергия вещества при этом увеличивается за счёт увеличения энергии взаимодействия молекул. Примерами плавления могут служить таяние льда, плавление металлов в металлургии и пр.
Обратный процесс, связанный с переходом вещества из жидкого состояния в твёрдое, называется кристаллизацией или отвердеванием. Пример кристаллизации — замерзание воды. Процесс кристаллизации сопровождается уменьшением внутренней энергии вещества за счёт уменьшения энергии взаимодействия молекул.
ПАРООБРАЗОВАНИЕ И КОНДЕНСАЦИЯ
Переход вещества из жидкого состояния в газообразное называется парообразованием. Пример парообразования — испарение воды.
Обратный процесс, связанный с переходом вещества из газообразного состояния в жидкое, называется конденсацией (от лат. condense — уплотнение, сгущение). Пример конденсации — образование росы.
СУБЛИМАЦИЯ (ВОЗГОНКА) И ДЕСУБЛИМАЦИЯ
Переход вещества из твёрдого состояния в газообразное (минуя жидкое) называется сублимацией (от лат. sublimo — возношу) или возгонкой. Возгонкой объясняются также запахи, которыми обладают многие твёрдые тела. Вылетая из твёрдого тела, молекулы образуют над ним газ (или пар), который и вызывает запах. Например, разные сорта древесины имеют различный запах.
Переход вещества из газообразного состояния в твёрдое (минуя жидкое) называется десублимацией. Пример десублимации — образование на окнах зимой инея, узоров из кристалликов льда. Данный процесс десублимации может осуществляться только на внутренней поверхности оконного стекла, где молекулы паров воды превращаются в кристаллики льда.
Вы смотрели Конспект по физике для 8 класса «Агрегатные состояния вещества».
Основные агрегатные состояния вещества
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
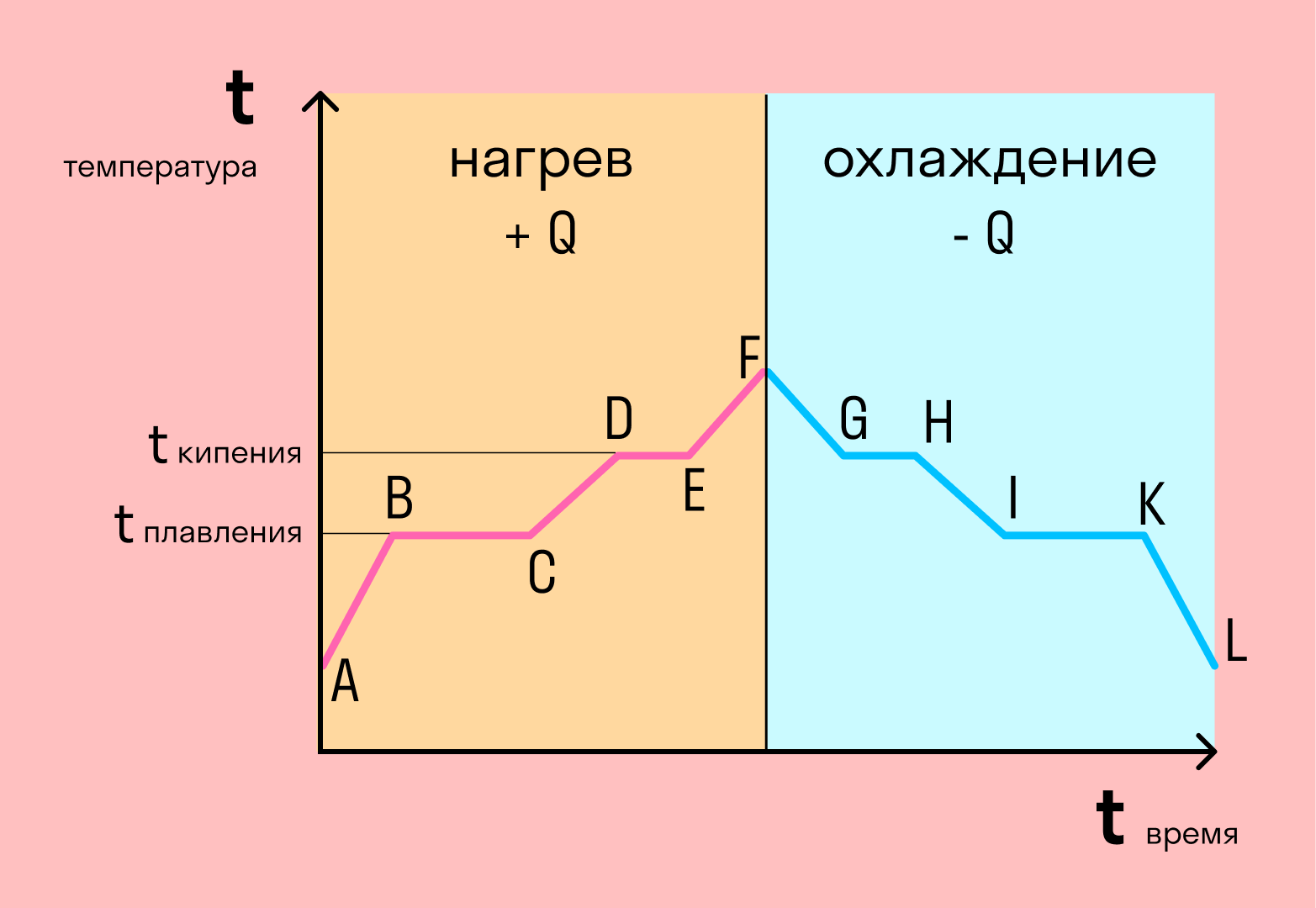
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Агрегатные состояния вещества
Вещество может пребывать в твердом, жидком или газообразном состояниях, а при особых условиях также в плазменном состоянии.
Любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой. В обычной жизни мы наблюдаем три агрегатных состояния вещества — твердое, жидкое и газообразное.
Газ расширяется, пока не заполнит весь отведенный ему объем. Если рассмотреть газ на молекулярном уровне, мы увидим беспорядочно мечущиеся и сталкивающиеся между собой и со стенками сосуда молекулы, которые, однако, практически не вступают во взаимодействие друг с другом. Если увеличить или уменьшить объем сосуда, молекулы равномерно перераспределятся в новом объеме. Молекулярно-кинетическая теория связывает молекулярные свойства газа с его макроскопическими свойствами, такими как температура и давление.
В отличие от газа жидкость при заданной температуре занимает фиксированный объем, однако и она принимает форму заполняемого сосуда — но только ниже уровня ее поверхности. На молекулярном уровне жидкость проще всего представить в виде молекул-шариков, которые хотя и находятся в тесном контакте друг с другом, однако имеют свободу перекатываться друг относительно друга, подобно круглым бусинам в банке. Налейте жидкость в сосуд — и молекулы быстро растекутся и заполнят нижнюю часть объема сосуда, в результате жидкость примет его форму, но не распространится в полном объеме сосуда.
Твердое тело имеет собственную форму, не растекается по объему контейнера и не принимает его форму. На микроскопическом уровне атомы прикрепляются друг к другу химическими связями, и их положение друг относительно друга фиксировано. При этом они могут образовывать как жесткие упорядоченные структуры — кристаллические решетки, — так и беспорядочное нагромождение — аморфные тела (именно такова структура полимеров, которые похожи на перепутанные и слипшиеся макароны в миске).
Выше были описаны три классических агрегатных состояния вещества. Имеется, однако, и четвертое состояние, которые физики склонны относить к числу агрегатных. Это плазменное состояние. Плазма характеризуется частичным или полным срывом электронов с их атомных орбит, при этом сами свободные электроны остаются внутри вещества. Таким образом, плазма, будучи ионизированной, в целом остается электрически нейтральной, поскольку число положительных и отрицательных зарядов в ней остается равным. Мы можем наблюдать как холодную и в незначительной степени ионизированную плазму (например, в люминесцентных лампах), так и полностью ионизированную горячую плазму (внутри Солнца, например).
При сверхнизких температурах скорости молекул снижаются настолько, что мы не можем точно определить их местоположение. Это происходит в силу принципа неопределенности Гейзенберга. Когда температура снижается настолько, что степень неопределенности положения атомов оказывается сопоставимой с размерами группы атомов, к которой они принадлежат, вся группа начинает вести себя, как единое целое. Такое состояние вещества называется конденсатом Бозе—Эйнштейна, и его можно считать пятым агрегатным состоянием вещества.
Статья в стиле рассказа детям на уроке природоведения.
Характеризовать агрегатное состояние по тому как вещество, находящееся в нем, заполняет предоставленный ему объем можно в рассказе второклассникам.
В жидкости друг относительно друга движутся не молекулы, а их небольшие группы.
Не показана разница между аморфными и твердыми телами.
Не выполнена главная задача любой энциклопедии: точного краткого описания с множеством ссылок на другие статьи, разъясняющих смысл всех специальных слов и понятий, встречающихся в описании, в конце концов приводящих к элементарным законам.
Состояния же материи, различимые только измерительными
ПРИБОРАМИ (тоже условный термин), возможно,
неисчислимы (и для «вещества»).
Начните измерения и окажется, что всё давно измерено и всё давно просчитано!
Прошлое движение, говорите? Возьмите настояшее движение и через мгновение оно станет прошлым! И что изменилось? где новая масса? Блин, все просчитывается известными кинематическими формулами, а вы при этом тут со своей теорией лишний. [/quote]
Если Вы не принимаете моё объяснение, то сами объясните, как рождается первичное движение? Как первичное неуловимое движение закольцовывается и в таком состоянии повторяется много раз, как и обращение Земли с повторениями лета и зимы, что мы воспринимаем массой-симбиозом движения и части пространства? Прошлое движение проявляется, материализуется через труд-инерцию, перелетающую на препятствие и изменяющее его форму и направленность движения. Настоящее движение (например, автомобиля, который своим движением перевозит груз с одного места на другое) работой переносится на объект, когда инерцией движение от одного носителя (хозяина) переходит к другому носителю (хозяину). Движения работают в момент настоящего времени, но настоящее время сменяется очередным настоящим временем, а предыдущее настоящее становится прошлым временем и его движением. Если время остановить невозможно, то движения останавливаются там, где затихает их инерция в результате торможения-передачи движения от одного тела другим телам среды.
2.5.2015г. Пивень Григорий.
1. В каких агрегатных состояниях может находиться одно и то же вещество?
Вещество может находиться в твердом, жидком и газообразном состоянии.
2. Какое практическое значение имеют явления перехода вещества из одного агрегатного состояния в другое?
В металлургии: плавят металлы, чтобы получить из них сплавы: чугун, сталь, бронзу, латунь и др. Пар, полученный из воды при ее нагревании, используют на электростанциях в паровых турбинах.
Сжиженными газами пользуются в холодильных установках.
3. Чем определяется то или иное агрегатное состояние вещества?
Агрегатное состояние вещества определяется расположением, характером движения и взаимодействия молекул.
4. Каковы особенности молекулярного строения газов, жидкостей и твёрдых тел?
В газах при атмосферном давлении расстояние между молекулами много больше размера самых молекул. В связи с этим притяжение молекул газа мало. Средняя кинетическая энергия молекул газа вполне достоточна, чтобы совершить работу по преодолению сил молекулярного притяжения. Поэтому, если газу не мешают стенки сосуда, его молекулы разлетаются.
В жидкостях и твердых телах, плотность которых во много раз больше плотности газа, молекулы расположены ближе друг к другу. Средняя кинетическая энергия их уже недостаточна для того, чтобы совершить работу по преодолению сил молекулярного притяжения.
Поэтому молекулы в жидкостях и особенно в твердых телах не могут далеко удаляться друг от друга.
Агрегатное состояние
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация; из жидкого в твёрдое — кристаллизация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Содержание
Твёрдое тело
Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Жидкость
Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако не способно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Плазма
Часто причисляемая к агрегатным состояниям вещества плазма отличается от газа большой степенью ионизации атомов. Большая часть барионного вещества (по массе ок. 99,9 %) во Вселенной находится в состоянии плазмы. [2]
Сверхкритический флюид
Возникает при одновременном повышении температуры и давления до критической точки, в которой плотность газа сравнивается с плотностью жидкости; при этом исчезает граница между жидкой и газообразной фазами. Сверхкритический флюид отличается исключительно высокой растворяющей способностью.
Конденсат Бозе — Эйнштейна
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В результате этого часть атомов оказывается в состоянии со строго нулевой энергией (то есть в низшем из возможных квантовом состоянии). Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и резонанс Фишбаха.
Фермионный конденсат
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов. (В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше. [3]
Вырожденная материя
Другие состояния
При глубоком охлаждении некоторые (далеко не все) вещества переходят в сверхпроводящее или сверхтекучее состояние. Эти состояния, безусловно, являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности.
Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.
Примечания
См. также
Полезное
Смотреть что такое «Агрегатное состояние» в других словарях:
агрегатное состояние — — [Л.Г.Суменко. Англо русский словарь по информационным технологиям. М.: ГП ЦНИИС, 2003.] Тематики информационные технологии в целом EN state of aggregation … Справочник технического переводчика
агрегатное состояние — agregatinė būsena statusas T sritis Standartizacija ir metrologija apibrėžtis Kietoji, skystoji, dujinė ar plazminė medžiagos būsena. atitikmenys: angl. aggregation state vok. Aggregatzustand, m rus. агрегатное состояние, n pranc. état… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
агрегатное состояние — agregatinė būsena statusas T sritis chemija apibrėžtis Medžiagos kietoji, skystoji, dujinė ar plazminė būsena. atitikmenys: angl. aggregative state; state of aggregation rus. агрегатное состояние … Chemijos terminų aiškinamasis žodynas
агрегатное состояние — agregatinė būsena statusas T sritis fizika atitikmenys: angl. aggregation state vok. Aggregatzustand, m rus. агрегатное состояние, n pranc. état d’agrégation, m … Fizikos terminų žodynas
агрегатное состояние — agregatinė būsena statusas T sritis Energetika apibrėžtis Tos pačios medžiagos kietoji, skystoji, dujinė ar plazminė būsena, kurią lemia atomų (molekulių) išsidėstymas, sąveika ir šiluminis judėjimas. atitikmenys: angl. aggregation state vok.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Агрегатное состояние вещества — ► aggregative state Физическое состояние вещества: твердое (кристаллическое), жидкое или газообразное, в котором может находиться всякое вещество в зависимости от температуры и давления, которые определяют в данном веществе расстояние между… … Нефтегазовая микроэнциклопедия
Газы (агрегатное состояние вещества) — Газы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им… … Большая советская энциклопедия
Плазма (агрегатное состояние) — Плазменная лампа, иллюстрирующая некоторые из наиболее сложных плазменных явлений, включая филаментацию. Свечение плазмы обусловлено переходом электронов из высокоэнергетического состояния в состояние с низкой энергией после рекомбинации с ионами … Википедия