чем обусловлены ненаправленность и ненасыщаемость ионной связи
Билет 3. Ионная связь. Ненаправленность и ненасыщенность ионной связи
Ионная связь. Ненаправленность и ненасыщенность ионной связи. Степень окисления атомов в молекуле. Поляризуемость ионов и их взаимное поляризующее действие. Влияние степени поляризации ионов на свойства веществ.
Равновесный закон действующих масс: отношения произведения молярных концентраций продуктов к произведению молярных концентраций реагентов взятых в степенях равных стехиометрическим коэффициентам есть величина постоянная при данной температуре =Kр.
Факторы, влияющие на смещение равновесия:
Концентрация: увеличение концентрации исходных веществ ускоряет прямую реакции и смещает равновесии вправо (в сторону продуктов реакции), увеличение концентрации продуктов реакции увеличивает объем образовавшейся реакции и смещает равновесие влево.
Давление: если давление повышается, то равновесие смещается в сторону уменьшения объема реагирующей смеси, и если давление понижается то равновесие смещается в сторону увеличения объема реагирующей смеси.
Температура: при повышении температуры возрастает скорость как прямой так и обратной реакций, но в большей степени ускоряются эндотермические реакции, характеризующиеся большей величиной энергии активации.
Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказать какое либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, которое уменьшит указанное воздействие.
Катализ – явление изменения скорости реакции под действием катализаторов. В присутствии катализатора меняется путь, по которому проходит суммарная реакция, образуются другие переходные состояния, с иными энергиями активации, а поэтому изменяется и скорость химической реакции. Катализатор увеличивет скорость как прямой так и обратной химической реакции, поэтому на смещние химического равновесия он не влияет.
1. Развитие представлений о строении атома. Составные части атома – ядро, (протоны, нейтроны), элеткроны их заряд и масса. Понятие о масс-спектрометрии.
Атом –наименьшая частица хим эл-та, являющаяся носителем его хим св-в.
Модель строения атома по Дж. Томсону. “Сливовый пуддинг».
Чем обусловлены ненаправленность и ненасыщаемость ионной связи
Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее. Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершенным и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химической связи: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода (рис. 3):
`»H» + «H» = «H»_2`; `Delta»H»=-436` кДж/моль
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется `sigma`-связью.
1) в виде точек, обозначающих электроны и поставленных у химического знака элемента:
$$ \mathrm
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
3) часто, особенно в органической химии, ковалентную связь изображают черточкой, которая символизирует пару электронов: `»H»-«H»`.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов или электронной пары:
неподелённые пары остаются при своих атомах, а та что их связывает уже становится поделённой между двумя атомными центрами.
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x` (рис. 4).
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `»N»_2`. В ней атомы имеют три общие пары электронов:
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`. Если перекрывание по оси `x` ведёт к образованию `σ`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны от линии, связывающей центры соединяющихся атомов. Такая ковалентная связь, возникающая при перекрывании орбиталей по обе стороны от линии, связывающей центры соединяющихся атомов, называется `pi`-связью.
В общем случае ковалентной называется химическая связь, осуществляемая электронными парами.
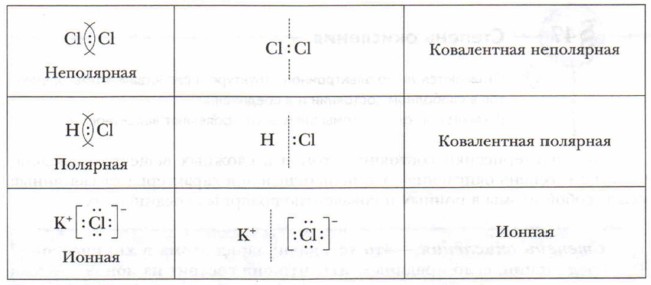
Различают неполярную и полярную ковалентную связь. Все рассмотренные выше молекулы образованы атомами одного и того же элемента, при этом двухэлектронное облако связи распределяется в пространстве симметрично относительно ядер обоих атомов, и электронная пара в одинаковой мере принадлежит обоим атомам. Такая связь называется неполярной ковалентной связью.
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора (рис. 6).
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону. Однако образование ковалентной связи может происходить и по донорно-акцепторному механизму. В этом случае химическая связь возникает за счёт двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподеленную пару, называется донором, а атом, принимающий её (т. е. предоставляющий свободную орбиталь) – акцептором.
Механизм образования ковалентной связи за счёт двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным; образованная таким путём ковалентная связь называется донорно-акцепторной или координационной связью.
Химическая связь между ионами, возникающая в результате их электростатического притяжения, называется ионной связью.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот. Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки. Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода `(«IV»)` («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Такой тип химической связи, которая осуществляется электронами, принадлежащими всем атомам одновременно, называется металлической связью. Металлическая связь характерна для металлов в твёрдом и жидком состоянии.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит обобществление валентных электронов. Однако при ковалентной связи эти электроны находятся вблизи соединенных атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической – пластичны, т. е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придает кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Иногда в соединениях мы встречаемся с особой формой химической связи – так называемой водородной связью. Она менее прочна, чем уже рассмотренные виды, и может считаться дополнительной связью к уже существующим ковалентным.
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность обусловливает строение и свойства воды и льда.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды (рис. 7).
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
Ионная связь
Ионная связь проявляется тогда, когда электроотрицательность элементов резко отличаются между собой (по шкале Полинга Δχ > 1,7), а это происходит при взаимодействии ионов, образованных из атомов элементов, характеризующихся существенно отличными химическими свойствами.
Ионная связь — это электростатическое притяжение между разноименно заряженными ионами, которые образованы в результате полного смещения общей электронной пары от атома одного элемента к атому другого элемента.
В зависимости от индивидуальных свойств у атомов одних элементов преобладает тенденция к потере электронов с преобразованием в положительно заряженные ионы (катионы ), а атомы других элементов, наоборот, стремятся приобрести электроны, превращаясь при этом в отрицательно заряженные ионы (анионы ), как это происходит с атомами обычного металла натрия и типичного неметалла хлора.
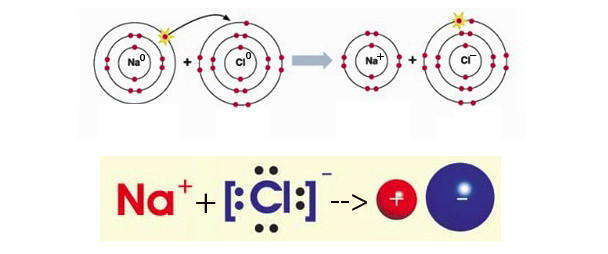
Способность элементов образовывать простые ионы (то есть исходящие от одного атома) обусловлена электронной конфигурацией их изолированных атомов, а также величинами электроотрицательности, энергий ионизации и сродства к электрону (минимальная энергия, необходимая для удаления электрона из соответствующего отрицательного иона на бесконечное расстояние). Понятно, что катионы легче образуются атомами элементов с малыми энергиями ионизации — щелочных и щелочно-земельных металлов (Na, К, Cs, Rb, Ca, Ba, Sr и т.д.). Образование же простых катионов других элементов менее вероятно, поскольку это связано с расходом большой энергии на ионизацию атома.
Простые анионы легче образуются р-элементами седьмой группы (Cl, Br, I) вследствие их высокого сродства к электрону. Присоединение по одному электрону к атомам О, S, N сопровождается выделением энергии. А присоединение других электронов с образованием многозарядных простых анионов энергетически невыгодно.
Поэтому соединения, состоящие из простых ионов, немногочисленны. Они легче образуются при взаимодействии щелочных и щелочно-земельных металлов с галогенами.
Характеристики ионной связи
1. Ненаправленность. Электрические заряды ионов обусловливают их притяжение и отталкивание и в целом определяют стехиометрический состав соединения. Ионы можно представить как заряженные шарики, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому, например, в соединении NaCl ионы натрия Na+ могут взаимодействовать с ионами хлора Cl- в любом направлении, привлекая определенное их число.
Ненаправленность — это свойство ионной связи, обусловленной способностью каждого иона притягивать к себе ионы противоположного знака в любом направлении.
Итак, ненаправленность объясняется тем, что электрическое поле иона имеет сферическую симметрию и уменьшается с расстоянием по всем направлениям, поэтому взаимодействие между ионами осуществляется независимо от направления.
2. Ненасыщенность. Понятно, что взаимодействие двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому ион с определенным зарядом сохраняет способность притягивать другие ионы противоположного знака по всем направлениям. Количество таких «привлеченных» ионов ограничивается только их геометрическими размерами и силами взаимного отталкивания.
Ненасыщенность — это свойство ионной связи, которое проявляется в способности иона, который имеет определенный заряд, присоединять любое количество ионов противоположного знака.
3. Поляризация ионов. При ионной связи каждый ион, будучи носителем электрического заряда, является источником силового электрического поля, поэтому при близком расстоянии между ионами они взаимно влияют друг на друга.
Поляризация иона — это деформация его электронной оболочки под воздействием электрического силового поля другого иона.
4. Поляризуемость и поляризующая способность ионов. При поляризации самому сильному смещению подвергаются электроны внешнего слоя. Но при действии одного и того же электрического поля различные ионы деформируются в неодинаковой степени. Чем слабее связаны внешние электроны с ядром, тем легче происходит поляризация.
Поляризуемость — это относительное смещение ядра и электронной оболочки в йоне при воздействии силового электрического поля другого иона. Поляризующая способность ионов — это их свойство оказывать деформирующее действие на другие ионы.
Поляризующая способность зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее его поле, то есть наибольшую поляризующей способностью обладают многозарядные ионы.
Свойства ионных соединений
При обычных условиях ионные соединения существуют в виде твердых кристаллических веществ, которые имеют высокие температуры плавления и кипения, поэтому считаются нелетучими. Например, температуры плавления и кипения NaCl составляют соответственно 801 0 С и 1413 0 С, CaF2 — 1418 0 С и 2533 0 C. В твердом состоянии ионные соединения не проводят электрический ток. Они хорошо растворяются в воде и слабо или совсем не растворяются в неполярных растворителях (керосин, бензин). В полярных растворителях ионные соединения диссоциируют (распадаются) на ионы. Это объясняется тем, что ионы имеют более высокие энергии сольватации, которые способны компенсировать энергию диссоциации на ионы в газовой фазе.
Ионная связь. Ненаправленность и ненасыщенность ионной связи. Электростатическое взаимодействие ионов. Поляризуемость и поляризующая способность ионов.
Ионная связь – это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев.
Ненасыщаемость ионной связи следует из того, что каждый заряд может притягивать любое число противоположных зарядов (очевидно, что с увеличением расстояния между зарядами сила притяжения между ними ослабевает).
Это связь очень сильная и ее очень трудно разорвать физическим путем (плавлением например ) именно поэтому ионные соединения имеют высокую температуру плавления. Ионные соединения растворяются в полярных растворителях таких как вода например, а растворяются они потому что полярные молекулы воды «захватывают» и удерживают катионы и анионы.
Природа электростатических взаимодействий определяется кулоновским притяжением противоположно заряженных групп или атомов и отталкиванием одноименно заряженных. Энергия электростатического взаимодействия заряженных частиц определяется законом Кулона, где Z1,Z2 — заряды взаимодействующих частиц; е — заряд электрона, равный 1,6*10-19 Кл; ε — диэлектрическая проницаемость среды; l — расстояние между частицами.
Энергия взаимодействия заряженных частиц может быть весьма значительна. Так, в вакууме энергия взаимодействия частиц, находящихся на расстоянии 0,1 нм, составляет 1380 кДж/моль; на расстоянии 0,3 нм — 460 кДж/моль. Однако в водном растворе, особенно в растворах электролитов, кулоновское взаимодействие существенно ослабляется. Молекулы воды имеют большой дипольный момент и поэтому способны, взаимодействуя с заряженными частицами, частично компенсировать их взаимное влияние. Диэлектрическая проницаемость воды равна ε = 80, и согласно закону Кулона сила взаимодействия заряженных частиц в воде будет в 80 раз меньше, чем в вакууме.
Из изложенного следуют два важных для практики вывода:
в органических растворителях или в микрофазе, близкой по характеристикам к гидрофобному аполярному органическому растворителю, сила электростатического взаимодействия заряженных групп возрастает по сравнению с водой (диэлектрическая проницаемость органического растворителя существенно меньше диэлектрической проницаемости воды);
введение в систему дополнительных заряженных ионов должно приводить к ослаблению электростатического взаимодействия в силу экранирования зарядов введенными ионами.
Характеристикой влияния дополнительных ионов является ионная сила раствора электролита.
В реальных системах в присутствии диполей воды и дополнительных электролитов энергия ионных взаимодействий не превышает 12 — 20 кДж/моль, хотя может сильно возрастать в локальной области микроорганической фазы белковой молекулы.
При известной функции потенциальной энергии U(r) электростатические взаимодействия могут быть детально проанализированы. Теоретически в аналитической форме значение l рассчитано для двух случаев — для бесконечно разбавленных растворов электролитов и для растворов электролитов, подчиняющихся предельному закону Дебая — Хюккеля.
Бесконечно разбавленные растворы электролитов. В растворах электролитов при бесконечном разбавлении потенциальная энергия взаимодействия заряженных частиц описывается законом Кулона.
Влияние общего заряда белковой глобулы. Анализ электростатических эффектов не учитывает воздействие на ферментативную реакцию общего заряда белковой глобулы. При исследовании ферментативной реакции в условиях, близких к изоэлектрической точке белка, этим эффектом действительно можно пренебречь.
Однако при проведении реакции вдали от изоэлектрической точки в условиях, когда белковая глобула несет большой заряд, влияние общего заряда глобулы может быть весьма значительным.
Предполагалось, что общий заряд белка можно представить равнодействующим зарядом, локализованным в центре сферической глобулы. Диэлектрические свойства среды считались постоянными по всему объему и характеризовались диэлектрической проницаемостью. В рассматриваемом приближении предполагалось также, что потенциальная энергия взаимодействия заряженных частиц не зависит от угловых характеристик и взаимодействие зарядов имеет линейный характер.
Влияние заряда глобулы может быть весьма значительным. Если субстрат заряжен и реакция проводится вдали от изоэлектрической точки, можно ожидать увеличения или уменьшения энергии взаимодействия примерно на два порядка.
Важно отметить, что электростатические взаимодействия являются ненаправленными в отличие, например, от водородной связи.
Ослабление электростатического взаимодействия при высоких концентрациях солей часто используют в препаративной химической энзимологии. Например, выделение белков в большинстве случаев включает стадию осаждения белков концентрированным раствором электролита, часто сульфата аммония. При этом в первую очередь происходит нейтрализация зарядов белковых молекул и агрегация белка.
Ионная связь и её свойства
Важнейшими свойствами ионной связи являются её прочность, ненасыщенность, ненаправленность.
Ионная связь весьма прочная. Так, например, энергия разрыва связи К— Сl равна 426,1 кДж/моль, связи Li—F — 577,3 кДж/моль, Na—Сl — 411,3 кДж/моль.
Ненасыщенность её объясняется тем, что вокруг заряженной частицы — иона создаётся сферическое электромагнитное поле.
Притяжение противоположно заряженных ионов в сферическом поле происходит во всех направлениях, поэтому ионная связь является ненаправленной.
Вы познакомились с ковалентной (неполярной и полярной) и ионной химическими связями. Природа их одинакова — электрическая. Она связана с электрическим взаимодействием электронов и ядер атомов.
Чем больше разность между значениями ОЭО атомов, тем выше степень ионности их соединения. Связи с разностью ОЭО больше 2,1 можно отнести к ионным (более 50% ионности).
Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
Чисто ионной связи практически не существует. Отсюда деление химической связи на типы — ковалентная и ионная также условно.
Ионы • Катионы • Анионы • Ионная связь • Ионные соединения