чем обезвредить кислоту серную
Как нейтрализовать кислоту содой
H2SO4 – вещество, способное растворяться в воде и выделять при этом большое количество тепла. Его 100-процентная концентрация при температуре больше +10 С затвердевает и становится кристаллической массой. Раствор используют в фармакологии и медицине, для диагностики желудочных заболеваний.
Но при всех её удивительных способностях, серная кислота способна нанести немалый урон или причинить ожог. Как распространённая сода способна помочь в нейтрализации?
О серной кислоте побольше
Данное вещество — это результат взаимодействия воды с серой. Два атома водорода и кислотный остаток составляют его формулу. Интересно, что способность растворяться в воде без нейтрализации давно используется в промышленности, когда нужно осушить газ.
Кислота забирает на себя воду, оставляя газ нетронутым (за исключением случаев, когда с ним реагирует). При соприкосновении с углеводами тоже происходит необычное – раствор их обугливает. Это объясняется химически: происходит реакция, где углевод отдаёт водород и кислород, а остаётся уголь.
Как кислота, раствор H2SO4 реагирует с метиловым оранжевым, перекрашивая его в красный. Она способна окислять практически все металлы, кроме:
Реакция нейтрализации
Сама реакция представляет собой взаимодействие основания и кислоты. Обязательным условием является образование воды и кислотной соли. Чем менее сильная кислота, тем больше воды выделяется.
Нейтрализацию часто используют в лабораториях, чтобы выяснить объём жидкости, нужный для реакции. То есть, если известна концентрация раствора, необходимо провести реакцию, постепенно добавляя второй компонент.
Предельное количество добавляемого компонента, при котором будет проходить реакция используют для проведения расчётов.
Действует такая формула: кислоту нейтрализуют щёлочью и наоборот. Ионное уравнение часто будет выглядеть подобным образом:
Каждая реакция нейтрализации может быть обратимой или необратимой в зависимости от компонентов – распадаются ли они при реакции. Необратимым считается взаимодействие сильных кислот и оснований, но остальные сочетания веществ будут распадаться.
Сода – слабая щёлочь, а это обуславливает обратимость реакции независимо от того, насколько концентрированной будет H2SO4. Когда же возникает необходимость нейтрализовать это агрессивное вещество?
Зачем необходимо нейтрализовать
Взаимодействие соды и серной кислоты
Сода – слабая щёлочь, которая используется для гашения лимонной кислоты, уксусной и серной, в том числе. NaHCO3 вступает в гомогенную реакцию с ними, обмениваясь атомами. Вот как выглядит уравнение для концентрированной серной кислоты:
Происходит вот что: формируется кислотный остаток, выделяется углекислый газ и вода. Оксид водорода появляется из-за взаимодействия карбонат ионов соли и водорода. Оба вида ионов образуются в процессе диссоциации кислоты. Разбавленная H2SO4 требует меньшего количества соды:
Что образуется при взаимодействии
Кислотный остаток уже не так опасен, как исходный компонент. Интересно, что именно реакции с выделением углекислого газа сода обязана добавлением её в хлеб – углекислый газ, выделяющийся из-за взаимодействия с молочной кислотой, поднимает тесто и делает в нём пузырьки.
Примерно также происходит реакция нейтрализации: основание вступает в реакцию с H2SO4 и выделяется углекислый газ. Поэтому, чтобы этот химический опыт не превратился в плачевный жизненный, следует проводить его в проветриваемом помещении.
К вопросу о том, сколько соды необходимо для нейтрализации H2SO4. Если взять 1 часть кислоты, пригодится 1 часть щёлочи для реакции с ней, то есть соотношение будет 1:1. Но концентрированная кислота требует больше соды, здесь соотношение увеличится до 1:2. Раствор соды необходим 3%.
Кроме того, если необходимо оказать помощь при ожоге кислотой, то готовится раствор соды в очень приблизительном количестве: 1 чайная ложка щёлочи и на 2,5 стакана воды. Насколько эффективна реакция? В этом помогут разобраться отзывы тех, кто с ней часто сталкивается.
Отзывы
Автолюбители прекрасно знают, что электролит в аккумуляторе содержит 30-35% серной кислоты (если плотность 1,26). Чтобы его утилизировать они используют именно пищевую соду. На всю жидкость уходит 1,5 пачки соды. Положительным отзывом этот способ нейтрализации обязан стоимости соды и её доступности – щелочь легко можно приобрести в продуктовом магазине.
На форумах можно найти другой способ нейтрализации, с помощью силиката натрия. Он имеет право на существование, но сода в этом случае имеет бесспорное преимущество: в результате реакции с силикатом натрия выпадает осадком кремневая кислота, которую, увы, очень сложно вымыть. Результат реакции с содой – появляется карбонат ионов соли, безопасный и легко смываемый, что обуславливает большое количество положительных отзывов.
Очень интересный вопрос был обнаружен на одном из форумов. Он касался выпечки: в ней есть сода, которая теоретически может реагировать с желудочным соком (H2SO4). В результате должна образоваться в желудке соль, а вся проблема в том, что человек сидел на бессолевой диете. Пользователи успокоили волнующегося, что для реакции нейтрализации необходимо большое количество соды, а в выпечке она измеряется маленькими ложками.
Среди отзывов можно найти немало полезных советов: сыпать щёлочь лучше понемногу, чтобы пена не выходила из узкой пробирки струёй, перед утилизацией раствора разводить его дополнительно водой и проводить реакцию в проветриваемом помещении. Таким образом опасная H2SO4 не причинит вреда, если её правильно утилизировать содой.
Инструкция по нейтрализации отработанной серной кислоты аккумуляторных батарей
Утверждаю:
Директор ООО » »
_______________ В.В.Иванов
« ____ » ____________ 2015г.
Инструкция
по нейтрализации отработанной серной кислоты аккумуляторных батарей (2 класса опасности).
1. Общие требования безопасности.
При сборе, хранении, нейтрализации отработанной серной кислоты от аккумуляторных батарей следует учитывать особенности ее эксплуатации и степень опасности.
Природные воды имеют нейтральную, слабокислую или слабощелочную реакцию, рН их находится в пределах 6.5 — 8,5. Электролит имеет кислую рН среду и представляет собой серную кислоту плотностью 1,2 — 1,27. Аккумуляторная серная кислота является достаточно концентрированной и не подлежит утилизации без предварительной нейтрализации.
Растворы серной кислоты оказывают вредное воздействие на организм человека.
При нагревании серной кислоты образуются пары сернистого ангидрида, которые, соединяясь с парами воздуха, образуют кислотный туман. При вдыхании паров серной кислоты раздражаются и прижигаются слизистые оболочки верхних дыхательных путей.
При попадании на кожу серная кислота вызывает сильные ожоги, болезненные и трудно поддающиеся лечению. Попадание серной кислоты в глаза грозит потерей зрения.
Персонал, занятый нейтрализацией аккумуляторной серной кислоты, должен работать в одежде из кисло-защитной ткани, прорезиненных фартуках, резиновых сапогах, резиновых кислостойких перчатках, защитных очках или щитках из оргстекла, иметь фильтрующий противогаз марки В.
Места сбора и нейтрализации аккумуляторной серной кислоты должны иметь предупредительные надписи.
2. Требования безопасности перед началом работы.
Получить инструктаж от ответственного за нейтрализацию, о мерах безопасности и производственной санитарии при работе с аккумуляторной серной кислотой.
Подготовить и проверить исправность защитных средств, приспособлений и другого инвентаря. Следует иметь в виду, что любые разбавленные растворы серной кислоты, к которым относится и электролит, крайне • агрессивны. Вследствие этого нейтрализацию электролита необходимо проводить с максимально возможной быстротой и без перерывов.
Разработал руководитель экологической службы организации_____________
Согласовано:
Инженер по охране труда _______________________________
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Что делать при ожоге серной кислотой
Ожог серной кислотой – опасная химическая травма, часто приводящая к летальному исходу. Маслянистая жидкость без запаха и цвета относится к сильным окислителям. При контакте со слизистыми оболочками и кожными покровами моментально разрушает клетки эпителия. Вдыхание испарений кислоты приводит к ларингиту, бронхиту, геморрагической пневмонии. Степень повреждения тканей зависит от процентного содержания реагента в растворе. Принципы лечения ожогов едкими кислотами отличаются от мер, к которым прибегают при химических травмах другими веществами.
Чем опасен ожог серной кислотой
Ожоги от серной кислоты чреваты глубоким поражением мягких и костных тканей. Попадание реагента на кожу приводит к:
При контакте с кислотой происходит некроз кожи, а в случае поражения больших участков тела наблюдается ожоговый шок. Особенно опасными являются испарения жидкости, которые проникают в органы дыхания. Ожог вызывает сильную боль, внутренние кровотечения. Попадание реагента в глаза в 80% случаев заканчивается частичной или полной потере зрения.
Степени повреждения кожи
Ожоги получают из-за неаккуратного обращения с реагентами на производстве и в быту. Серьезность химической травмы определяется концентрацией кислоты в растворе:
При воздействии вещества на живые ткани разрушается внутриклеточный белок с образованием органических и неорганических соединений – альбумоз, протеиногенных аминокислот, пептонов и т.д.

По глубине повреждений выделяют 4 степени ожогов:
Ожоги едкой кислотой приводят к формированию белой рыхлой корки с четкими границами, которая со временем темнеет. Внешне кажется, что травма поверхностная и не представляет опасности. Но под струпом образуются язвы, а отмирание тканей повышает риск инфекционного воспаления.
Первая помощь при ожоге серной кислотой
Чтобы оказать пострадавшему медицинскую помощь, необходимо иметь представления о свойствах едких кислот. Неправильные действия чреваты углублением ожога, опасными для жизни осложнениями. В определенных ситуациях нельзя даже находиться рядом с потерпевшим без средств защиты – респиратора, резиновых перчаток, защитных очков. Вдыхание испарений серной кислоты приводит к разрушению слизистых оболочек дыхательных путей.
Первая помощь при ожогах серной кислотой предполагает:
При обширных ожогах проводят противошоковые и дезинтоксикационные мероприятия, которые направлены на уменьшение токсического действия химического вещества на организм.
При повреждении кожи
Алгоритм оказания доврачебной помощи при попадании реагента на кожные покровы включает в себя такие шаги:
В завершение накладывают стерильную повязку и вызывают на дом врача или отправляются в больницу.
При попадании в глаза
Попадание серной кислоты на слизистую глаза или роговицу чревато слепотой. Чтобы предупредить такие осложнения, следует:
После оказания экстренной помощи вызывают специалиста или отправляются в ожоговый центр. Дальнейшая терапия определяется офтальмологом в зависимости от глубины проникновения реактива в глаз.
При поражении слизистой оболочки рта и пищевода
Наибольшую опасность для жизни представляют ожоги слизистой ЖКТ, желудка, пищевода. Случайный прием более 5 мг вещества приводит к летальному исходу.

При повреждении внутренних органов необходимо:
Чтобы предотвратить еще большее поражение ЛОР-органов, в комнате открывают окна для поступления свежего воздуха. Промывание желудка эффективно только в первые 5-6 часов после получения травмы.
Категорически нельзя провоцировать рвоту, так как это чревато разрывом пищевода.
Дальнейшее восстановление
Едкая кислота редко вызывает поверхностные травмы, не требующие госпитализации. Необходимо обратить к врачу, если:
Местной терапией ограничиваются при повреждении только поверхностных слоев кожи. Обычно в схему лечения включаются:
Для антисептической обработки пораженных участков используют раствор коллоидного серебра. При пузырьковых высыпаниях и отторжении тканей накладывают повязки с такими препаратами:
Ожоги кислотой 3 степени опасны гнойными осложнениями. В случае заражения раны кокковой инфекцией используют Мирамистин, Хлоргексидин. При обширных поражениях проводится системная противомикробная терапия полусинтетическими пенициллинами, аминогликозидами или цефалоспоринами – Гентамицином, Цефуроксимом, Амоксициллином, Уназином и т.д.
Разрушение базального слоя кожи является показанием к оперативному вмешательству. Метод хирургического лечения зависит от степени и обширности повреждений – ампутация, кожная пластика. Даже после успешного лечения кислота оставляет заметные рубцы в виде подтеков.
При ожоге ЖКТ проводится бужирование на 7 день после начала терапии. Суть процедуры заключается во введении в пищевод дилататоров – трубок разного диаметра. Они препятствуют уменьшению просвета пищевода и рубцеванию слизистой.
Опасные осложнения
Разрушающее воздействие кислоты обусловлено обезвоживанием тканей, расщеплением в них белковых компонентов. Последствия определяются концентрацией едкого вещества, его объемом и длительностью контакта с кожей или слизистыми. Высокоактивная кислота сразу же провоцирует глубокие ожоги с обугливанием тканей.
К возможным осложнениям химической травмы относят:
Если вовремя не оказать пострадавшему помощь, это приведет к отказу почек или печени. В 93% случаев такие осложнения заканчиваются летальным исходом. В зону риска входят пациенты с пиелонефритом, циррозом печени, гломерулонефритом и т.д. Химически активная жидкость провоцирует отсроченные осложнения. В 7% случаев на месте рубцов возникает плоскоклеточный рак.
Меры предосторожности во время работы с химическими агентами
Ожоги едкими кислотами в 67% случаев встречаются у людей, работающих на химических производствах. Чтобы минимизировать риск травмы, нужно соблюдать технику безопасности при работе с концентрированными окислителями:
Химические вещества нельзя хранить на одной полке с продуктами или лекарствами. Кислота должна быть недоступна для детей.
Прогноз выживаемости
Серьезность травмы определяется концентрацией реагента, локализацией ожога. Прогноз заживления определяют по правилу сотни – суммируют проценты ожоговой площади по отношению к сохранившимся тканям с возрастом пострадавшего:
Прогноз выздоровления зависит от локализации ожоговых ран, глубины проникновения реагента. Исход химической травмы ухудшается при ожоговом шоке, интоксикации. Ожоги концентрированными кислотами сопровождаются продолжительным воспалением. Во время заживления в очагах поражения образуется много грануляционной ткани. Поэтому у обожженных возникают заметные рубцы, которые ограничивают подвижность суставов.
Регенерация отработанной серной кислоты
Крупными потребителями серной кислоты являются химическая и нефтехимическая промышленность, металлургия, машиностроение, сельское хозяйство и другие отрасли промышленности.
Ежегодно порядка 10% от общего ее производства становится отработанной серной кислотой.
Необходимо утилизировать сотни тысяч т отработанной кислоты с целью экономного ресурсопользования и защиты окружающей среды.
Отходы, образующиеся при использовании серной кислоты, включают кроме отработанной серной кислоты травильные растворы, кислые гудроны и сточные воды, содержащие кислоту менее 10 % (по массе).
В России насчитывается более 200 видов отработанной серной кислоты, содержащих около ста видов примесей, в том числе аккумуляторная кислота из отработанных свинцовых аккумуляторов.
Обезвреживание и утилизацию отработанной серной кислоты производят следующими способами:
— нейтрализацией растворов или их огневым обезвреживанием без использования образующихся продуктов;
-использованием (возможно после предварительного упаривания) загрязненных растворов в других технологических процессах;
— регенерацией отходов с получением товарной серной кислоты.
Сточные воды с низкой концентрацией серной кислоты обычно нейтрализуют щелочами.
При содержании в сточных водах примесей нейтрализацию совмещают с огневым методом. Метод нейтрализации применяют при небольших количествах отходов и отсутствии в них органических примесей.
Непосредственное использование отходов кислоты в других процессах ограничено из-за наличия в них примесей.
Отработанную кислоту применяют после очистки и концентрирования в производстве сульфатных минеральных удобрений.
Основная масса отработанной серной кислоты и кислых гудронов подвергается регенерации.
В зависимости от состава отработанной кислоты применяют различные методы регенерации: термическое расщепление, экстрагирование органических примесей, адсорбцию, каталитическое окисление пероксидом водорода, коагулирование, выпаривание и тд.
Для концентрирования серной кислоты применяются 2 типа установок:
— с внешним обогревом;
— с непосредственным соприкосновением греющих газов с кислотой.
В них происходит обогрев кислоты через стенку в аппаратах колонного типа, установки вакуум- аппаратов и установки Дюпон пленочного типа.
Суть процесса концентрирования в таких аппаратах заключается в дроблении кислоты на капли благодаря потоку горячего газа.
Оба вида технологий получения концентрированной серной кислоты имеют как положительные, так и отрицательные стороны.
Большим преимуществом установок с внешним обогревом является отсутствие или минимальное количество тумана серной кислоты, образующейся в результате работы концентраторов второго типа, а также получения серной кислоты с крепостью до 98%.
Но при концентрировании серной кислоты, например, в ретортах до 96% крепости и выше, происходит их быстрое изнашивание из-за высокой температуры кипения серной кислоты, которая достигает 300°С.
При высоких температурах увеличивается испарение и разложение серной кислоты, что ведет к потере количества и качества серной кислоты.
Эти недостатки устранены в установках Майснера, где концентрирование происходит под вакуумом.
Установки Майснера более компактны по сравнению с ретортными установками Паулинга.
Установки с колоннами Майснера занимают менее 40% площади, требующейся для установки реторт Паулинга.
Недостаток установки Майснера:
— малая производительность (выход составляет до 13-15 т/сут).
— растрескивание ферросилидовых царг, проявляющееся в процессе эксплуатации данной установки, а также нарушение уплотнения между царгами.
— необходимость строительства котельных для выработки водяного пара, применяемого в колоннах.
Установки Майснера могутт быть применены только в случаях необходимости концентрирования небольших количеств серной кислоты и для получения при этом серной кислоты высокой концентрации (до 98%).
Установки Дюпон решают проблема растрескивания ферросилидовых материалов и проблему появления неплотностей, путем применения нагревательных труб и метода стекающей пленки.
В установках Дюпон применено новое техническое решение в виде монтажа оборудования с учетом механических и термических напряжений ферросилида, на катках или на пружинных подвесках.
Преимущества: простота устройства, исполнения и обслуживания. Установки по производительности относятся к числу средних, достигая до 25 т/сутки.
Недостатки установок Дюпон:
— загрязнение внутренних поверхностей труб с течением времени, что приводит к снижению их теплопропускной способности,
— необходимость их периодической прочистки и промывки труб с применением большого количества воды.
Преимущества установок Кесслера:
— значительно облегчена передача тепла от топочных газов к серной кислоте,
— концентрируемая кислота не доводится до точки кипения, а большая, открытая поверхность контакта газа и кислоты максимизирует интенсивность процесса массопередачи и теплопередачи,
— возможность работать на любом местном виде топлива: газообразном, жидком, твердом, что значительно увеличивает сырьевые возможности безостановочного перехода с одного вида топлива в случае необходимости на другой.
Недостатки установок Кесслера:
— необходимость периодической чистки рекуператора с выгрузкой насадки,
— большая потеря СК с отходными газами, что составляет порядка 2-2,5%.
Более перспективны концентраторы барабанного типа.
— концентрирование производится путем барботажа горячих газов через упариваемую кислоту, как в слое кислоты, так и в зоне брызг, где на поверхности капель происходит хорошая теплопередача.
—лучшее использование тепла и переработка большого количества кислоты.
До настоящего времени они считались наиболее удобными, экономичными и практичными для концентрирования серной кислоты.
Работают на мазуте и газе.
— необходимость в поддержании строгого температурного режима топочных газов, так как увеличение его даже на 10 °С довольно быстро разрушает барботажные трубы 1 й камеры концентратора и увеличивают потери кислоты из-за ее термического разложения, которые составляют 10-15% от общего количества.
Скоростные концентраторы, в которых потоком горячего газа жидкость преимущественно разбивается на мельчайшие капли. Для создания такого процесса концентрирования серной кислоты в капельном состоянии используют аппараты Вентури.
В России наибольшее распространение получила регенерация серной кислоты огневым методом, при котором происходит высокотемпературное расщепление кислоты.
Метод универсален и высокоэффективен.
При огневом методе используется концентрированная серная кислота, поэтому при необходимости предварительно проводят упаривание отработанной кислоты до необходимой концентрации.
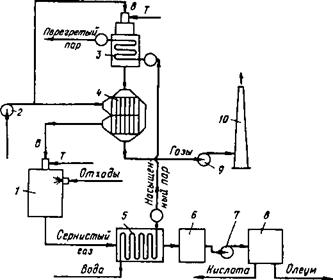
Процесс термического расщепления кислоты и окисление органических. примесей проводят при 950-1200 °С, для чего в огневом реакторе сжигают топливо (рис 1).
Сернокислотные растворы с помощью форсунок распыляют в потоке продуктов сгорания топлива в огневом реакторе 1.
Туда же с помощью воздуходувки 2 подается воздух, предварительно пропущенный через воздухоподогреватель 4.
Органические примеси при этом окисляются с образованием С02 и Н20, а серная кислота расщепляется с образованием SО2
Очищенные дымовые газы с помощью дымососа 9 выбрасываются в атмосферу через дымовую трубу 10.
Огневая регенерация серной кислоты из отходов позволяет одновременно с их обезвреживанием получать товарную продукцию высокого качества.
Это приводит к сокращению расходов природного сырья и снижению затрат на производство серной кислоты на 25-30 % по сравнению с ее производством из первичного сырья (элементарной серы).
Для рентабельной регенерации серной кислоты из рассматриваемых отходов необходимо их предварительное обезвоживание (концентрирование).
В связи с отсутствием в отходах летучих веществ концентрирование можно осуществить методом упаривания в контактных теплообменниках за счет теплоты отходящего из огневого реактора сернистого газа.
При этом одновременно происходит закалка газа.
Содержание воды в упаренном растворе зависит от температуры отходящих из огневого реактора газов и от содержания воды в исходном растворе.
Если в исходном растворе имеется 60-70 % воды, то после упаривания его отходящими газами с температурой 950-1000 °С содержание воды снижается до 35- 40 %.
Сильно разбавленные растворы, содержащие более 80 % воды, после упаривания содержат ее не более 60 %. При огневой переработке таких растворов с целью получения сернистого газа с содержанием 802 не менее 6 % в качестве топлива используют серу или сероводород, а также обогащают кислородом дутьевой воздух.
Для более полного превращения S03 в S02 в огневом реакторе целесообразно 2-ступенчатое сжигание топлива.
В 1й ступени термическое расщепление серной кислоты и сульфатов осуществляется в восстановительной газовой среде (в продуктах неполного горения топлива), а во 2й ступени происходит дожигание продуктов неполного горения за счет подачи вторичного воздуха.
Если травильные растворы не загрязнены различными примесями, получаемый оксид железа применяется в производстве красителей, активных катодных масс, ферритных порошков, полирующих паст и т д.
Загрязненный оксид железа используется как металлургическое сырье.
В процессе регенерации травильных сернокислотных растворов образуется сульфат железа, который можно использовать непосредственно без дополнительной обработки как ядохимикат, а также для мелиорации почв и очистки сточных вод. Этот продукт может использоваться после соответствующей переработки как сырье для получения серы и оксида железа.
Существуют методы переработки сульфата железа в сернистый газ (а следовательно, в серную кислоту).
Разработана технология получения серной кислоты путем одновременного сжигания сульфата железа и серы в реакторе с кипящим слоем.
Процесс проводят при температуре 900-1000 °С. Образующиеся в процессе сжигания пульпы, состоящей из сульфата железа и серы, продукты сгорания (сернистый газ и вода) подвергаются очистке от пыли, охлаждаются до 290-300 °С и направляются на получение серной кислоты по классической схеме.