чем обезболить спайки кишечника
Университет
Николай Сивец, заведующий хирургическим отделением 6-й ГКБ Минска, доктор мед. наук, профессор кафедры военно-полевой хирургии БГМУ:
— Спаечной болезнью называют патологические состояния, связанные с образованием спаек в брюшной полости при ряде заболеваний, при травматических повреждениях внутренних органов, в т. ч. при операционной травме. Относится к числу еще не решенных проблем абдоминальной хирургии. В большинстве случаев — неизбежный брак именно хирургии, а не хирурга. Врач, спасая больного от одного смертельного заболевания, вынужденно способствует возникновению нового.
Большой вклад в изучение спаечной болезни внес Н. И. Пирогов, первым в России выполнивший операцию под эфирным наркозом по поводу странгуляционной тонкокишечной непроходимости. В 1914 году немецкий хирург Эрвин Пайр опубликовал 157 случаев спаек брюшной полости после различных вмешательств и впервые поставил вопрос о необходимости профилактики развития спаек. Исследования продолжили В. А. Оппель, Ю. М. Дедерер, В. А. Блинов.
С развитием хирургии шире становился диапазон операций. Чаще возникали и болезненные состояния, обозначаемые как спайки, спаечная непроходимость, спаечная болезнь. Изучение процесса спайкообразования показало, что болезненные состояния, сопровождающие образование спаек, дают значительные варианты клинических проявлений, обозначаемых симптомокомплексом спаечной болезни. Установлено: в основе спаечного процесса лежат нарушения функции брюшины, связанные с гипоксией, развивающейся вследствие длительного воспалительного процесса, что приводит к нарушению ее фибринолитической функции (А. Н. Дубяга, 1987; Р. А. Женчевский, 1989; D. M. Scott-Combes, 1995; J. N. Thompson, 1995; S. A. Whawell, 1995).
Наличие спаек приводит к снижению качества жизни, хроническим болям в животе, бесплодию у женщин, угрожает кишечной непроходимостью. По данным ряда авторов, 1% перенесших операции на органах брюшной полости ежегодно лечатся от спаечной болезни. Внутрибрюшные сращения после манипуляций хирурга на органах брюшной полости возникают в 80–90% случаев. Частота развития рецидива острой спаечной непроходимости кишечника — 30–69%, повторные операции усугубляют состояние и приводят к летальным исходам в 13–55% случаев.
Существует множество классификаций спаечной болезни, однако в практической работе чаще всего применяется классификация по Д. П. Чухриенко.
Масштабы спаечного процесса — от тотального до образования отдельных тяжей, фиксированных в двух точках. Как правило, спаечный процесс сильнее выражен в зоне операции. Часто петли кишок припаиваются к послеоперационному рубцу или фиксируются к стенкам послеоперационного грыжевого мешка.
Клинические проявления — от незначительных болей в животе до тяжелых форм острой кишечной непроходимости. Одна из основных жалоб — постоянная боль по всему животу без четкой локализации. Также отмечаются тошнота, нередко рвота, вздутие живота, урчание в кишечнике, затруднение отхождения газов и стула, желудочно-кишечный дискомфорт. Имеют место функциональные расстройства со стороны других органов, вовлеченных в спаечный процесс. При спаечной болезни с преобладанием болевого синдрома характерных изменений показателей периферической крови, функций печени, органов ЖКТ обычно не наблюдается.
Для установления диагноза «спаечная болезнь» необходимо провести рентгенологическое обследование ЖКТ, т. к. наличие лапаротомий в анамнезе еще не говорит о присутствии спаек в брюшной полости. Рентгенодиагностика основывается на обнаружении деформаций, необычной фиксации, сращений с брюшной стенкой в полипозиционном исследовании.
Лапароскопия до недавнего времени была противопоказана из-за высокого риска повреждения внутренних органов. Сейчас ее применяют при спаечной болезни как с диагностической, так и с лечебной целью.
Нередко эффективной в плане диагностики оказывается фиброколоноскопия.
Лабораторные данные не дают ничего патогномоничного.
Лечение трудное: никогда нельзя быть уверенным, что лапаротомия, произведенная при спаечной болезни, ликвидирует причины, вызвавшие спаечный процесс.
Вмешательства чаще выполняются по экстренным показаниям. В плановом порядке оперируются пациенты с хронической обтурационной и рецидивирующей спаечной непроходимостью.
В сложной ситуации оказывается хирург при наличии плотного конгломерата кишечных петель. Рациональным будет наложение выключающего обходного анастомоза; радикальным, оптимальным для больного — резекция всего конгломерата.
Самая серьезная проблема — рецидивирующая спаечная непроходимость кишечника, собственно спаечная болезнь.
Операции различны — в зависимости от характера сращений и вида кишечной непроходимости. Наиболее частая — разделение спаек. Плоскостные спайки, вызывающие перегибы, перетяжки, образование двустволок, рассекают. Соединительнотканные тяжи иссекают у места их прикрепления. Десерозированные поверхности на кишке перитонизируют путем наложения узловых швов на стенку кишки. При рубцовых спайках, деформирующих петли кишок без нарушения питания стенки, обычно накладывают обходные анастомозы между петлями тонких кишок, между тонкой и толстой кишкой, реже — между отделами толстой.
Важен выбор доступа. Многих оперируют не по разу — передняя брюшная стенка у них с рубцами. Поэтому лучшим доступом большинство хирургов считает нижнесрединную лапаротомию, которая при необходимости может быть расширена кверху. Доступ через старый операционный рубец чреват вскрытием просвета кишки.
Разрезы передней брюшной стенки должны быть достаточными. Брюшину не следует грубо захватывать и вытягивать на края раны; салфетки, введенные в брюшную полость, не фиксировать к брюшине. Необходимо избегать обширной эвентрации кишечных петель и высыхания висцеральной брюшины, их покрывающей. Кишечные петли укрывать влажными салфетками, смоченными изотоническим раствором хлорида натрия. Во время операции нужен тщательный гемостаз, а излившаяся кровь должна быть своевременно эвакуирована. Важно предупреждать попадание на париетальную и висцеральную брюшину растворов йода, спирта, масел, мелких инородных тел, сухих антибиотиков.
Случай из практики
Больной К., 55 лет. Врач по специальности. Обратился в хирургическое отделение 6-й ГКБ Минска в плановом порядке для консультации с направительным диагнозом «спаечная болезнь брюшной полости с эпизодами кишечной непроходимости». Жалуется на периодическое вздутие живота, приступы болей последние 3 месяца, тошноту, задержку отхождения газов и стула.
В 1971 году в возрасте 10 лет оперирован по поводу острого деструктивного аппендицита с разлитым перитонитом. Проведена аппендэктомия, брюшная полость дренирована. Через 2 недели повторно оперирован в связи с развившейся ранней послеоперационной спаечной кишечной непроходимостью. Выполнена лапаротомия, спайки разделены.
Спустя 10 лет оперирован в одной из клиник Минска по поводу острой спаечной кишечной непроходимости: лапаротомия, спайки рассечены, кишечная непроходимость ликвидирована. Через год в другой клинике снова оперирован по поводу острой спаечной кишечной непроходимости. Имел место массивный спаечный процесс в брюшной полости. Войти в полость удалось только путем иссечения внутренних листков влагалищ прямых мышц живота в мезогастрии.
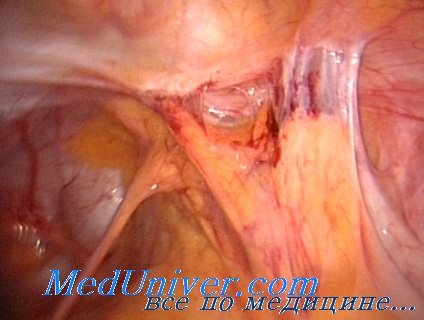
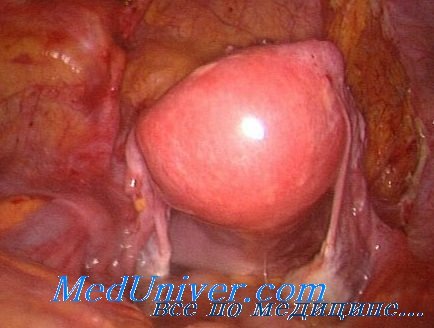
При ревизии органов брюшной полости выявлено массивное распространение спаек по петлям тонкого и толстого кишечника с вовлечением в процесс большого сальника, париетальной и висцеральной брюшины. В правой половине брюшной полости обнаружен конгломерат из петель тонкого кишечника, слепой, восходящей и правой половины поперечно-ободочной кишки. Попытка выделить петли кишечника из конгломерата безуспешна. Операция завершена наложением обходного илеотрансверзоанастомоза «бок в бок».
Пациент выписан по выздоровлению. Около 20 лет выраженных симптомов нарушения пассажа по кишечнику не было.
Медленное ухудшение началось приблизительно 3 года назад, в течение последних 6 месяцев — интенсивное. Задержка стула и газов на 2–3 дня стала постоянным явлением. Пациент отказался от твердой и грубой пищи, стал есть мало. За 2 месяца до обращения в 6-ю ГКБ Минска принимал только жидкую пищу — часто, небольшими порциями. Для обеспечения пассажа по кишечнику менял положение тела и массировал переднюю брюшную стенку. Началось похудание, снижение работоспособности. В последние 3 недели рацион включал жидкие супы, детские гомогенизированные смеси и жидкий шоколад.
При первичном осмотре — пациент c пониженным питанием, однако без признаков истощения. Кожа обычной окраски, суховатая. Легкие, сердце — без особенностей. Живот не вздут. Имеются рубцы после аппендэктомии и верхнесреднесрединной лапаротомии. При пальпации живот мягкий, слабо болезненный в мезогастрии. По правому боковому каналу определяется инфильтрат без четких границ. Симптомы раздражения брюшины отрицательные.
Клинический диагноз при поступлении: «спаечная болезнь брюшной полости с хроническим нарушением пассажа по кишечнику».
Общеклинические анализы пациента без существенных отклонений.
На рентгенограмме легочные поля без видимых инфильтративных изменений. Усилен, обогащен легочной рисунок в прикорневых отделах, корни малоструктурные, несколько расширены. Сердце не расширено. Аорта уплотнена, развернута.
Выполнена фиброколоноскопия, к которой пациент во избежание острой спаечной кишечной непроходимости готовился сам в течение 2 дней (отказ от питания и питья; ни фортранс, ни очистительные клизмы не применялись). Проблем для осмотра кишечника при колоноскопии не возникло. Эндоскоп введен в купол слепой кишки. Просвет кишки обычный. В нем до печеночного угла незначительное количество промывных вод. Стенки кишки эластичны. Перистальтика, складки не изменены. Слизистая оболочка блестящая, розовая. Сосудистый рисунок в норме. Баугиниева заслонка хорошо выражена. Интубирован терминальный отдел подвздошной кишки. Просвет обычный, на слизистой уплощенные эрозии под фибрином. В просвете восходящей кишки большое количество сформированных каловых масс. В поперечно-ободочной кишке широкое устье илеотрансверзоанастомоза. Эндоскоп проведен в отводящую кишку на глубину 40–50 см. Просвет обычный. На слизистой множественные плоские эрозии на грани изъязвлений, под фибрином. Биопсия (3 фрагмента). Интубирована приводящая кишка на глубину до 35 см (без особенностей).
Заключение: состояние после наложения илеотрансверзоанастомоза (функционирует). Диффузный эрозивный илеит отводящей кишки (болезнь Крона?).
Рентгенологическое исследование кишечника с пассажем сернокислого бария решено не выполнять, дабы не спровоцировать острую спаечную кишечную непроходимость. Клиническая картина и данные колоноскопии достаточные для принятия обоснованного решения о выполнении хирургического вмешательства в плановом порядке.
Пациент оперирован под эндотрахеальным наркозом. Иссечен старый операционный рубец. Верхнесрединная лапаротомия с обходом пупка слева. Свободная брюшная полость как таковая отсутствует. Массивный спаечный процесс после предыдущих операций. К передней брюшной стенке на всем протяжении операционного рубца «вмурованы» петли тонкого кишечника, поскольку брюшина передней брюшной стенки была удалена на предыдущей операции. С техническими трудностями выполнена мобилизация проксимального отдела тонкой кишки. Кишка имеет ригидную стенку, диаметр около 6 см. Выявлено, что в 150 см от трейцевой связки имеется илеотрансверзоанастомоз. Дальнейшая мобилизация позволила установить в области илеотрансверзоанастомоза конгломерат петель тонкого кишечника. Конгломерат разделен, однако сами петли тонкого кишечника со стороны слепой кишки рубцово изменены и признаны функционально несостоятельными. Пальпаторно определяется стриктура отводящего сегмента илеотрансверзоанастомоза. Прослежен ход тонкой кишки от трейцевой связки до илеотрансверзоанастомоза. Последний наложен антиперистальтически.
По правому боковому каналу имеется конгломерат петель тонкого кишечника, не разделенный на предыдущей операции. Попытка его разделения оказалась безуспешной. В результате тщательной ревизии установлено, что причиной нарушения пассажа по тонкой кишке являются множественные ее спайки и перегибы, конгломерат кишечных петель по правому боковому каналу, а также стриктура илеотрансверзоанастомоза. Спайки, насколько это возможно, разъединены. Петли кишечника расправлены по левой половине брюшной полости. Справа разделить петли тонкого кишечника без их повреждения нереально. Показана правосторонняя гемиколэктомия. Единым блоком мобилизован конгломерат кишечных петель, включающий около 80 см рубцово-измененной, со спайками подвздошной кишки, слепую, восходящую и правую половину поперечно-ободочной кишки с илеотрансверзоанастомозом. Правосторонняя гемиколэктомия выполнена. Сформирован изоперистальтический илеотрансверзоанастомоз «конец в конец» двухрядным швом. Анастомоз проходим, наложен без натяжения. Ушито «окно» в брыжейке кишечника. Частично восстановлена целостность брюшины правого бокового канала. Дренажная трубка по правому боковому каналу и в малый таз, а также по левому боковому каналу. Брюшная полость осушена. Рана передней брюшной стенки послойно ушита с наложением механического кожного шва. Повязка. Длительность операции — 9 часов 15 минут.
Макропрепарат: рубцово-измененные петли тонкого кишечника (около 80 см подвздошной кишки), слепая, восходящая и половина поперечно-ободочной с илеотрансверзоанастомозом общей длиной около 140 см.
Гистологическое заключение: фрагменты тонкой и толстой кишок с десквамацией эпителия в просвете, геморрагиями, очаговыми некробиотическими изменениями слизистого слоя толстой кишки, скудной лимфолейкоцитарной инфильтрацией в слизистом и подслизистом слоях. Со стороны серозы — разрастание фиброзной ткани с неоангиогенезом, лейкоцитарной инфильтрацией. В краях резекции — аналогичные изменения. Брыжейка с полнокровными сосудами, лимфатическими узелками с синусовым гистиоцитозом, участками фиброзной ткани.
Заключительный клинический диагноз: хроническая спаечная болезнь брюшной полости с тотальным спаечным процессом и нарушением пассажа по кишечнику. Рубцовая стриктура илеотрансверзоанастомоза.
Операция: лапаротомия, ликвидация спаечного процесса, правосторонняя гемиколэктомия с резекцией илеотрансверзоанастомоза и формированием нового илеотрансверзоанастомоза «конец в конец».
Послеоперационный период протекал гладко, дренажи удалены на 3-и–4-е сутки, рана зажила первичным натяжением. Пациент выписан с выздоровлением. Стул на день выписки и позже — 3 раза в сутки. Признаков нарушения пассажа по кишечнику в ближайшем послеоперационном периоде не отмечается.
1. Операции при длительно протекающей спаечной болезни органов брюшной полости с хроническим нарушением пассажа по кишечнику предпочтительнее проводить в плановом порядке, в дневное время, подготовленной хирургической бригадой.
2. Во избежание повреждения петель тонкого кишечника лучшим доступом следует считать нижнесрединную лапаротомию, которая при необходимости может быть расширена кверху.
3. Рационально накладывать выключающий обходной анастомоз; радикальный, оптимальный для больного вариант — резекция всего конгломерата.
4. Оперируя пациента со спаечной болезнью, необходимо соблюдать ряд известных мер, предупреждающих рецидив спайкообразования.
Медицинский вестник, 18 июля 2016
Чем обезболить спайки кишечника
Помимо использования микрохирургических и обычных хирургических методов, были предложены новые способы предотвращения и уменьшения развития спаек: применение интраоперационных устройств и соответствующих медикаментов.
При использовании барьерных методов в профилактике спаек необходимо отличать участок повреждения от других участков. Неизвестно, обеспечивает ли применение физических барьеров защиту от спаек на смежных участках. Доказано, что спайки могут развиваться на неповрежденных перитонеальных участках и что лапаротомия по срединной линии вызывает перитонеальную воспалительную реакцию. Следовательно, физический барьер, примененный к одному участку, не может предотвратить образования спаек во всей брюшной полости. Его действие распространяется только на участке действия барьера.
Существует несколько классов барьеров, применяемых для профилактики спаек. Предложенные подходы обладают одним или несколькими механизмами действияя:
• Уменьшение образования фибрина (противосвертывающие и противовоспалительные средства, такие как глюкокортикоиды и НПВС).
• Уменьшение содержания фибрина (перитонеальный лаваж жидкостями и ферментативное расщепление фибринолитическими средствами, такими как урокиназа и рекомбинантный активатор плазминогена).
• Механическое разделение травмированных поверхностей (в брюшную полость нагнетают жидкость с большой молекулярной массой, а также применение механических барьеров, таких как интерсид, хирургическая мембрана гор-текс и сепрафильм).
• Косвенные механизмы воздействия:
— повышение кишечной подвижности для предотвращения образования спаек;
— в настоящее время продолжается изучение других препаратов, влияющих на воспалительный ответ — мелатонина, биоразрушаемых полимеров и других иммуномодуляторов;
— антибиотики для устранения инфекции.
Некоторые вещества и материалы применяют на практике. Они относительно дороги, стоимость каждого из них составляет 100-300 долларов США. Хотя много написано о практическом использовании этих средств, экономическая выгода их применения для системы здравоохранения остается неизвестной.
Важно подчеркнуть тот факт, что подтверждением необходимости профилактики спаек являются многочисленные экспериментальные исследования различных способов предотвращения послеоперационных интраперитонеальных спаек, возникающих после пластики маточных труб и других связанных с бесплодием операций. Кроме того, большинство клинических исследований, связанных с профилактикой спаек у людей, описано в литературе по бесплодию, а не по гинекологической онкологии. Отношение этих исследований к профилактике спаек до конца не ясно, однако вспомогательные факторы, эффективные в профилактике спаек в одних случаях (хирургия бесплодия), могут также быть эффективными в других (обширная гинекологическая хирургия).
Данное предположение еще не подтвердилось, но оно может оказаться ложным, если возникнут различия в метаболических, гемостатических и инфекционных параметрах обширной хирургии и хирургии бесплодия. Кроме того, такие процедуры, как лизис спаек, не вызывают серьезных повреждений основных структур по сравнению с радикальными действиями, после которых может возникнуть обширная перитонеальная травма.
Описанные хирургические вспомогательные факторы предотвращения спаек не использовали после радикальной тазовой хирургии, поэтому данный вопрос остается неизученным. После перитонеального повреждения процесс заживления может протекать вполне нормально. В зависимости от степени деструкции ткани, связанной с радикальным воздействием, развитие спаек может быть физиологическим, а не патологическим.
Активация фибринолитической системы полезна в профилактике интраабдоминальных спаек. В конце 19-го столетия применяли средства с потенциальными фибринолитическими свойствами: раствор тиосинамина и салицилата натрия и препараты фосфора внутрь. Стрептокиназа и стрептодорназа были первыми средствами с доказанными фибринолитическими свойствами. Опыты на кроликах и крысах показали эффективность данных средств в предотвращении развития спаек. Значение активации фибринолитической системы у человека остается недоказанной.
Активатор плазминогена для профилактики спаек. Тканевой активатор плазминогена, главный его активатор, применяли для профилактики спаек. Однако, несмотря на эффективность, использование активатора сопровождалось риском возникновения кровотечения. Противосвертывающие средства (препараты гепарина) также эффективны в профилактике спаек, но способны вызвать кровотечение.
Механическое разделение поврежденных поверхностей. В прошлом десятилетии было разработано несколько механических барьеров. Для предотвращения развития спаек используют мембраны из оксидной восстановленной целлюлозы, модифицированную гиалуроновую кислоту с карбоксиметилцеллюлозой или политетрафтороэтилен. Во всех случаях эпителизация наступает своевременно (>7 дней). Johns провел обзор литературы по профилактике послеоперационных спаек. Он выделил три средства для профилактики послеоперационных спаек: интерсид, сепрафильм и хирургическая мембрана гор-текс. Наибольшая эффективность достигается непосредственно на участке применения.
У всех трех есть ограничения. Хирургическая мембрана гор-текс не резорбируется. Ее либо удаляют хирургическим путем, либо оставляют на долгое время. интерсид и сепрафильм разлагаются микроорганизмами, а также имеют определенные практические ограничения. Данные методы несовместимы с лапароскопией.
В последнее время для уменьшения спаек стали применять 4% раствор икодекстрина, представляющий собой полученный из кукурузного крахмала водный растворимый разветвленный полимер декстрозы (глюкозы*). Его применяют интраперитонеально в течение 3-4 дней.
Гиалуронан для профилактики спаек. Исследования показали, что средства на основе гиа-луронана предотвращают развитие спаек после операции. Его действие основано на уменьшении образования интраабдоминальных спаек при сепсисе. Эффективность и безопасность таких средств, как модифицированная гиалуронан-карбоксиметилцеллюлозная биорассасывающая мембрана и 0,4% раствор гиалуронана, были доказаны клинически. Однако только мембрана была одобрена Американским управлением по контролю за продуктами и медикаментами.
Натрия лактата раствор сложный [калия хлорид+кальция хлорид+натрия хлорид+натрия лактат] (Рингер лактат) для профилактики спаек. Эффективность гидрофлотации (использования больших объемов изотонических растворов, таких как изотонический раствор натрия хлорида и Рингер лактат) в предотвращении послеоперационных спаек не была проверено в рандомизированных исследованиях. Однако метаанализ показал недостаточную эффективность кристаллоидов. Эффективность кристаллоидов низка из-за быстрой их абсорбции. Большинство кристаллоидов всасывается со скоростью 30-60 мл/ч.
Однако проведены исследования по удержанию кристаллоидов в перитонеальной жидкости. После инсталляции 300 мл раствора Рингер лактата через 48 ч в брюшной полости находилось еще 78 мл. У пациентов в контрольной группе, где инстилляцию этого раствора не проводили, остаточный объем составил 30 мл. Через 96 ч между этими двумя группами не было никакого различия. Однако этого времени недостаточно, чтобы оказать определенный эффект на процесс формирования спаек.
Нарушение равновесия между синтезом фибрина и его деградацией приводит к образованию фибриновых спаек. Происходит врастание фибробластов, и последующее депонирование коллагена заканчивается формированием постоянных фиброзных спаек. Лечение галофугиноном, ингибитором синтеза коллагена типа 1, уменьшает развитие экспериментально вызванных хирургических спаек, но клинически этот факт еще не доказан.
Также исследовали способность противовоспалительных препаратов (глюкокортикоидов и ингибиторов синтетазы простагландина) предотвращать образование спаек. Однако подавление воспалительной реакции дало противоречивые результаты. Swolin успешно применял введение глюкокортикоидов в брюшную полость, другие авторы о данном методе отзывались с сомнением.
32% раствор декстрана [ср. мол. масса 64 000-76 000] (декстран 70*) в профилактике спаек. Этот препарат был одобрен Американским управлением по контролю за продуктами и медикаментами для введения в брюшную полость с целью ее растяжения во время операционной гистероскопии. Однако рандомизированные исследования дали противоречивые результаты в случае применения препарата для уменьшения спаек. У некоторых пациентов применение препарата вызвало аллергическую реакцию, что заметно уменьшило интраабдоминальное использование декстрана 70 в гинекологической восстановительной хирургии.
Кратко о современном состоянии проблемы спаек и спаечной болезни:
• Перитонеальные спайки чаще встречают у пациентов (55%), перенесших операцию на органах таза.
• Брюшина состоит из одного слоя мезотелиальных клеток, который позволяет жидкости свободно перемещаться.
• Причиной возникновения спаек могут быть различные события, происходящие во время хирургической операции (проникновение инфекции или инородного тела).
• Эти события нарушают процесс фибринолиза, необходимый для профилактики спаек.
• Мезотелиальные клетки начинают покрывать поврежденную область брюшины на 3-й день.
• Преобладающий тип клеток, содержащихся в перитонеальной жидкости к 4-7-му дню, — макрофаги.
• Гелевая фибриновая матрица, образовавшаяся после повреждения тканей, на 5-8-й день превращается в спайку.
• Спайки становятся причиной бесплодия, хронической боли и обструкции тонкой кишки.
• Спайки также создают проблемы во время последующих хирургических вмешательств, особенно при вхождении в брюшную полость. Это увеличивает время операции.
• Хирургическими методами профилактики образования спаек являются деликатная работа с тканями, гемостаз, минимизация воздействия инородных тел (в том числе шов) и уменьшение ишемии при помощи ирригации.
• Кристаллоидные растворы не препятствуют образованию спаек, как предполагали раньше, так как они быстро всасываются (со скоростью 35-65 мл/ч), то есть до того, как перитонеальная поверхность полностью восстановится и покроется мезотелием (процесс занимает около 8 дней).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021