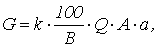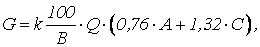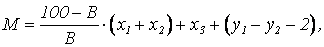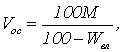чем нейтрализуется серная кислота
Как нейтрализовать кислоту содой
H2SO4 – вещество, способное растворяться в воде и выделять при этом большое количество тепла. Его 100-процентная концентрация при температуре больше +10 С затвердевает и становится кристаллической массой. Раствор используют в фармакологии и медицине, для диагностики желудочных заболеваний.
Но при всех её удивительных способностях, серная кислота способна нанести немалый урон или причинить ожог. Как распространённая сода способна помочь в нейтрализации?
О серной кислоте побольше
Данное вещество — это результат взаимодействия воды с серой. Два атома водорода и кислотный остаток составляют его формулу. Интересно, что способность растворяться в воде без нейтрализации давно используется в промышленности, когда нужно осушить газ.
Кислота забирает на себя воду, оставляя газ нетронутым (за исключением случаев, когда с ним реагирует). При соприкосновении с углеводами тоже происходит необычное – раствор их обугливает. Это объясняется химически: происходит реакция, где углевод отдаёт водород и кислород, а остаётся уголь.
Как кислота, раствор H2SO4 реагирует с метиловым оранжевым, перекрашивая его в красный. Она способна окислять практически все металлы, кроме:
Реакция нейтрализации
Сама реакция представляет собой взаимодействие основания и кислоты. Обязательным условием является образование воды и кислотной соли. Чем менее сильная кислота, тем больше воды выделяется.
Нейтрализацию часто используют в лабораториях, чтобы выяснить объём жидкости, нужный для реакции. То есть, если известна концентрация раствора, необходимо провести реакцию, постепенно добавляя второй компонент.
Предельное количество добавляемого компонента, при котором будет проходить реакция используют для проведения расчётов.
Действует такая формула: кислоту нейтрализуют щёлочью и наоборот. Ионное уравнение часто будет выглядеть подобным образом:
Каждая реакция нейтрализации может быть обратимой или необратимой в зависимости от компонентов – распадаются ли они при реакции. Необратимым считается взаимодействие сильных кислот и оснований, но остальные сочетания веществ будут распадаться.
Сода – слабая щёлочь, а это обуславливает обратимость реакции независимо от того, насколько концентрированной будет H2SO4. Когда же возникает необходимость нейтрализовать это агрессивное вещество?
Зачем необходимо нейтрализовать
Взаимодействие соды и серной кислоты
Сода – слабая щёлочь, которая используется для гашения лимонной кислоты, уксусной и серной, в том числе. NaHCO3 вступает в гомогенную реакцию с ними, обмениваясь атомами. Вот как выглядит уравнение для концентрированной серной кислоты:
Происходит вот что: формируется кислотный остаток, выделяется углекислый газ и вода. Оксид водорода появляется из-за взаимодействия карбонат ионов соли и водорода. Оба вида ионов образуются в процессе диссоциации кислоты. Разбавленная H2SO4 требует меньшего количества соды:
Что образуется при взаимодействии
Кислотный остаток уже не так опасен, как исходный компонент. Интересно, что именно реакции с выделением углекислого газа сода обязана добавлением её в хлеб – углекислый газ, выделяющийся из-за взаимодействия с молочной кислотой, поднимает тесто и делает в нём пузырьки.
Примерно также происходит реакция нейтрализации: основание вступает в реакцию с H2SO4 и выделяется углекислый газ. Поэтому, чтобы этот химический опыт не превратился в плачевный жизненный, следует проводить его в проветриваемом помещении.
К вопросу о том, сколько соды необходимо для нейтрализации H2SO4. Если взять 1 часть кислоты, пригодится 1 часть щёлочи для реакции с ней, то есть соотношение будет 1:1. Но концентрированная кислота требует больше соды, здесь соотношение увеличится до 1:2. Раствор соды необходим 3%.
Кроме того, если необходимо оказать помощь при ожоге кислотой, то готовится раствор соды в очень приблизительном количестве: 1 чайная ложка щёлочи и на 2,5 стакана воды. Насколько эффективна реакция? В этом помогут разобраться отзывы тех, кто с ней часто сталкивается.
Отзывы
Автолюбители прекрасно знают, что электролит в аккумуляторе содержит 30-35% серной кислоты (если плотность 1,26). Чтобы его утилизировать они используют именно пищевую соду. На всю жидкость уходит 1,5 пачки соды. Положительным отзывом этот способ нейтрализации обязан стоимости соды и её доступности – щелочь легко можно приобрести в продуктовом магазине.
На форумах можно найти другой способ нейтрализации, с помощью силиката натрия. Он имеет право на существование, но сода в этом случае имеет бесспорное преимущество: в результате реакции с силикатом натрия выпадает осадком кремневая кислота, которую, увы, очень сложно вымыть. Результат реакции с содой – появляется карбонат ионов соли, безопасный и легко смываемый, что обуславливает большое количество положительных отзывов.
Очень интересный вопрос был обнаружен на одном из форумов. Он касался выпечки: в ней есть сода, которая теоретически может реагировать с желудочным соком (H2SO4). В результате должна образоваться в желудке соль, а вся проблема в том, что человек сидел на бессолевой диете. Пользователи успокоили волнующегося, что для реакции нейтрализации необходимо большое количество соды, а в выпечке она измеряется маленькими ложками.
Среди отзывов можно найти немало полезных советов: сыпать щёлочь лучше понемногу, чтобы пена не выходила из узкой пробирки струёй, перед утилизацией раствора разводить его дополнительно водой и проводить реакцию в проветриваемом помещении. Таким образом опасная H2SO4 не причинит вреда, если её правильно утилизировать содой.
Чем обработать металл после кислоты?
Недавно проводил эксперимент по удалению ржавчины с суппортов соляной кислотой. Удаляет очень хорошо даже глубокую ржавчину.
Саму кислоту смывал содовым раствором (промывал около 10 минут в нем).
Но, к сожалению, практически на глазах опять стала появляться ржавчина.
Как я понимаю, это «проделки» этой самой соляной кислоты, которая хоть и удаляет ржавчину, но при этом и провоцирует ее скорейшее появление вновь.
То есть сода или не гасит ее, или гасит плохо, или есть еще какие-то причины повторного быстрого появления ржавчины.
Видя это, я обильно запшикал суппорта ВД-шкой. Немного помогло, но не на 100%.
В связи с этим вопрос:- Чем обрабатывать металл после травления ржавчины в соляной кислоте, чтобы не происходило повторного активного окисления металла?
Комментарии 34
Соляной больше ниче не делай около авто, испортишь резинки проводку и т.д. Бери ортофосфорную, она делает тоже самое лучше и не трогает резинки, проводку, и многое другое.
Думал найду тут ответ, а не тут то было!
У меня таже беда, тока мне приходится снова и снова на неё наскакивать, никуда не деться результат мощный, а вот труда много…Именно поэтому вы никогда не услышите от маляра, что надо цинкарем обработать кузов))))
Я использую ортофосфорную кислоту, в канистрах 30 литров 70 процентную…
1.Сначала пескоструй, после пескоструя местами на метале есть вкрапление они рыжие(долбить пескоструем вечно же не будешь каждую раковинку).А красить такой метал тоже преступление.
2. навожу 35%…Нанеся ортофосфорную через минут 20 на жаре все вкрапления становится черными, голая рама пенится, становится липкой,
3. вот в этот момент наношу пену с керхера, и смываю обильно…Следом за керхером при смывании рама становится желтой. Если все удачно и я вижу при смывании белый метал с вкраплениями черными, то иду на завершение если нет то повторяю,
повторюсь главное не дать кислоте высохнуть, иначе её заново нужно будет размачивать высохщую кислоту опять кислотой…
4.Последним этапом после счмывки керхером, наношу 8% ортофосфорную ксилоту, метал из желтого становится белым или черноватым(по разному)…
5.Теперь не давая высыхать смываю 646 растворителем, 646 растворить втираю китью(руки горят защитные перчатки разлазятся ппц полный, на данном этапе, смывать до тех пор пока растворитель не начнет засыхать, если кислота не смылась, то растворитель не испаряется)…Красить по кислоте или цинкарю нельзя!(под грунтом если будет кислота, образуется вода, этого достаточно чтобы под краской метал сгнил!)
6.Затем втираю обежириватель кисточкой, и тока тогда на финишную выхожу и наношу кислотный грунт!
Этот метод жопа полная, вы должны быть уверены что вам это надо, на каждом этапе результат может быть такой, что кажется нафига я это делал…
Во всей этой процедуре самый тяжелый шаг это пятый, с маленькими деталями нет проблем, а с большими растворителя потратите на миллион! и на крем потом детский и неделю руки будут облазить, перчатки внатуре одни за одними даже устойчивые к растворителю разлазятся.
Вот бы найти дешевую альтернативу, для смыва кислоты, чтобы бочку 200 литров не жалко было вылить, подал на керхер и пошел купать раму. а так 646 растворитель 90 рублей литр, сильно не намоешь, легче повторно отпескоструить. Насчет керхера я пошутил, но в нагнетатель 10 литровый, я бы заправил.
А да вода с содой! Это вапще трындец! маленькие детали нет проблем, когда все можно ополоснуть и быстро обежирить, а большие тока гемора хапнешь. После воды с содой ржавеет быстро, тока ещё соду надо смывать)))
Что делать при ожоге серной кислотой
Ожог серной кислотой – опасная химическая травма, часто приводящая к летальному исходу. Маслянистая жидкость без запаха и цвета относится к сильным окислителям. При контакте со слизистыми оболочками и кожными покровами моментально разрушает клетки эпителия. Вдыхание испарений кислоты приводит к ларингиту, бронхиту, геморрагической пневмонии. Степень повреждения тканей зависит от процентного содержания реагента в растворе. Принципы лечения ожогов едкими кислотами отличаются от мер, к которым прибегают при химических травмах другими веществами.
Чем опасен ожог серной кислотой
Ожоги от серной кислоты чреваты глубоким поражением мягких и костных тканей. Попадание реагента на кожу приводит к:
При контакте с кислотой происходит некроз кожи, а в случае поражения больших участков тела наблюдается ожоговый шок. Особенно опасными являются испарения жидкости, которые проникают в органы дыхания. Ожог вызывает сильную боль, внутренние кровотечения. Попадание реагента в глаза в 80% случаев заканчивается частичной или полной потере зрения.
Степени повреждения кожи
Ожоги получают из-за неаккуратного обращения с реагентами на производстве и в быту. Серьезность химической травмы определяется концентрацией кислоты в растворе:
При воздействии вещества на живые ткани разрушается внутриклеточный белок с образованием органических и неорганических соединений – альбумоз, протеиногенных аминокислот, пептонов и т.д.

По глубине повреждений выделяют 4 степени ожогов:
Ожоги едкой кислотой приводят к формированию белой рыхлой корки с четкими границами, которая со временем темнеет. Внешне кажется, что травма поверхностная и не представляет опасности. Но под струпом образуются язвы, а отмирание тканей повышает риск инфекционного воспаления.
Первая помощь при ожоге серной кислотой
Чтобы оказать пострадавшему медицинскую помощь, необходимо иметь представления о свойствах едких кислот. Неправильные действия чреваты углублением ожога, опасными для жизни осложнениями. В определенных ситуациях нельзя даже находиться рядом с потерпевшим без средств защиты – респиратора, резиновых перчаток, защитных очков. Вдыхание испарений серной кислоты приводит к разрушению слизистых оболочек дыхательных путей.
Первая помощь при ожогах серной кислотой предполагает:
При обширных ожогах проводят противошоковые и дезинтоксикационные мероприятия, которые направлены на уменьшение токсического действия химического вещества на организм.
При повреждении кожи
Алгоритм оказания доврачебной помощи при попадании реагента на кожные покровы включает в себя такие шаги:
В завершение накладывают стерильную повязку и вызывают на дом врача или отправляются в больницу.
При попадании в глаза
Попадание серной кислоты на слизистую глаза или роговицу чревато слепотой. Чтобы предупредить такие осложнения, следует:
После оказания экстренной помощи вызывают специалиста или отправляются в ожоговый центр. Дальнейшая терапия определяется офтальмологом в зависимости от глубины проникновения реактива в глаз.
При поражении слизистой оболочки рта и пищевода
Наибольшую опасность для жизни представляют ожоги слизистой ЖКТ, желудка, пищевода. Случайный прием более 5 мг вещества приводит к летальному исходу.

При повреждении внутренних органов необходимо:
Чтобы предотвратить еще большее поражение ЛОР-органов, в комнате открывают окна для поступления свежего воздуха. Промывание желудка эффективно только в первые 5-6 часов после получения травмы.
Категорически нельзя провоцировать рвоту, так как это чревато разрывом пищевода.
Дальнейшее восстановление
Едкая кислота редко вызывает поверхностные травмы, не требующие госпитализации. Необходимо обратить к врачу, если:
Местной терапией ограничиваются при повреждении только поверхностных слоев кожи. Обычно в схему лечения включаются:
Для антисептической обработки пораженных участков используют раствор коллоидного серебра. При пузырьковых высыпаниях и отторжении тканей накладывают повязки с такими препаратами:
Ожоги кислотой 3 степени опасны гнойными осложнениями. В случае заражения раны кокковой инфекцией используют Мирамистин, Хлоргексидин. При обширных поражениях проводится системная противомикробная терапия полусинтетическими пенициллинами, аминогликозидами или цефалоспоринами – Гентамицином, Цефуроксимом, Амоксициллином, Уназином и т.д.
Разрушение базального слоя кожи является показанием к оперативному вмешательству. Метод хирургического лечения зависит от степени и обширности повреждений – ампутация, кожная пластика. Даже после успешного лечения кислота оставляет заметные рубцы в виде подтеков.
При ожоге ЖКТ проводится бужирование на 7 день после начала терапии. Суть процедуры заключается во введении в пищевод дилататоров – трубок разного диаметра. Они препятствуют уменьшению просвета пищевода и рубцеванию слизистой.
Опасные осложнения
Разрушающее воздействие кислоты обусловлено обезвоживанием тканей, расщеплением в них белковых компонентов. Последствия определяются концентрацией едкого вещества, его объемом и длительностью контакта с кожей или слизистыми. Высокоактивная кислота сразу же провоцирует глубокие ожоги с обугливанием тканей.
К возможным осложнениям химической травмы относят:
Если вовремя не оказать пострадавшему помощь, это приведет к отказу почек или печени. В 93% случаев такие осложнения заканчиваются летальным исходом. В зону риска входят пациенты с пиелонефритом, циррозом печени, гломерулонефритом и т.д. Химически активная жидкость провоцирует отсроченные осложнения. В 7% случаев на месте рубцов возникает плоскоклеточный рак.
Меры предосторожности во время работы с химическими агентами
Ожоги едкими кислотами в 67% случаев встречаются у людей, работающих на химических производствах. Чтобы минимизировать риск травмы, нужно соблюдать технику безопасности при работе с концентрированными окислителями:
Химические вещества нельзя хранить на одной полке с продуктами или лекарствами. Кислота должна быть недоступна для детей.
Прогноз выживаемости
Серьезность травмы определяется концентрацией реагента, локализацией ожога. Прогноз заживления определяют по правилу сотни – суммируют проценты ожоговой площади по отношению к сохранившимся тканям с возрастом пострадавшего:
Прогноз выздоровления зависит от локализации ожоговых ран, глубины проникновения реагента. Исход химической травмы ухудшается при ожоговом шоке, интоксикации. Ожоги концентрированными кислотами сопровождаются продолжительным воспалением. Во время заживления в очагах поражения образуется много грануляционной ткани. Поэтому у обожженных возникают заметные рубцы, которые ограничивают подвижность суставов.
Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
каустическая
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
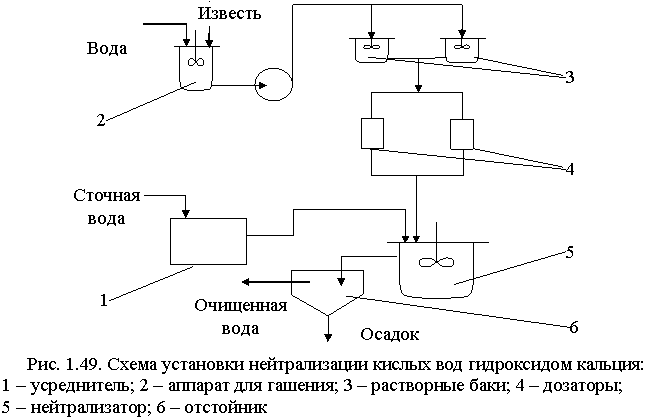
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.